WikiDer > Сульфид бора - Википедия
 | |
| Имена | |
|---|---|
| Название ИЮПАК Сульфид бора | |
| Другие имена Сесквисульфид бора, диборон трисульфид | |
| Идентификаторы | |
3D модель (JSmol) | |
| ECHA InfoCard | 100.031.355 |
| Номер ЕС |
|
PubChem CID | |
| |
| |
| Характеристики | |
| B2S3 | |
| Молярная масса | 117,80 г / моль |
| Внешность | бесцветные кристаллы |
| Плотность | 1,55 г / см3, твердый |
| Температура плавления | 563 ° С (1045 ° F, 836 К) |
| Точка кипения | разлагается при высоких T |
| разлагается | |
| Растворимость | растворим в аммиак |
| Структура | |
| моноклинический, mP40, SpaceGroup = P21/ с, №14 | |
| B: планарный, sp2 | |
| Термохимия | |
Теплоемкость (C) | 111,7 Дж / моль К |
Стандартный моляр энтропия (S | 327 Дж / моль К |
Станд. Энтальпия формирование (ΔжЧАС⦵298) | -240,6 кДж / моль |
| Опасности | |
| Главный опасности | источник H2S |
| Родственные соединения | |
Родственные соединения | BCl3 Реактив Лавессона |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Сульфид бора это химическое соединение с формула B2S3. Этот полимерный материал представляет интерес как компонент «высокотехнологичных» стекол и как реагент для получения сероорганических соединений. Подобно сульфидам кремния и фосфора, B2S3 реагирует с водой, включая атмосферную влагу, с выделением ЧАС2S. Таким образом, образцы должны обрабатываться в безводных условиях.
Как и оксиды бора, B2S3 легко формирует очки при смешивании с другими сульфидами, такими как п4S10. Такие очки поглощают более низкие частоты Инфракрасный энергия относительно обычных боросиликатный очки.
B2S3 обращает кетоны в соответствующий тионы. Например, преобразование бензофенон к его тиону действует следующим образом:
- B
2S
3 + 3 (C
6ЧАС
5)
2C = O → B
2О
3 + 3 (C
6ЧАС
5)
2C = S
На практике B2S3 будет использоваться в избытке.[1]
Синтез
Среди других методов диборон трисульфид может быть получен реакцией железа или марганца. борид с сероводород при температуре 300 ° С.[2]
- 2 февраля + 4 часа2S → B2S3 + FeS + 4 H2
Первый синтез был сделан Йенс Якоб Берцелиус в 1824 г. путем прямой реакции аморфного бор с сера пар.[3]
- 2 Б + 3 S → B2S3
Другой синтез был одобрен Фридрих Вёлер и Анри Этьен Сент-Клер Девиль впервые опубликовано в 1858 г., начиная с бора и сероводород.[4][5]
- 2 спальни + 3 квартиры2S → B2S3 + 3 часа2
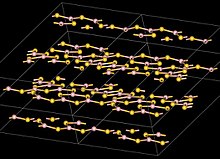
Структура
Атомы бора в B2S3 тригонально плоские и расположены в B3S3 и B2S2 кольца с мостиковыми атомами S образуют слоистую структуру с межслоевым расстоянием 355 мкм. Это отличается от триоксид бора который имеет трехмерную структуру.[6]
Молекулярная, мономерная форма B2S3 имеет плоскую V-образную форму с центральным углом B-S-B приблизительно 120 °.[6]
Рекомендации
- ^ Сато, Р. (2004). «Трисульфид бора». В Л. Пакетте (ред.). Энциклопедия реагентов для органического синтеза, 8 томов. Энциклопедия реагентов для органического синтеза. Нью-Йорк: J. Wiley & Sons. Дои:10.1002 / 047084289X.rb255. ISBN 0471936235.
- ^ Хоффманн, Дж. (1908). "Synthese von Borsulfid aus Ferro- und Manganbor". Zeitschrift für anorganische Chemie. 59 (1): 127–135. Дои:10.1002 / zaac.19080590116.
- ^ Берцелиус, Дж. (1824). "Undersökning af flusspatssyran och dess märkvärdigaste föreningar" [Исследование плавиковой кислоты и ее наиболее примечательных соединений]. Kongliga Vetenskaps-Academiens Handlingar [Труды Королевской академии наук]. 12: 46–98.
Перепечатано на немецком языке как:
Берцелиус, Дж. Дж. (1824). "Untersuchungen über die Flußspathsäure und deren merkwürdigsten Verbindungen". Annalen der Physik und Chemie. 78 (10): 113–150. Дои:10.1002 / andp.18240781002. особенно см. стр. 145–147. - ^ Вёлер, Ф.; Deville, H. E. S.-C. (1858). "Neue Beobachtungen über das Bor und einige seiner Verbindungen" [Новые наблюдения относительно бора и некоторых его соединений]. Liebigs Annalen der Chemie und Pharmacie. 105 (1): 67–73. Дои:10.1002 / jlac.18581050109.
- ^ Вёлер, Ф.; Deville, H. E. S.-C. (1858). "Du Bore". Annales de Chimie et de Physique. 52: 62–93.
- ^ а б Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-08-037941-8.