WikiDer > Модуль связывания углеводов
| CBM_1 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 трехмерные структуры трех сконструированных целлюлозосвязывающих доменов целлобиогидролазы i из trichoderma reesei, ЯМР, 18 структур | |||||||||
| Идентификаторы | |||||||||
| Символ | CBM_1 | ||||||||
| Pfam | PF00734 | ||||||||
| ИнтерПро | IPR000254 | ||||||||
| PROSITE | PDOC00486 | ||||||||
| SCOP2 | 1цел / Объем / СУПФАМ | ||||||||
| CAZy | CBM1 | ||||||||
| |||||||||
| CBM_2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 структура раствора целлюлозного связывающего домена из Cellulomonas fimi с помощью спектроскопии ядерного магнитного резонанса | |||||||||
| Идентификаторы | |||||||||
| Символ | CBM_2 | ||||||||
| Pfam | PF00553 | ||||||||
| Pfam клан | CL0203 | ||||||||
| ИнтерПро | IPR001919 | ||||||||
| PROSITE | PDOC00485 | ||||||||
| SCOP2 | 1exg / Объем / СУПФАМ | ||||||||
| CAZy | CBM2 | ||||||||
| |||||||||
| CBM_3 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 кристаллическая структура семейства iiia cbd из clostridium cellulolyticum | |||||||||
| Идентификаторы | |||||||||
| Символ | CBM_3 | ||||||||
| Pfam | PF00942 | ||||||||
| Pfam клан | CL0203 | ||||||||
| ИнтерПро | IPR001956 | ||||||||
| SCOP2 | 1nbc / Объем / СУПФАМ | ||||||||
| CAZy | CBM3 | ||||||||
| |||||||||
| CBM_5 / 12 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 взаимодействия хитиназы семейства 18 с разработанным ингибитором hm508 и продуктом его разложения, хитобионо-дельта-лактон | |||||||||
| Идентификаторы | |||||||||
| Символ | CBM_5_12 | ||||||||
| Pfam | PF02839 | ||||||||
| ИнтерПро | IPR003610 | ||||||||
| SCOP2 | 1ed7 / Объем / СУПФАМ | ||||||||
| CAZy | CBM12 | ||||||||
| |||||||||
| CBM_6 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 cbm6ct из Clostridium thermocellum в комплексе с ксилопентаозой | |||||||||
| Идентификаторы | |||||||||
| Символ | CBM_6 | ||||||||
| Pfam | PF03422 | ||||||||
| Pfam клан | CL0202 | ||||||||
| ИнтерПро | IPR005084 | ||||||||
| SCOP2 | 1 гмм / Объем / СУПФАМ | ||||||||
| CAZy | CBM6 | ||||||||
| |||||||||
| CBM_4 / 9 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
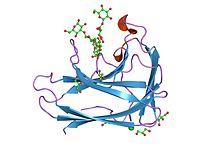 структура и функции cbm4 | |||||||||
| Идентификаторы | |||||||||
| Символ | CBM_4_9 | ||||||||
| Pfam | PF02018 | ||||||||
| Pfam клан | CL0202 | ||||||||
| ИнтерПро | IPR003305 | ||||||||
| SCOP2 | 1 целлюлоза / Объем / СУПФАМ | ||||||||
| CAZy | CBM22 | ||||||||
| |||||||||
| CBM_10 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 структура раствора типа x м.б. | |||||||||
| Идентификаторы | |||||||||
| Символ | CBM_10 | ||||||||
| Pfam | PF02013 | ||||||||
| ИнтерПро | IPR002883 | ||||||||
| SCOP2 | 1qld / Объем / СУПФАМ | ||||||||
| CAZy | CBM10 | ||||||||
| |||||||||
| CBM_11 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 семейство 11 углеводсвязывающий модуль целлюлосомной целлюлазы lic26a-cel5e Clostridium thermocellum | |||||||||
| Идентификаторы | |||||||||
| Символ | CBM_11 | ||||||||
| Pfam | PF03425 | ||||||||
| Pfam клан | CL0202 | ||||||||
| ИнтерПро | IPR005087 | ||||||||
| CAZy | CBM11 | ||||||||
| |||||||||
| CBM_14 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Символ | CBM_14 | ||||||||
| Pfam | PF01607 | ||||||||
| Pfam клан | CL0155 | ||||||||
| ИнтерПро | IPR002557 | ||||||||
| SCOP2 | 1dqc / Объем / СУПФАМ | ||||||||
| CAZy | CBM14 | ||||||||
| |||||||||
| CBM_15 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 ксилан-связывающий модуль cbm15 | |||||||||
| Идентификаторы | |||||||||
| Символ | CBM_15 | ||||||||
| Pfam | PF03426 | ||||||||
| Pfam клан | CL0202 | ||||||||
| ИнтерПро | IPR005088 | ||||||||
| SCOP2 | 1gny / Объем / СУПФАМ | ||||||||
| CAZy | CBM15 | ||||||||
| |||||||||
| CBM_17 / 28 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 структура модуля связывания углеводов fam17 из Clostridium cellulovorans | |||||||||
| Идентификаторы | |||||||||
| Символ | CBM_17_28 | ||||||||
| Pfam | PF03424 | ||||||||
| Pfam клан | CL0202 | ||||||||
| ИнтерПро | IPR005086 | ||||||||
| SCOP2 | 1g0c / Объем / СУПФАМ | ||||||||
| CAZy | CBM28 | ||||||||
| |||||||||
| Chitin_bind_1 (CBM18) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 анализ кристаллической структуры комплекса сшитый-wga3 / glcnacbeta1,4glcnac | |||||||||
| Идентификаторы | |||||||||
| Символ | Chitin_bind_1 | ||||||||
| Pfam | PF00187 | ||||||||
| ИнтерПро | IPR001002 | ||||||||
| PROSITE | PDOC00025 | ||||||||
| SCOP2 | 1wgt / Объем / СУПФАМ | ||||||||
| CAZy | CBM18 | ||||||||
| |||||||||
| CBM_19 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Символ | CBM_19 | ||||||||
| Pfam | PF03427 | ||||||||
| Pfam клан | CL0155 | ||||||||
| ИнтерПро | IPR005089 | ||||||||
| CAZy | CBM19 | ||||||||
| |||||||||
| CBM_20 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 глюкоамилаза, гранулярный комплекс крахмал-связывающего домена с циклодекстрином, ЯМР, минимизированная средняя структура | |||||||||
| Идентификаторы | |||||||||
| Символ | CBM_20 | ||||||||
| Pfam | PF00686 | ||||||||
| Pfam клан | CL0369 | ||||||||
| ИнтерПро | IPR002044 | ||||||||
| SCOP2 | 1cdg / Объем / СУПФАМ | ||||||||
| CAZy | CBM20 | ||||||||
| |||||||||
| CBM_21 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Символ | CBM_21 | ||||||||
| Pfam | PF03370 | ||||||||
| ИнтерПро | IPR005036 | ||||||||
| CAZy | CBM21 | ||||||||
| |||||||||
| CBM_25 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Символ | CBM_25 | ||||||||
| Pfam | PF03423 | ||||||||
| ИнтерПро | IPR005085 | ||||||||
| CAZy | CBM25 | ||||||||
| |||||||||
| CBM27 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 структурное и термодинамическое разделение специфического распознавания маннана с помощью модуля связывания углеводов, tmcbm27 | |||||||||
| Идентификаторы | |||||||||
| Символ | CBM27 | ||||||||
| Pfam | PF09212 | ||||||||
| ИнтерПро | IPR015295 | ||||||||
| SCOP2 | 1oh4 / Объем / СУПФАМ | ||||||||
| |||||||||
| Chitin_bind_3 (CBM33) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 кристаллическая структура мутанта хитинсвязывающего белка serratia marcescens cbp21 y54a. | |||||||||
| Идентификаторы | |||||||||
| Символ | Chitin_bind_3 | ||||||||
| Pfam | PF03067 | ||||||||
| ИнтерПро | IPR004302 | ||||||||
| CAZy | CBM33 | ||||||||
| |||||||||
| CBM_48 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 кристаллическая структура гликозилтрехалозной трегалогидролазы из sulfolobus solfataricus | |||||||||
| Идентификаторы | |||||||||
| Символ | CBM_48 | ||||||||
| Pfam | PF02922 | ||||||||
| Pfam клан | CL0369 | ||||||||
| ИнтерПро | IPR004193 | ||||||||
| SCOP2 | 1bf2 / Объем / СУПФАМ | ||||||||
| CAZy | CBM48 | ||||||||
| |||||||||
| CBM49 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Символ | CBM49 | ||||||||
| Pfam | PF09478 | ||||||||
| Pfam клан | CL0203 | ||||||||
| ИнтерПро | IPR019028 | ||||||||
| |||||||||
В молекулярной биологии углеводсвязывающий модуль (CBM) - это белковый домен нашел в углевод-активные ферменты (например, гликозидгидролазы). Большинство этих доменов обладают активностью связывания углеводов. Некоторые из этих доменов находятся на целлюлосомный скаффолдин белки. CBM ранее были известны как целлюлоза-связывание доменов.[1] CBM делятся на множество семейств на основе аминокислота сходство последовательностей. В настоящее время (июнь 2011 г.) 64 семейства CBM в базе данных CAZy.[2]
МД микробный гликозидгидролазы играют центральную роль в переработке фотосинтетически фиксированный углерод через их привязка к конкретным растение структурный полисахариды.[3] CBM могут распознавать как кристаллическую, так и аморфную формы целлюлозы.[4] CBM являются наиболее распространенными некаталитическими модулями, связанными с ферменты активен в клеточной стенке растений гидролиз. Многие предполагаемые меры доверия были идентифицированы аминокислотная последовательность выравнивания но экспериментально показано, что только несколько представителей обладают функцией связывания углеводов.[5]
CBM1
Семейство модулей связывания углеводов 1 (CBM1) состоит из 36 аминокислот. Этот домен содержит 4 сохраненных цистеин остатки, которые участвуют в образовании двух дисульфидные связи.
CBM2
Семейство модулей связывания углеводов 2 (CBM2) содержит два консервативных цистеины - по одному на каждом конце домена - которые были показаны [6] быть вовлеченным в дисульфидная связь. Также есть четыре консервированных триптофаны, два из которых участвуют в связывании целлюлозы.[7][8][9]
CBM3
Семейство модулей связывания углеводов 3 (CBM3) участвует в целлюлоза привязка [10] и ассоциируется с широким спектром бактериальный гликозилгидролазы. В структура этого домена известно; он образует бета-бутерброд.[11]
CBM4
Семейство 4 углеводосвязывающих модулей (CBM4) включает два целлюлозосвязывающих домена, CBD (N1) и CBD (N2), расположенных в тандеме на N-конце 1,4-бета-глюканазы, CenC, из Cellulomonas fimi. Эти гомологичные CBM отличаются своей селективностью связывания аморфной и некристаллической целлюлозы.[12] Многомерный гетероядерный ядерный магнитный резонанс (ЯМР) спектроскопия была использована для определения третичная структура из 152 аминокислота N-концевое связывание целлюлозы домен из C. fimi 1,4-бета-глюканаза CenC (CBDN1). Высшее структура CBDN1 поразительно сходен с таковым из бактериальных 1,3-1,4-бета-глюканаз, а также других связывающих сахар белки с желейные складки.[13] CBM4 и CBM9 тесно связаны.
CBM5
Семейство 5 углеводсвязывающих модулей (CBM5) связывает хитин.[14] CBM5 и CBM12 отдаленно связаны.
CBM6
Семейство модулей связывания углеводов 6 (CBM6) необычно тем, что оно содержит два сайта связывания субстрата, щель A и щель B. Cellvibrio mixtus эндоглюканаза 5A содержит два домена CBM6, домен CBM6 на С-конце проявляет различные специфичности связывания лиганда в каждой из субстрат-связывающих щелей. И расщелина А, и щель В могут связывать целлюлозныйолигосахариды, ламинарин предпочтительно связывается в щели A, ксилоолигосахариды связываются только в щели A, и бета1,4, -beta1,3-смешанные связи глюканы связываются только в щели B.[15]
CBM9
Семейство модулей связывания углеводов 9 (CBM9) связывается с кристаллической целлюлозой.[16] CBM4 и CBM9 тесно связаны.
CBM10
Семейство модулей связывания углеводов 10 (CBM10) находится в двух различных наборах белки с разными функциями. Те найдены в аэробные бактерии связывают целлюлозу (или другие углеводы); но в анаэробные грибы они представляют собой белковые связывающие домены, называемые dockerin домены. Считается, что домены докерина ответственны за сборку комплекса мультибелковая целлюлаза / гемицеллюлаза, подобного целлюлосома содержится в некоторых анаэробных бактерии.[17][18]
В анаэробном бактерии которые разрушают стенки растительных клеток, например Clostridium thermocellum, докериновые домены каталитический полипептиды одинаково хорошо связывается с любым когезин из того же организм. Совсем недавно анаэробные грибы, представленные Piromyces equi, было предложено также синтезировать целлюлосомный комплекс, хотя последовательности докерина бактериальный и грибковый ферменты совершенно разные.[19] Например, грибковые ферменты содержат одну, две или три копии докерина. последовательность в тандеме с каталитическим полипептидом. Напротив, все C. термоцелл Каталитические компоненты целлюлосомы содержат единственный домен докерина. Докерины анаэробных бактерий гомологичны EF руки (кальций-связывающие мотивы) и требуют кальция для активности, тогда как докерин грибов не требует кальция. Наконец, взаимодействие между когезином и докерином, по-видимому, разновидность специфичен для бактерий, практически отсутствует видоспецифичность связывания внутри видов грибов и нет идентифицированных участков, которые отличают разные виды.
Докерина из P. equi содержит два спиральный растяжки и четыре короткие бета-нити, которые образуют антипараллельный к структуре листа примыкает дополнительная короткая закрученная параллельная прядь. N- и C-концы примыкают друг к другу.[19]
CBM11
Семейство 11 углеводсвязывающих модулей (CBM11) обнаружено у ряда бактериальных целлюлазы. Одним из примеров является CBM11 Clostridium thermocellum Cel26A-Cel5E, этот домен, как было показано, связывает как β-1,4-глюкан, так и β-1,3-1,4-смешанные глюканы.[20] CBM11 имеет бета-сэндвич-структуру с вогнутой стороной, образующей щель, связывающую субстрат.[20]
CBM12
Семейство модулей связывания углеводов 12 (CBM12) состоит из двух бета-листы, состоящий из двух и трех антипараллельных бета-цепей соответственно. Он связывает хитин через ароматические кольца триптофан остатки.[14] CBM5 и CBM12 отдаленно связаны.
CBM14
Семейство 14 углеводсвязывающих модулей (CBM14) также известно как домен перитрофина-A. Он находится в хитин связывающие белки, особенно перитрофическая матрица белки насекомых и животных хитиназы.[21][22][23] Копии домена также можно найти в некоторых бакуловирусы. Это внеклеточный домен, содержащий шесть консервативных цистеины это, наверное, три дисульфидные мостики. Связывание хитина было продемонстрировано для белка, содержащего только два из этих доменов.[21]
CBM15
Семейство модулей связывания углеводов 15 (CBM15), обнаруженных в бактериальных ферментах, как было показано, связывается с ксилан и ксилоолигосахариды. Он имеет складку бета-желе в виде рулона с канавкой на вогнутой поверхности одного из бета-листы.[3]
CBM17
Семейство 17 модулей связывания углеводов (CBM17), по-видимому, имеет очень мелкую связывающую щель, которая может быть более доступной для целлюлозы. цепи в некристаллической целлюлозе, чем более глубокие связывающие щели CBM семейства 4.[24] Последовательность и структурная консервативность в семействах CBM17 и CBM28 предполагает, что они имеют развился через дупликация гена и последующее расхождение.[4] CBM17 не конкурирует с модулями CBM28 при связывании с некристаллической целлюлозой. Было показано, что разные CBM связываются с разными sirtes в аморфной целлюлозе, CBM17 и CBM28 распознают отдельные неперекрывающиеся сайты в аморфной целлюлозе.[25]
CBM18
Семейство 18 углеводосвязывающих модулей (CBM18) (также известных как связывающий хитин 1 или белок узнавания хитина) встречается в ряде растение и грибковый белки который связывать N-ацетилглюкозамин (например. пасленовый лектины помидоров и картофеля, растений эндохитиназы, белки, индуцированные раной: Hevein, win1 и win2, а Kluyveromyces lactis убийца токсин альфа-субъединица).[26] Домен может существовать в одной или нескольких копиях и, как считается, участвует в распознавании или связывании хитин субъединицы.[27][28] В хитиназах, а также в картофель белки, индуцированные раной, этот домен из 43 остатков непосредственно следует за сигнальная последовательность и поэтому находится на N-конце зрелого белка; в альфа-субъединице киллерного токсина он расположен в центральной части белка.
CBM19
Семейство 19 модулей связывания углеводов (CBM19), обнаруженных у грибов хитиназысвязывает хитин.[29]
CBM20
Семейство 20 углеводсвязывающих модулей (CBM20) связывается с крахмал.[30][31]
CBM21
Семейство 21 углеводосвязывающих модулей (CBM21), встречается во многих эукариотический белки, участвующие в гликоген метаболизм, связывается с гликогеном.[32]
CBM25
Семейство 25 углеводсвязывающих модулей (CBM25) связывает альфа-глюкоолигосахариды, особенно те, которые содержат альфа-1,6 связи, и гранулированный крахмал.[33]
CBM27
Семейство 27 модулей связывания углеводов (CBM27) связывается с бета-1,4-манноолигосахаридами, рожковое дерево галактоманнан, и Конжак глюкоманнан, но не целлюлозу (нерастворимую и растворимую) или растворимый ксилан березы. CBM27 имеет бета-сэндвич-структуру, состоящую из 13 бета-нити с одним маленьким альфа-спираль и единственный металл атом.[34]
CBM28
Семейство 28 модулей связывания углеводов (CBM28) не конкурирует с модулями CBM17 при связывании с некристаллической целлюлозой. Было показано, что разные CBM связываются с разными sirtes в аморфной целлюлозе, CBM17 и CBM28 распознают отдельные неперекрывающиеся сайты в аморфной целлюлозе. CBM28 имеет топологию «бета-желейного рулона», аналогичную по структуре доменам CBM17. Последовательность и структурная консервативность в семействах CBM17 и CBM28 предполагает, что они имеют развился через дупликация гена и последующее расхождение.[4][25]
CBM32
Семейство 32 связывающих углеводы модулей (CBM32) связывается с различными субстратами, от полисахаридов клеточной стенки растений до сложных гликанов.[35] Модуль был обнаружен у микроорганизмов, включая археи, эубактерии и грибы.[35] CBM32 имеет бета-сэндвич-складку и имеет связанный атом металла, чаще всего кальций.[36] Модули CBM32 связаны с каталитическими модулями, такими как сиалидазы, B-N-ацетилглюкозаминидазы, α-N-ацетилглюкозаминидазы, маннаназы и оксидазы галактозы.[36]
CBM33
Семейство 33 углеводсвязывающих модулей (CBM33) представляет собой хитин-связывающий домен.[37] Он имеет почковую складку фибронектина типа III, состоящую из двух бета-листов, расположенных в виде сэндвича с бета-слоями, и зачатка, состоящего из трех коротких спиралей, расположенных между бета-цепями 1 и 2. Он связывает хитин через консервативные полярные аминокислоты.[38] Этот домен находится изолированно в бакуловирусный белки сфероидин и спиндолин.
CBM48
Семейство 48 модулей связывания углеводов (CBM48) часто встречается в ферментах, содержащих гликозилгидролаза семейство 13 каталитических доменов. Встречается в ряде ферменты которые действуют на разветвленные субстраты то есть изоамилаза, пуллуланаза и фермент ветвления. Изоамилаза гидролизует связи 1,6-альфа-D-глюкозидной ветви в гликогене, амилопектин и декстрин; Фермент разветвления 1,4-альфа-глюкана участвует в образовании 1,6-глюкозидных связей гликогена; и пуллуланаза является ферментом, разветвляющим крахмал. CBM48 связывает гликоген.[39][40][41][42]
CBM49
Семейство 49 углеводсвязывающих модулей (CBM49) находится на С-конце целлюлаз и in vitro Исследования связывания показали, что он связывается с кристаллической целлюлозой.[43]
Рекомендации
- ^ Гилкс Н.Р., Хенриссат Б., Килберн Д.Г., Миллер Р.К., Уоррен Р.А. (июнь 1991 г.). «Домены микробных бета-1,4-гликаназ: сохранение последовательности, функция и семейства ферментов». Microbiol. Rev. 55 (2): 303–15. Дои:10.1128 / MMBR.55.2.303-315.1991. ЧВК 372816. PMID 1886523.
- ^ Cantarel, B.L .; Coutinho, P.M .; Rancurel, C .; Бернард, Т .; Lombard, V .; Хенриссат, Б. (2009). «База данных по углеводно-активным ферментам (CAZy): экспертный ресурс по гликогеномике». Исследования нуклеиновых кислот. 37 (Проблема с базой данных): D233 – D238. Дои:10.1093 / nar / gkn663. ЧВК 2686590. PMID 18838391.
- ^ а б Szabo, L .; Jamal, S .; Xie, H .; Чарнок, С. Дж .; Bolam, D. N .; Гилберт, Х. Дж.; Дэвис, Дж. Дж. (2001). «Структура модуля связывания углеводов семейства 15 в комплексе с ксилопентаозой. Доказательства того, что ксилан связывается в приблизительно 3-х спиральной конформации». Журнал биологической химии. 276 (52): 49061–49065. Дои:10.1074 / jbc.M109558200. PMID 11598143.
- ^ а б c Джамал С., Нуриццо Д., Борастон А.Б., Дэвис Дж. Дж. (Май 2004 г.). «Рентгеновская кристаллическая структура некристаллического целлюлозо-специфического углеводно-связывающего модуля: CBM28». J. Mol. Биол. 339 (2): 253–8. Дои:10.1016 / j.jmb.2004.03.069. PMID 15136030.
- ^ Роске Ю., Сунна А., Пфейл В., Хайнеманн Ю. (июль 2004 г.). «Кристаллические структуры высокого разрешения штамма Caldicellulosiruptor Rt8B.4 углеводсвязывающего модуля CBM27-1 и его комплекса с манногексаозой». J. Mol. Биол. 340 (3): 543–54. Дои:10.1016 / j.jmb.2004.04.072. PMID 15210353.
- ^ Gilkes NR, Claeyssens M, Aebersold R, Henrissat B, Meinke A, Morrison HD, Kilburn DG, Warren RA, Miller RC (декабрь 1991). «Структурные и функциональные отношения в двух семействах бета-1,4-гликаназ». Евро. J. Biochem. 202 (2): 367–77. Дои:10.1111 / j.1432-1033.1991.tb16384.x. PMID 1761039.
- ^ Мейнке А., Гилкс Н. Р., Килберн Д. Г., Миллер Р. К., Уоррен Р. А. (декабрь 1991 г.). «Бактериальные последовательности, подобные домену связывания целлюлозы в эукариотических полипептидах». Protein Seq. Анализ данных. 4 (6): 349–53. PMID 1812490.
- ^ Симпсон П.Дж., Се Х., Болам Д.Н., Гилберт Х.Д., Уильямсон депутат (декабрь 2000 г.). «Структурная основа лигандной специфичности углеводсвязывающих модулей семейства 2». J. Biol. Chem. 275 (52): 41137–42. Дои:10.1074 / jbc.M006948200. PMID 10973978.
- ^ Xu, G. Y .; Ong, E .; Gilkes, N.R .; Kilburn, D.G .; Muhandiram, D. R .; Harris-Brandts, M .; Carver, J. P .; Kay, L.E .; Харви, Т. С. (1995). «Структура раствора целлюлозосвязывающего домена из Cellulomonas fimi с помощью спектроскопии ядерного магнитного резонанса». Биохимия. 34 (21): 6993–7009. Дои:10.1021 / bi00021a011. PMID 7766609.
- ^ Пул Д.М., Мораг Е., Ламед Р., Байер Е.А., Хазлвуд Г.П., Гилберт Г.Дж. (декабрь 1992 г.). «Идентификация целлюлозосвязывающего домена субъединицы S1 целлюлосомы из Clostridium thermocellum YS». FEMS Microbiol. Латыш. 78 (2–3): 181–6. Дои:10.1016 / 0378-1097 (92) 90022-г. PMID 1490597.
- ^ Тормо Дж., Ламед Р., Чирино А.Дж., Мораг Е., Байер Е.А., Шохам И., Стейтц Т.А. (ноябрь 1996 г.). «Кристаллическая структура бактериального семейства III целлюлозосвязывающего домена: общий механизм прикрепления к целлюлозе». EMBO J. 15 (21): 5739–51. Дои:10.1002 / j.1460-2075.1996.tb00960.x. ЧВК 452321. PMID 8918451.
- ^ Брун Э., Джонсон П.Е., Креаг А.Л., Томм П., Вебстер П., Хейнс, Калифорния, Макинтош LP (март 2000 г.). «Структура и специфичность связывания второго N-концевого целлюлозосвязывающего домена из эндоглюканазы C Cellulomonas fimi». Биохимия. 39 (10): 2445–58. Дои:10.1021 / bi992079u. PMID 10704194.
- ^ Johnson PE, Joshi MD, Tomme P, Kilburn DG, McIntosh LP (ноябрь 1996 г.). «Структура N-концевого целлюлозосвязывающего домена Cellulomonas fimi CenC, определенная с помощью спектроскопии ядерного магнитного резонанса». Биохимия. 35 (45): 14381–94. Дои:10.1021 / bi961612s. PMID 8916925.
- ^ а б Акаги, К. -И .; Watanabe, J .; Hara, M .; Kezuka, Y .; Chikaishi, E .; Yamaguchi, T .; Akutsu, H .; Нонака, Т .; Watanabe, T .; Икегами, Т. (2006). «Идентификация области взаимодействия субстрата хитин-связывающего домена хитиназы C Streptomyces griseus». Журнал биохимии. 139 (3): 483–493. Дои:10.1093 / jb / mvj062. PMID 16567413.
- ^ Henshaw, J. L .; Bolam, D. N .; Пирес, В. М .; Czjzek, M .; Henrissat, B .; Ferreira, L.M .; Fontes, C.M .; Гилберт, Х. Дж. (2004). «Модуль связывания углеводов семейства 6 CmCBM6-2 содержит два сайта связывания лиганда с различными специфичностями». Журнал биологической химии. 279 (20): 21552–21559. Дои:10.1074 / jbc.M401620200. PMID 15004011.
- ^ Winterhalter, C .; Heinrich, P .; Candussio, A .; Wich, G .; Либл, В. (1995). «Идентификация нового целлюлозосвязывающего домена в многодоменной 120 кДа ксиланазе XynA гипертермофильной бактерии Thermotoga maritima». Молекулярная микробиология. 15 (3): 431–444. Дои:10.1111 / j.1365-2958.1995.tb02257.x. PMID 7783614.
- ^ Миллуорд-Сэдлер С.Дж., Дэвидсон К., Хазлвуд Г.П., Блэк Г.В., Гилберт Х.Дж., Кларк Дж.Х. (ноябрь 1995 г.). «Новые целлюлозосвязывающие домены, гомологи NodB и консервативная модульная архитектура в ксиланазах из аэробных почвенных бактерий Pseudomonas fluorescens subsp. Cellulosa и Cellvibrio mixtus». Biochem. J. 312 (1): 39–48. Дои:10.1042 / bj3120039. ЧВК 1136224. PMID 7492333.
- ^ Fanutti C, Ponyi T, Black GW, Hazlewood GP, Gilbert HJ (декабрь 1995 г.). «Консервативная некаталитическая последовательность из 40 остатков в целлюлазах и гемицеллюлазах анаэробных грибов функционирует как стыковочный домен белка». J. Biol. Chem. 270 (49): 29314–22. Дои:10.1074 / jbc.270.49.29314. PMID 7493964.
- ^ а б Raghothama S, Eberhardt RY, Simpson P, Wigelsworth D, White P, Hazlewood GP, Nagy T., Gilbert HJ, Williamson MP (сентябрь 2001 г.). «Характеристика домена докерина целлюлосомы анаэробного гриба Piromyces equi». Nat. Struct. Биол. 8 (9): 775–8. Дои:10.1038 / nsb0901-775. PMID 11524680. S2CID 6442375.
- ^ а б Carvalho, A. L .; Гоял, А .; Prates, J. A .; Bolam, D. N .; Гилберт, Х. Дж.; Пирес, В. М .; Ferreira, L.M .; Planas, A .; Romão, M. J .; Фонтес, К. М. (2004). "Модуль связывания углеводов семейства 11 Clostridium thermocellum Lic26A-Cel5E вмещает -1,4- и -1,3-1,4-смешанные связанные глюканы в единственном сайте связывания". Журнал биологической химии. 279 (33): 34785–34793. Дои:10.1074 / jbc.M405867200. PMID 15192099.
- ^ а б Шен З, Джейкобс-Лорена М. (июль 1998 г.). «Белок перитрофического матрикса типа I из переносчика малярии Anopheles gambiae связывается с хитином. Клонирование, экспрессия и характеристика». J. Biol. Chem. 273 (28): 17665–70. Дои:10.1074 / jbc.273.28.17665. PMID 9651363.
- ^ Элвин К.М., Вуоколо Т., Пирсон Р.Д., Ист Ай-Джерси, Райдинг Г.А., Айсманн С.Х., Теллам Р.Л. (апрель 1996 г.) «Характеристика основного белка перитрофической мембраны, перитрофина-44, из личинок Lucilia cuprina. КДНК и выведенные аминокислотные последовательности». J. Biol. Chem. 271 (15): 8925–35. Дои:10.1074 / jbc.271.15.8925. PMID 8621536.
- ^ Казу Р., Эйсеманн С., Пирсон Р., Верховая езда G, Восток I, Дональдсон А., Кадоган Л., Теллам Р. (август 1997 г.). «Опосредованное антителами ингибирование роста личинок насекомого, вызывающего кожный миаз у млекопитающего-хозяина». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 94 (17): 8939–44. Дои:10.1073 / пнас.94.17.8939. ЧВК 22971. PMID 9256413.
- ^ Notenboom V, Boraston AB, Chiu P, Freelove AC, Kilburn DG, Rose DR (декабрь 2001 г.). «Распознавание целлоолигосахаридов с помощью модуля связывания углеводов семейства 17: рентгеноструктурное, термодинамическое и мутагенное исследование». J. Mol. Биол. 314 (4): 797–806. Дои:10.1006 / jmbi.2001.5153. PMID 11733998.
- ^ а б Jamal, S .; Нуриццо, Д .; Борастон, А. Б .; Дэвис, Дж. Дж. (2004). «Рентгеновская кристаллическая структура некристаллического целлюлозо-специфического углеводно-связывающего модуля: CBM28». Журнал молекулярной биологии. 339 (2): 253–258. Дои:10.1016 / j.jmb.2004.03.069. PMID 15136030.
- ^ Райт Х.Т., Сандрасегарам Г., Райт С.С. (сентябрь 1991 г.).«Эволюция семейства N-ацетилглюкозамин-связывающих белков, содержащих богатый дисульфидом домен агглютинина зародышей пшеницы». J. Mol. Evol. 33 (3): 283–94. Дои:10.1007 / bf02100680. PMID 1757999. S2CID 8327744.
- ^ Батлер А.Р., О'Доннелл Р.В., Мартин В.Дж., Гудей Г.В., Старк М.Дж. (июль 1991 г.). «Токсин Kluyveromyces lactis обладает существенной хитиназной активностью». Евро. J. Biochem. 199 (2): 483–8. Дои:10.1111 / j.1432-1033.1991.tb16147.x. PMID 2070799.
- ^ Лернер Д.Р., Райхель Н.В. (июнь 1992 г.). «Ген лектина крапивы двудомной (агглютинин Urtica dioica) кодирует как лектин, так и хитиназу». J. Biol. Chem. 267 (16): 11085–91. PMID 1375935.
- ^ Куранда, М. Дж .; Роббинс, П. В. (1991). «Хитиназа необходима для разделения клеток во время роста Saccharomyces cerevisiae». Журнал биологической химии. 266 (29): 19758–19767. PMID 1918080.
- ^ Penninga, D .; Van Der Veen, B.A .; Knegtel, R.M .; Van Hijum, S.A .; Rozeboom, H.J .; Kalk, K. H .; Dijkstra, B.W .; Дийкхёйзен, Л. (1996). «Неочищенный крахмал-связывающий домен циклодекстрингликозилтрансферазы из штамма 251 Bacillus Circum». Журнал биологической химии. 271 (51): 32777–32784. Дои:10.1074 / jbc.271.51.32777. PMID 8955113.
- ^ Ояма, Т .; Кусуноки, М .; Kishimoto, Y .; Takasaki, Y .; Нитта, Ю. (1999). «Кристаллическая структура бета-амилазы из Bacillus cereus var. Mycoides при разрешении 2,2». Журнал биохимии. 125 (6): 1120–1130. Дои:10.1093 / oxfordjournals.jbchem.a022394. PMID 10348915.
- ^ Armstrong, C.G .; Доэрти, М. Дж .; Коэн, П. Т. (1998). «Идентификация отдельных доменов в субъединице нацеливания на гликоген в печени протеинфосфатазы 1, которые взаимодействуют с фосфорилазой а, гликогеном и протеинфосфатазой 1». Биохимический журнал. 336 (3): 699–704. Дои:10.1042 / bj3360699. ЧВК 1219922. PMID 9841883.
- ^ Борастон, А. Б .; Healey, M .; Klassen, J .; Ficko-Blean, E .; Lammerts Van Bueren, A .; Закон В. (2005). «Структурный и функциональный анализ распознавания -глюканов семейством 25 и 26 модулей, связывающих углеводы, выявляет консервативный способ распознавания крахмала». Журнал биологической химии. 281 (1): 587–598. Дои:10.1074 / jbc.M509958200. PMID 16230347.
- ^ Boraston AB, Revett TJ, Boraston CM, Nurizzo D, Davies GJ (июнь 2003 г.). «Структурное и термодинамическое рассечение специфического распознавания маннана с помощью модуля связывания углеводов, TmCBM27». Структура. 11 (6): 665–75. Дои:10.1016 / S0969-2126 (03) 00100-X. PMID 12791255.
- ^ а б Abbot, DW; Эйрин-Лопес, JM; Борастон, AB (январь 2008 г.). «Понимание разнообразия лигандов и новых биологических ролей углеводсвязывающих модулей семейства 32». Молекулярная биология и эволюция. 25 (1): 155–67. Дои:10.1093 / молбев / мсм243. PMID 18032406.
- ^ а б Фико-Блин, Элизабет; Борастон, Алисдэр,«Семейство модулей связывания углеводов 32» В архиве 2016-08-20 в Wayback Machine,CAZypedia, 4 мая 2017 г.
- ^ Schnellmann, J .; Зелтинс, А .; Blaak, H .; Шремпф, Х. (1994). «Новый лектин-подобный белок CHB1 кодируется хитин-индуцируемым геном Streptomyces olivaceoviridis и специфически связывается с кристаллическим альфа-хитином грибов и других организмов». Молекулярная микробиология. 13 (5): 807–819. Дои:10.1111 / j.1365-2958.1994.tb00473.x. PMID 7815940.
- ^ Vaaje-Kolstad, G .; Хьюстон, Д. Р .; Riemen, A.H .; Эйсинк, В. Г .; Ван Аалтен, Д. М. (2005). «Кристаллическая структура и связывающие свойства хитинсвязывающего белка CBP21 Serratia marcescens». Журнал биологической химии. 280 (12): 11313–11319. Дои:10.1074 / jbc.M407175200. PMID 15590674.
- ^ Katsuya, Y .; Mezaki, Y .; Кубота, М .; Мацуура, Ю. (1998). «Трехмерная структура изоамилазы Pseudomonas при разрешении 2,2 Å1». Журнал молекулярной биологии. 281 (5): 885–897. Дои:10.1006 / jmbi.1998.1992. PMID 9719642.
- ^ Wiatrowski, H.A .; Van Denderen, B.J .; Berkey, C.D .; Kemp, B.E .; Stapleton, D .; Карлсон, М. (2004). «Мутации в гликоген-связывающем домене gal83 активируют путь киназы snf1 / gal83 по гликоген-независимому механизму». Молекулярная и клеточная биология. 24 (1): 352–361. Дои:10.1128 / mcb.24.1.352-361.2004. ЧВК 303368. PMID 14673168.
- ^ Полехина, Г .; Gupta, A .; Michell, B.J .; Van Denderen, B .; Murthy, S .; Feil, S.C .; Jennings, I.G .; Кэмпбелл, Д. Дж .; Виттерс, Л. А .; Паркер, М. У .; Kemp, B.E .; Стэплтон, Д. (2003). «Бета-субъединица AMPK воздействует на гликоген, чувствительный к метаболическому стрессу». Текущая биология. 13 (10): 867–871. Дои:10.1016 / S0960-9822 (03) 00292-6. PMID 12747837. S2CID 16778615.
- ^ Hudson, E. R .; Пан, Д. А .; James, J .; Lucocq, J.M .; Hawley, S.A .; Грин, К. А .; Баба, О .; Терашима, Т .; Харди, Д. Г. (2003). «Новый домен в AMP-активированной протеинкиназе вызывает тельца-накопители гликогена, подобные тем, которые наблюдаются при наследственной сердечной аритмии». Текущая биология. 13 (10): 861–866. Дои:10.1016 / S0960-9822 (03) 00249-5. PMID 12747836. S2CID 2295263.
- ^ Урбанович Б.Р., Катала С., Ирвин Д., Уилсон Д. Б., Риполл Д. Р., Роуз Дж. К. (апрель 2007 г.). «Эндо-бета-1,4-глюканаза томатов, SlCel9C1, представляет собой отдельный подкласс с новым семейством модулей связывания углеводов (CBM49)». J. Biol. Chem. 282 (16): 12066–74. Дои:10.1074 / jbc.M607925200. PMID 17322304.