WikiDer > Гиперметилирование CpG-островков
Эта статья может быть слишком техническим для большинства читателей, чтобы понять. Пожалуйста помогите улучшить это к сделать понятным для неспециалистов, не снимая технических деталей. (Апрель 2017 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |
Гиперметилирование CpG-островков является эпигенетический контролировать аберрацию, что важно для генная инактивация в рак клетки. Гиперметилирование из Острова CpG был описан почти во всех типах опухоль. Многие важные клеточные пути, Такие как Ремонт ДНК (hMLH1, Например), клеточный цикл (p14ARF), апоптоз (ДАПК), клеточная адгезия (CDH1, CDH13), инактивируются этим эпигенетическим поражением.[1] Гиперметилирование связано с метилсвязывающие белки, ДНК-метилтрансферазы и гистоновая деацетилаза, но степень, в которой этот процесс выборочно заглушает гены-супрессоры опухолей остается яркой областью изучения. Список гиперметилированных генов растет, и проводятся функциональные и генетические исследования, чтобы определить, какие события гиперметилирования актуальны для туморогенез. Базовый, а также трансляционные исследования будет необходимо для понимания механизмов и роли гиперметилирования CpG-островков при раке.
История
Первое открытие метилирования в Остров CpG гена-супрессора опухоли у людей был геном Ретинобластома (Rb) ген в 1989 году.[2] Это было всего через несколько лет после первого онкоген мутация была обнаружена в первичной опухоли человека. Открытие связанной с метилированием инактивации Ген фон Хиппель-Линдау (VHL) возродил идею гиперметилирования Остров CpG промотор является механизмом инактивации генов при раке.[3] Рак эпигенетическое молчание в своем нынешнем состоянии родился в лабораториях Бейлина и Джонса,[3] где было доказано, что гиперметилирование CpG-островков было обычным механизмом инактивации гена-супрессора опухоли. p16INK4a. Вступление к ПЦР, специфичная для метилирования и бисульфит натрия модификация добавила инструменты в пояс исследования эпигенетики рака,[3][4] и список генов-кандидатов с аберрантным метилированием их CpG-островков с тех пор растет.[5] Первоначально наличие изменений в профиле метилирования ДНК при раке рассматривалось как глобальное гипометилирование генома, которое должно приводить к массивной сверхэкспрессии онкогенов с обычно гиперметилированным островком CpG.[6] В последнее время это считается неполным сценарием, несмотря на представление о том, что геном раковой клетки подвергается сокращению своей 5-метилцитозин содержимое по сравнению с его родительской нормальной ячейкой является правильным.[5] В нормальных тканях подавляющее большинство CpG-островков полностью неметилировано, за некоторыми исключениями.[1] Связь подавления транскрипции генов-супрессоров опухолей с гиперметилированием является фундаментом, на котором стоит эта подгруппа эпигенетики рака.
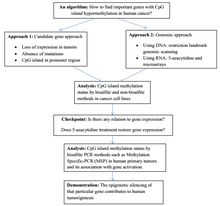
Структура
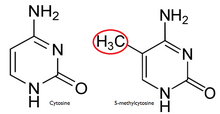
В нормальной клетке Остров CpG является гипометилированный,[7] а остальная часть генома метилирована. Очевидно, что гипометилирование CpG-островка в нормальных клетках не дает дополнительных стерическое препятствие к будущей привязке. Большая часть чего-либо CpG пары у млекопитающих химически модифицированы ковалентный прикрепление метил группа в C5 позиция цитозин звенеть.[8] Эта модификация распространяется по всему геному и подавляет транскрипцию. Остров CpG - это Цитозин и Гуанин связаны фосфат в повторяющейся последовательности. Это генетический горячие точки, поскольку они являются сайтами для активных метилирование. Выражение ген является ткань специфический, что приводит к изменению функции тканей. Метилирование гена препятствует экспрессии гена определенным образом.
Причина, по которой метилирование почти исключительно для CpG динуклеотиды симметрия динуклеотида. Это позволяет сохранять во время деление клеток и является признаком эпигенетических модификаций.

Роль в раке
Чтобы понять роль Остров CpG гиперметилирования при раке полезно рассмотреть конкретный тип опухоли, называемый Прототип CpG-островного метилатора, или CIMP. Более высокие уровни гиперметилирования CpG-островков обнаруживаются в CIMP. Частое возникновение гиперметилирования было впервые описано в колоректальный рак а позже для глиома. Совсем недавно он был изучен для нейробластомы. Частое гиперметилирование CpG-островков в этих опухолях, а также их нерегулярность являются способами определения того, что гиперметилированные CpGs различаются в зависимости от типа опухоли. Это означало бы, что колоректальный рак не обязательно будет иметь тот же набор гиперметилированных CpG-островков, что и в глиоме. Эта клиническая особенность опухолей может интерпретироваться врачами. Чтобы увеличить масштаб, давайте сосредоточимся на колоректальном CIMP, так как это было одно из первых описаний подобного рода. Пациенты с этой категорией рака, как правило, старше, женского пола и имеют дефекты. MLH1 функция. Опухоли обычно находятся в восходящей ободочной кишке. У них также есть хороший прогностический результат, поэтому, если пациенту был поставлен диагноз этой разновидности CIMP, у него, вероятно, был хороший результат. Эти клинически отличные фенотипы CIMP также предполагают, что существует потенциал для эпигенетическая терапия. Гиперметилированные CpG-островки могут играть три роли в развитии рака: диагноз, прогноз И в мониторинг. При диагностике можно определить тип опухоли и подтип опухоли, а также первичную опухоль, если она неизвестна. Гиперметилирование увеличивается с онкогенность, что является показателем прогноза рака. Например, высокий метилирование является маркером плохого прогноза при раке легких. Гиперметилирование CpG-островков многообещающе для молекулярный мониторинг больных раком. Это также потенциальная мишень для терапевтического использования.

Аберрации в эпигенетический контроль, который наблюдается при раке, относится к Метилирование ДНК, который может быть либо локус-специфическое гиперметилирование ДНК или геномширокое гипометилирование ДНК. Под локус-специфическим гиперметилированием ДНК происходит Остров CpG гиперметилирование. Метилирование ДНК действует как альтернатива генетическая мутация. Согласно Гипотеза Кнудсона, рак является результатом множественных попаданий в ДНК, и Метилирование ДНК может быть одним из таких попаданий. Эпигенетические мутации, такие как метилирование ДНК, митотически наследственные, но также обратимые, в отличие от генных мутаций. Идентичность гиперметилированных CpG-островков зависит от типа опухоли. Некоторые примеры одного гена включают MLH1 в колоректальный рак и BRCA1 в рак молочной железы. Гиперметилированные островки CpG также действуют как биомаркеры, поскольку они могут помочь отличить рак от нормальных клеток в одном образце. Они также могут помочь идентифицировать определенные специфические особенности рака, и их обнаружение более чувствительно. Гиперметилирование CpG-островков показало перспективу для молекулярного мониторинга пациентов с раком и является потенциальной мишенью для терапевтического использования.
Рекомендации
- ^ а б Эстеллер М (12 августа 2002 г.). «Гены гиперметилирования CpG-острова и опухолевые супрессоры: процветающее настоящее, светлое будущее». Онкоген. 21 (35): 5427–40. Дои:10.1038 / sj.onc.1205600. PMID 12154405. ProQuest 227311892.
- ^ Greger V, Passarge E, Höpping W, Messmer E, Horsthemke B (1 сентября 1989 г.). «Эпигенетические изменения могут способствовать образованию и спонтанному регрессу ретинобластомы». Генетика человека. 83 (2): 155–8. Дои:10.1007 / BF00286709. PMID 2550354.
- ^ а б c Герман Дж. Г., Латиф Ф., Вен Й., Лерман М.И., Збар Б., Лю С., Самид Д., Дуан Д.С., Гнарра Дж. Р., Лайнхан В. М. (11 октября 1994 г.). «Подавление гена-супрессора опухоли VHL метилированием ДНК при раке почки». Труды Национальной академии наук. 91 (21): 9700–4. Дои:10.1073 / пнас.91.21.9700. ЧВК 44884. PMID 7937876.
- ^ Кларк Дж., Рокки П.Дж., Экипаж А.Дж., Гилл С., Шипли Дж., Чан А.М., Гастерсон Б.А., Купер С.С. (1 августа 1994 г.). «Идентификация новых генов, SYT и SSX, участвующих в транслокации t (X; 18) (p11.2; q11.2), обнаруженной в синовиальной саркоме человека». Природа Генетика. 7 (4): 502–8. Дои:10.1038 / ng0894-502. PMID 7951320.
- ^ а б Эстеллер М, Кукуруза PG, Байлин С.Б., Герман Дж. Г. (15 апреля 2001 г.). «Профиль гиперметилирования гена рака человека». Исследования рака. 61 (8): 3225–9. PMID 11309270.
- ^ Файнберг А.П., Фогельштейн Б. (1 июля 1983 г.). «Методика радиомечения фрагментов рестрикционных эндонуклеаз ДНК с высокой удельной активностью». Аналитическая биохимия. 132 (1): 6–13. Дои:10.1016/0003-2697(83)90418-9. PMID 6312838.
- ^ Мельбурнский университет, Coursera
- ^ Иллингворт Р.С., Берд А.П. (5 июня 2009 г.). «Острова CpG» - приблизительный справочник'". Письма FEBS. 583 (11): 1713–20. Дои:10.1016 / j.febslet.2009.04.012. PMID 19376112.