WikiDer > Кроссовер эксперимент (химия)
В химия, а кроссовер эксперимент это метод, используемый для изучения механизм из химическая реакция. В перекрестном эксперименте два одинаковых, но различимых реагента одновременно вступают в реакцию как часть одной и той же реакционной смеси. Образующиеся продукты будут либо напрямую соответствовать одному из двух реагентов (неперекрестные продукты), либо будут включать компоненты обоих реагентов (кроссоверные продукты). Целью кроссоверного эксперимента является определение того, включает ли процесс реакции стадию, на которой компоненты каждого реагента имеют возможность обмениваться друг с другом.
Результаты кроссоверных экспериментов часто легко анализировать, что делает их одним из наиболее полезных и наиболее часто применяемых методов механистического исследования. В органическая химия кроссоверные эксперименты чаще всего используются для различения внутримолекулярный и межмолекулярный реакции.[1][2][3]Неорганический и металлоорганический химики в значительной степени полагаются на кроссоверные эксперименты, и в частности изотопная маркировка эксперименты, подтверждающие или опровергающие предложенные механизмы.[4] Когда исследуемый механизм более сложен, чем внутри- или межмолекулярное замещение или перегруппировка, дизайн эксперимента по кроссоверу может сам по себе стать сложным вопросом.[5] Хорошо спланированный кроссоверный эксперимент может привести к выводам о механизме, которые иначе сделать невозможно. Многие механистические исследования включают как кроссоверные эксперименты, так и измерения ставка и кинетические изотопные эффекты.
Цель
Кроссовер-эксперименты позволяют экспериментально изучить механизм реакции. Механистический исследования представляют интерес для химиков-теоретиков и экспериментаторов по разным причинам, включая предсказание стереохимический результаты, оптимизация условий реакции по скорости и селективности, а также разработка улучшенных катализаторы для лучшей оборачиваемости, надежности и т. д.[6][7] Поскольку механизм нельзя непосредственно наблюдать или определять исключительно на основе реагентов или продуктов, механизмы сложно изучать экспериментально. Только несколько экспериментальных методов способны предоставить информацию о механизме реакции, включая эксперименты по кроссоверу, исследования кинетического изотопного эффекта и изменения скорости в зависимости от заместителя. Преимущество эксперимента с кроссовером состоит в том, что он концептуально прост и относительно прост в разработке, проведении и интерпретации. В современных механистических исследованиях перекрестные эксперименты и исследования KIE обычно используются в сочетании с вычислительный методы.[8]
Теория
Концепция, лежащая в основе кроссоверного эксперимента, является базовой: при условии, что выбранный метод мечения не влияет на то, как протекает реакция, изменение мечения, наблюдаемое в продуктах, можно отнести к механизму реакции. Поэтому наиболее важным ограничением в дизайне экспериментов с кроссовером является то, что мечение не влияет на сам механизм реакции.[1]
Может быть трудно понять, повлияют ли изменения, внесенные в реагенты для кроссоверного эксперимента, на механизм, по которому протекает реакция. Это особенно верно, поскольку цель кроссоверного эксперимента - дать представление о механизме, который позволил бы делать такие типы предсказаний. Всегда есть вероятность, что этикетка изменит ход реакции.[1]
На практике кроссоверные эксперименты стремятся использовать наименьшее возможное изменение между обычными условиями изучаемой реакции и условиями кроссоверного эксперимента. Этот принцип способствует изотопному мечению, поскольку изменение изотопа одного атома в молекуле является наименьшим изменением, которое может быть легко осуществлено и отслежено в реакции. Если изотоп помещен в молекулу в положение, непосредственно участвующее в механизме реакции, кинетический изотопный эффект ожидается. Это можно использовать для изучения аспектов механизма независимо или вместе с экспериментом по кроссоверу.[1][2][8] Кинетический изотопный эффект - это изменение скорости реакции, основанное на изменении изотопа, а не изменение механизма самой реакции, поэтому изотопное мечение обычно удовлетворяет требованиям для достоверного кроссоверного эксперимента. В перекрестных экспериментах, которые не используют изотопное мечение, обычно ожидается, что добавление или вычитание метильного заместителя в положении, не участвующем в каком-либо предложенном механизме реакции, даст достоверный перекрестный эксперимент.[1]
Дизайн
При разработке кроссоверного эксперимента первая задача - предложить возможные механизмы изучаемой реакции. Основываясь на этих возможных механизмах, цель состоит в том, чтобы определить либо традиционный эксперимент с кроссовером, либо эксперимент по скремблированию изотопов, который позволит исследователю различать два или более возможных механизма. Часто приходится использовать многие методы механистического исследования, чтобы поддержать или обесценить все предложенные механизмы. Однако в некоторых случаях только перекрестный эксперимент сможет различить основные возможности, например, в случае механизмов внутримолекулярных и межмолекулярных органических реакций.
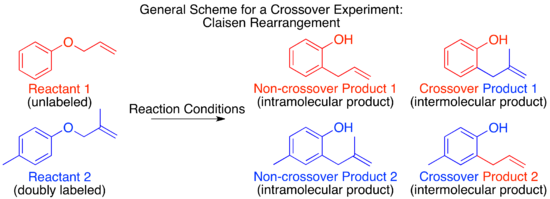
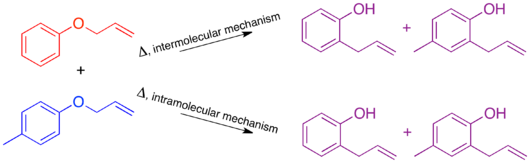
Механизм теплового Перестановка Клейзена был изучен методом кроссовера и служит отличным примером применения этой техники.[9] Прежде чем механизм был определен, было высказано предположение, что реакция может протекать по межмолекулярному или внутримолекулярному пути.[1]
Глядя на эти два предложенных механизма, становится ясно, что эксперимент с кроссовером будет подходящим для различения между ними, как это обычно бывает для меж- и внутримолекулярных механизмов. Следующим шагом в дизайне кроссоверного эксперимента является предложение меченых реагентов. Для неизотопного метода мечения наименьшее возмущение системы будет происходить при добавлении метильной группы в нереактивное положение.
Прогнозирование продуктов, предоставляемых каждым механизмом, покажет, сможет ли данный дизайн эксперимента с кроссовером различать рассматриваемые механизмы. Это особенно актуально при использовании изотопной метки. Возможно, что маркировка в одной позиции может различать только два из нескольких возможных механизмов, в то время как размещение изотопной метки в другой позиции может различать три потенциальных механизма или обеспечивать понимание переходных состояний или промежуточных соединений и т. Д. После того, как интерпретируемая ценность установлена уместно рассмотреть практические аспекты, например, возможен ли синтез предложенного реагента, и насколько легко или сложно отличить предсказанные продукты для каждого предложенного механизма и исходных материалов.
Для перегруппировки Клайзена мечение путем добавления одной метильной группы дает недостаточно меченую систему. Полученный в результате кроссоверный эксперимент не может быть использован в качестве механистического исследования, поскольку продукты межмолекулярного или внутримолекулярного механизма идентичны.
Чтобы иметь достаточно меченую систему, должны быть помечены обе «половинки» молекулы, которые разделяются по межмолекулярному механизму. Это известно как система с двумя метками, и обычно это требуется для экспериментов с кроссовером.[1] Затем прогнозирование продуктов каждого механизма показывает, что продукты кроссовера отличаются от продуктов непересечения. Как только это установлено и продукты спрогнозированы, можно проводить эксперимент и характеризовать продукты. Когда используется изотопная маркировка, продукты часто бывают более разнообразными, а распределение этикеток более запутанным. В этом случае также важно явно предсказать относительное количество метки, которое, как ожидается, появится в каждой позиции в зависимости от механизма.
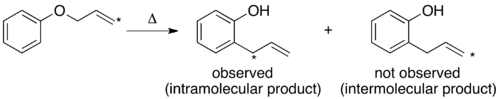
При проведении кроссоверного эксперимента по перегруппировке Клайзена наблюдаются только непересекающиеся продукты. На основании этого механизм определен как внутримолекулярный, как показано в стандарте. толкать стрелу механизм этой перестановки.[1][10]
Эксперимент по изотопной маркировке
Эксперимент с изотопной маркировкой - это эксперимент, используемый в механистическом исследовании, в котором изотопы используются в качестве этикеток и отслеживаются на продуктах. Эксперименты по изотопному мечению обычно считаются разновидностью экспериментов по кроссоверу.[1] Однако существует гораздо больше возможностей для способа мечения и потенциальных продуктов в эксперименте по изотопному мечению, чем в традиционном перекрестном эксперименте. Классификация эксперимента по маркировке изотопов как перекрестного эксперимента основана на сходной основной концепции, цели и принципах конструкции в двух экспериментах, а не на прямом сходстве. Эксперимент по изотопному мечению может быть разработан так, чтобы быть прямым аналогом традиционного эксперимента по кроссоверу, но есть много дополнительных способов проведения экспериментов по изотопному мечению.
Хотя эксперименты по изотопному мечению имеют преимущество использования наименьшего возмущения в реакционной системе, они ограничены возможностью изотопного обмена с растворителем или другими частицами, присутствующими в реакционной смеси. Если изотопная метка обменивается с другим изотопом того же атома в растворителе, результаты эксперимента по изотопному мечению непригодны. Это ограничивает использование мечения дейтерием в определенных положениях, например, в протонных растворителях. Однако этот обмен может быть полезен при исследовании взаимодействия с растворителем в реакции, поскольку изотопное мечение может обнаружить это взаимодействие.
Были проведены эксперименты по изотопному мечению термической перегруппировки Клейзена. Когда концевой углерод помечен 14C имеется только один продукт с изотопной меткой в бензильном положении. Поскольку ожидаемый продукт межмолекулярного механизма не наблюдается, вывод совпадает с выводом традиционного кроссоверного эксперимента.[1][10]
Характеристика
Основным преимуществом кроссоверного эксперимента является то, что результаты эксперимента получают путем непосредственного определения характеристик продукта. Таким образом, используемые методы уже знакомы химику-экспериментатору. Масс-спектрометрии и ЯМР-спектроскопия являются двумя наиболее распространенными способами определения продуктов и их относительных соотношений. ЯМР-спектроскопия особенно полезна для исследований изотопного мечения, в которых используются изотопы водорода или углерода.
ИК-спектроскопия может быть полезна в особых ситуациях, например, когда 13СО использовали для исследования механизма внедрения алкила в связи металл-монооксид углерода с образованием комплексов металл-ацил. Отслеживание 13CO в продуктах был достигнут с использованием ИК спектроскопия потому что большая масса 13C по сравнению с 12C вызывает характерный сдвиг частоты растяжения ν (CO) в сторону более низкой энергии.[4]
Интерпретация
Продукты, которые ожидаются от любого данного механизма, определяются во время разработки кроссоверного эксперимента. Это может быть довольно сложно установить, но это упрощает интерпретацию результатов. Если наблюдаемые продукты соответствуют предсказанным для данного механизма, то разумно сделать вывод, что механизм действует в реакции. Если результаты не соответствуют ожидаемому распределению, необходимо рассмотреть альтернативные механизмы и / или возможность того, что мечение повлияло на способ протекания реакции.
Для экспериментов по кроссоверу, используемых для различения межмолекулярных и внутримолекулярных реакций, отсутствие продуктов кроссовера менее убедительно, чем наличие продуктов кроссовера. Это связано с тем, что эффекты клетки растворителя могут маскировать межмолекулярный механизм.[1][5]
Ограничения
Эксперименты с кроссовером имеют несколько ограничений. Хотя они полезны для различения предложенных механизмов реакции, они ограничены в своей способности обеспечить понимание механизма, выходящего за рамки того, что уже было предложено. Дизайн полезного перекрестного эксперимента основан на наличии предложенного механизма, на котором основываются прогнозы распределения этикеток в продуктах. Если результаты не соответствуют какому-либо ожидаемому результату, фактический механизм не очевиден из результатов кроссоверного эксперимента. Дополнительным ограничением является, конечно, то, что некоторые системы просто не подходят для экспериментов с кроссовером. Это может иметь место, если добавление метки изменяет механизм или полностью останавливает реакцию, если нет предлагаемого механизма, если изотопные метки обмениваются с молекулами растворителя или если невозможно синтезировать меченые частицы, необходимые для эксперимента по кроссоверу. .
Эффект клетки для растворителя
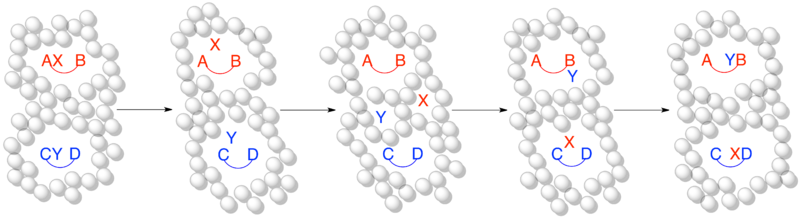
Одним из основных ограничений кроссоверного эксперимента является то, что он не может исключить возможность того, что эффекты клетки растворителя маскируют механизм диссоциации. Если наблюдаются продукты кроссовера, то доказательство того, что механизм не может быть чисто внутримолекулярным, является убедительным. Однако отсутствие продуктов кроссовера не является убедительным доказательством того, что механизм является исключительно внутримолекулярным. При условии, что реакция проводится в растворителе, всегда возможно, что эффекты клетки растворителя предотвращают образование продуктов кроссовера.[1][5]
Когда молекула растворяется в растворитель уместно рассматривать растворитель как создающий «клетку» вокруг молекулы. Время, необходимое данной молекуле, чтобы «покинуть» эту клетку растворителя, зависит от размера молекулы и силы межмолекулярных сил растворителя, но считается, что оно составляет порядка 1 x 10−10 секунд.[11] Если реакция происходит быстрее, чем молекулы способны покинуть клетку растворителя, то будут наблюдаться только непересекающиеся продукты, что маскирует истинный механизм реакции.[5]
Когда шкала времени реакции намного медленнее, чем шкала времени эффекта клетки растворителя, диссоциированные частицы способны покинуть клетку растворителя и образовать продукты кроссовера. Это подходящее представление реакции в эксперименте кроссовера, протекающей по межмолекулярному механизму и образующей продукты кроссовера, как и ожидалось.
Когда шкала времени реакции быстрее или в том же порядке, что и шкала времени эффекта клетки растворителя, это более точное представление того же эксперимента с кроссовером, что и выше. Хотя имеет место диссоциативный или межмолекулярный механизм, кроссовер не происходит, потому что временной масштаб реакции достаточно короткий, чтобы диссоциированный фрагмент оставался захваченным в клетке растворителя.
Влияние клетки растворителя на кроссоверные эксперименты не является чисто теоретическим понятием. Одним из первых экспериментальных доказательств существования клетки для растворителя было наблюдение эффекта клетки для растворителя в эксперименте с кроссовером. Поскольку радикальные рекомбинации происходят в очень короткие сроки по сравнению с нерадикальными реакциями, эффект клетки растворителя особенно важен для радикальный химия.[5] Лайонс и Леви были первыми, кто продемонстрировал влияние каркаса растворителя на эксперимент с радикальным кроссовером. Когда протио- и дейтероазометан объединяют и облучают в газовой фазе, результатом является статистическая смесь ожидаемых продуктов рекомбинации радикалов без кроссовера и кроссовера, C2ЧАС6, CH3CD3, а C2D6, как 1: 2: 1.[12]
Однако, когда ту же реакцию проводят в изооктановом растворе, количество CH3CD3 образуется составляет менее 0,3% от общего количества C2ЧАС6 сформирован.[12][13] Это продемонстрировало, что эффект каркаса растворителя способен значительно изменить результаты кроссоверного эксперимента, особенно в случае реакций с коротким временным интервалом, таких как реакции с участием радикалов.
Эндоциклический рестрикционный тест
Первым тестом на эндоциклическую рестрикцию был перекрестный эксперимент, опубликованный Альберт Эшенмозер в 1970 г. Были известны реакции метилирования, в которых сульфонильный анион действует как нуклеофил, а метил (аренсульфонат) - как электрофил, но было высказано предположение, что они могут протекать либо межмолекулярно, либо внутримолекулярно.[2]
Взаимодействие протио- и дважды меченых дейтеросульфонильных анионов одновременно в эксперименте с кроссовером дает смесь продуктов кроссовера и непересекающихся продуктов в соотношении 1: 1: 1: 1, что ясно указывает на то, что реакция протекает по межмолекулярному механизму. Этот результат был неожиданным, так как внутримолекулярный механизм протекает через циклическое переходное состояние, напоминающее шестичленное кольцо, которое, как известно, является предпочтительным переходным состоянием во многих органических механизмах. Тот факт, что эта реакция протекает по межмолекулярному, а не внутримолекулярному механизму, позволяет сделать вывод о наличии определенных ограничений на геометрию нуклеофильной атаки в SN2 реакции.[2][14] Эта концепция была дополнительно исследована во многих последующих эндоциклических рестрикционных тестах.[15]
Неорганическая химия
Механизмы в неорганической и металлоорганической химии часто сложны и трудно поддаются экспериментальному определению. Каталитические механизмы особенно сложно изучать в тех случаях, когда невозможно выделить какой-либо металлический комплекс, за исключением предварительного катализатора. В тематическом выпуске журнала Dalton Transactions 2013 года под названием «Механическая металлоорганическая химия», приглашенный редактор. Роберт Х. Крэбтри рассказывает историю, в которой в середине 20 века основоположник химии карбонилгидридов металлов назвал металлоорганические механизмы «химической философией».[8] В тематическом выпуске представлены семнадцать примеров современных механистических исследований металлоорганических реакций. Во многих случаях перекрестные эксперименты, эксперименты по скремблированию изотопов, кинетические изотопные эффекты и вычислительные исследования используются вместе, чтобы прояснить даже несколько аспектов металлоорганического механизма.
Кроссовер-эксперименты обеспечивают такое уникальное понимание неорганических механизмов, что иногда необычные изотопы используются для важного кроссоверного эксперимента. В работе Э.Л. Муттертиса на декаарбониле дирения был проведен кроссоверный эксперимент с использованием 185Re и 187Re для определения механизма реакций замещения димеров карбонила рения. Чтобы различить эти изотопы в продуктах, использовали масс-спектрометрию. В том же исследовании были проведены эксперименты по кроссоверу с использованием 13СО и 12CO.[16] Изотопное обогащение из начального изотопного распределения 63Cu и 65Cu изучалась в экспериментах по изотопному кроссоверу, недавно проведенных В.В. Фокин о азид-алкиновых циклоприсоединениях, катализируемых медью (I). Результаты этих экспериментов приводят к выводу, что в каталитическом цикле этой важной реакции щелчка участвует двухъядерный промежуточный продукт меди.[17]
Восстановительное устранение
Восстановительное удаление является обычным этапом в механизмах металлоорганических реакций, особенно в каталитические циклы. В каталитических циклах, которые образуют связи C-H или C-C, восстановительное отщепление часто является конечной стадией образования продукта.[18]Квадрат плоский d8 Комплексы металлов часто являются активными катализаторами в реакциях образования связи C-H или C-C, и восстановительное отщепление из этих частиц хорошо известно. Существует несколько известных механизмов восстановительного удаления из плоского квадрата d.8 комплексы. При диссоциативном механизме один лиганд диссоциирует, и происходит восстановительное отщепление от трехкоординированного промежуточного соединения. При недиссоциативном механизме восстановительное удаление происходит из самого плоского квадратного комплекса. Лиганды, подвергающиеся восстановительному удалению, должны быть СНГ друг к другу или иначе должны перестроиться, чтобы быть СНГ прежде, чем они смогут редуктивно устранить. Наконец, в ассоциативном механизме пятый лиганд объединяется, и восстановительное отщепление происходит между двумя соседними группами в образующемся квадратно-пирамидальном комплексе.[4]
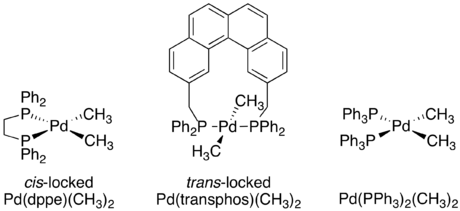
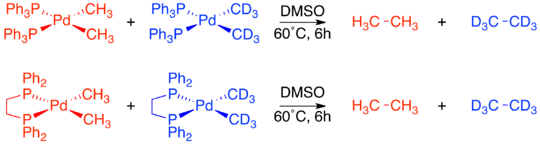
Независимо от конкретного механизма, очевидно, что восстановительное элиминирование - это внутримолекулярный процесс, который связывает два соседних лиганда. Хотя сейчас это может показаться очевидным, когда впервые изучались металлоорганические механизмы, доказательств этих ограничений не было. Серия экспериментов с кроссовером, описанная Дж. Стилл были одними из первых экспериментов, продемонстрировавших, что восстановительное удаление является внутримолекулярным процессом и что несмежные группы не устраняют восстановительным путем.[4][19][20]Несколько квадратных плоских d8 В исследовании использовали разновидности палладия, каждая из которых имеет два связанных фосфиновых лиганда и две связанные метильные группы. Один комплекс, Pd (dppe) (CH3)2, был заперт в СНГ-подтверждение хелатированием фосфина 1,2-бис (дифенилфосфино) этаном (dppe). Второй комплекс, Pd (трансфос) (CH3)2 был заблокирован в транс-подтверждении с помощью «трансфоса», хелатирующего фосфина с жестким ароматическим линкером.[19]
Комплексы с СНГ-метильные группы, как уже было известно, подвергаются восстановительному отщеплению с образованием этана. Кроссовер эксперимент был проведен как на Pd (dppe) (CH3)2 и Pd (PPh3)2(CH3)2. В обоих случаях продуктов кроссовера не наблюдалось, что свидетельствует о внутримолекулярном характере восстановительного элиминирования.[19]
В отличие от двух СНГ-подтверждающие комплексы, Pd (трансфос) (CH3)2 не подвергался восстановительному удалению даже при нагревании до 100 ° C. Однако добавление метилиодида к Pd (трансфос) (CH3)2 сразу произвел этан. Чтобы определить, ограничивается или нет это восстановительное удаление только соседними лигандами, был проведен эксперимент по мечению изотопов. Единственным продуктом был меченный дейтерием продукт СНГ-исправление. Это привело к окончательному выводу, что только лиганды, прилегающие друг к другу на металлическом комплексе, способны к восстановительному удалению.[4][19]
В этом исследовании также отслеживались и анализировались данные о скорости реакции, демонстрирующие ценность использования нескольких стратегий в согласованных усилиях, направленных на получение как можно большего количества информации о химическом процессе. Среди других скоростных экспериментов, скорости реакции СНГ-транс-изомерию наблюдали в качестве растворителя и варьировали концентрацию избыточного фосфинового лиганда. Эти результаты были использованы для установления механизма этой изомеризации в плоском квадрате d8 разновидности палладия, которые состоят из ассоциации растворителя или фосфина с последующим псевдовращением и последующей диссоциацией растворителя или фосфина.[19]
Биохимия
Механизмы реакций, катализируемых ферментами, также можно изучить с помощью перекрестных экспериментов. Примеры применения этой техники в биохимия включают изучение реакций, катализируемых нуклеозиддифосфогексозо-4,6-дегидратазами, катализируемое аконитазой отщепление воды из цитрата, а также различные реакции, катализируемые коферментом B12-зависимые ферменты, среди прочего. В отличие от исследований по мечению изотопов в органической и металлоорганической химии, в которых обычно используется дейтерий, когда требуется изотоп водорода, в экспериментах по биохимическому кроссоверу часто используется тритий.[21] Это связано с тем, что тритий радиоактивен и его можно отслеживать с помощью авторадиографы гелей в гель-электрофорез.
Механизм действия аконитазы
Эксперименты по мечению изотопов и эксперименты по кроссоверу были важны для первых попыток понять механизм аконитаза действие. Эксперименты по изотопному скремблированию с использованием трития, дейтерия и 18O проводили по реакции аконитазогидратазы И.А. Роуз и Э. О'Коннелл.[22] Используя результаты этих экспериментов, удалось построить общий механизм реакции. После этих ранних экспериментов была проведена дальнейшая работа по уточнению этого механизма.[23][24]
Одним из таких экспериментов по скремблированию изотопов была реакция [2р-3H] цитрат с аконитазой в присутствии 2-метил-СНГ-конитат. Эта реакция произвела как немеченые СНГ-аконитат и 2-метил- [3-3H] изоцитрат. Способность реакции производить межмолекулярный перенос трития в этом положении указывает на то, что протон, удаленный из цитрата, не обменивается с растворителем. Аналогичный эксперимент реагирует [2-18OH] изоцитрат с аконитазой не смог произвести меченный изотопами цитрат, демонстрируя, что гидроксильная группа, в отличие от удаленного протона, обменивается с растворителем при каждом обороте.[21][22]
Смотрите также
Рекомендации
- ^ а б c d е ж грамм час я j k л Кэрролл, Феликс А .; Перспективы структуры и механизма в органической химии; Брукс / Коул Паблишинг, Пасифик Гроув, Калифорния, 1998.
- ^ а б c d Брукер, Рейнхард; Продвинутая органическая химия: механизмы реакции; Академик Пресс, Сан-Диего, 2002.
- ^ http://www.chemgapedia.de/vsengine/vlu/vsc/en/ch/12/oc/vlu_organik/aufklaerung/aufklaerung_e_kreuz_kinetik.vlu.html
- ^ а б c d е Крэбтри, Роберт Х .; Металлоорганическая химия переходных металлов; Третье изд. Уайли, штат Нью-Йорк, 2001.
- ^ а б c d е Эдвардс, Джон О., Эд; Успехи в неорганической химии: механизмы неорганических реакций; т. 17, 1972.
- ^ Сяопин Сунь (5 июня 2013 г.). Органические механизмы: реакции, методология и биологические применения. Джон Вили и сыновья. ISBN 978-1-118-50791-9.
- ^ Эльдик, Р. Chem. Ред. 2005, 105, 1917.
- ^ а б c Crabtree, R.H .; Dalton Trans., 2013, 42, 4104.
- ^ Адити Сангал. Продвинутая органическая химия Кришны; Том 1. Кришна Пракашан СМИ. ISBN 978-81-8283-078-3.
- ^ а б Фрэнсис А. Кэри; Ричард Дж. Сандберг (13 июня 2007 г.). Продвинутая органическая химия: Часть A: Структура и механизмы. Springer. ISBN 978-0-387-44897-8.
- ^ Хорспул, Уильям М .; Lenci, Francesco, Eds; Справочник CRC по органической фотохимии и фотобиологии; CRC Press, 2004.
- ^ а б Lyon, R.K .; Леви, Д. Варенье. Chem. Soc. 1961, 83, 4290.
- ^ Денисов, Э.Т .; Денисова Т.Г .; Покидова, Т.С .; Справочник инициаторов свободных радикалов; John Wiley & Sons, Хобокен, Нью-Джерси, 2003.
- ^ Tenud, L .; Farouq, S .; Seible, J .; Эшенмозер, А. Helv. Чим. Acta 1970, 53, 2059.
- ^ Клюв, П. Соотв. Chem. Res. 1992, 25, 215.
- ^ Штольценберг, А. М .; Э. Л. Муэттертиес. Варенье. Chem. Soc. 1983, 105.4, 822.
- ^ Worrell, B.T .; Malik, J.A .; Фокин, В.В. Наука 2013, 340, 457.
- ^ Королевское химическое общество (Великобритания). Дивизия Фарадея (2003). Квантовая неорганическая химия. Королевское химическое общество. ISBN 978-0-85404-967-7.
- ^ а б c d е Гилли, С. Варенье. Chem. Soc. 1980, 102, 4933.
- ^ http://www.ilpi.com/organomet/reductive.html
- ^ а б Сильверман, Ричард Б .; Органическая химия реакций, катализируемых ферментами; Академик Пресс, Лондон, 2002.
- ^ а б Rose, I.A .; О'Коннелл, Э. J. Biol. Chem. 1967, 242, 870. http://www.jbc.org/content/242/8/1870.long
- ^ Glusker, J.P. J. Mol. Биол. 1968, 38, 149.
- ^ Виллафранка, J.J. J. Biol. Chem. 1971, 249, 6149.