WikiDer > Циклический нуклеотид-управляемый ионный канал
Циклические нуклеотидно-управляемые ионные каналы или же Каналы КПГ находятся ионные каналы эта функция в ответ на привязку циклические нуклеотиды. Каналы КПГ неизбирательный катион каналы, которые находятся в мембранах различных типов тканей и клеток и имеют важное значение в сенсорная трансдукция а также клеточное развитие. Их функция может быть результатом комбинации связывания циклических нуклеотидов (цГМФ и цАМФ) и либо деполяризация или гиперполяризация мероприятие. Первоначально обнаружен в клетках, составляющих сетчатка глаза каналы CNG были обнаружены во многих разных типах клеток как в животное и растение королевства. Каналы КПГ имеют очень сложную структуру с различными подразделения и домены которые играют решающую роль в их функциях. Каналы CNG важны для функции различных сенсорных путей, включая зрение и обоняние, а также в других ключевых клеточных функциях, таких как гормон выпуск и хемотаксис. Каналы СПГ также были обнаружены в прокариоты, в том числе многие спирохета, хотя их точная роль в бактериальный физиология остается неизвестным.
Открытие
Открытие каналов CNG связано с открытием внутриклеточный мессенджеры, отвечающие за передачу ответов в сетчатке фоторецепторы. До их открытия считалось, что циклические нуклеотиды сыграл роль в фосфорилирование. В 1985 году было обнаружено, что cGMP смог напрямую активировать светозависимый ответ стержень ионные каналы изучая адаптированные к свету сетчатка лягушек.[1] Каналы КПГ были также обнаружены в конус фоторецепторы, химиочувствительные реснички из обонятельные сенсорные нейроны, а шишковидная железа. После выявления аминокислоты из очищенных белков, клонирование и функциональная экспрессия каналов CNG. Молекулярное клонирование позволил открыть подобные каналы во многих других тканях.[2][3] В 2000 году ученые провели исследования с использованием сетчатки мыши и молекулярного клонирования, чтобы найти новую субъединицу канала, CNG6.[4]
Функция
Каналы CNG выполняют важные функции в преобразование сигнала в сетчатка фоторецепторы и нейроны обонятельных рецепторов. Они напрямую активируются циклическими нуклеотидами, и для активации каждого канала необходимо примерно 4 циклических нуклеотида. Каналы CNG неселективны и позволяют щелочь ионы поступают в клетку или из нее, экспрессируя каналы CNG на ее мембране. Этот поток ионов может привести либо к деполяризация или же гиперполяризация. Каналы CNG могут быть активированы лагерь или же cGMP исключительно, а иногда и комбинацией обоих cNMP, и некоторые каналы более избирательны, чем другие. Несмотря на то, что активность этих каналов мало зависит от напряжения, они по-прежнему считаются каналами, зависящими от напряжения. Кальций, кальмодулин, и фосфорилирование модулировать открытие каналов КПГ.[3]
Основная роль каналов КПГ - сенсорная. трансдукция в различных тканях. Многие исследования показали, что каналы CNG в стержень и конус фоторецепторы, и они также были обнаружены в мозг, то сердце, то почки, и гонады.[3]
Канал КПГ гомологи в Caenorhabditis elegans, Drosophila melanogaster, и Лимулус полифем имеют неизвестные функции. Исследования показали наличие гомологов в C. elegans может иметь функции в химиочувствительность.[3]
Дальтонизм и дегенерация сетчатки возникает, когда каналы CNG имеют мутации. Мутации конкретно в субъединицах A и B приводят к полному и неполному ахроматопсия.[3]
Структура
Канал КПГ состоит из четырех подразделения вокруг центрального поры. Каждая белковая субъединица состоит из 6 трансмембранный сегменты (S1-S6), a P-петля, внутриклеточный аминоконцевой регион и карбоксильный конец область, край. P-петля и сегменты S6 вокруг поры, которая играет роль в ионной проводимости. Существует домен связывания циклических нуклеотидов (CNBD) и область соединения с сегментом S6 на карбокси-конце. Есть пост-CNDB регион в аминоконцевой.[5]
Альфа-субъединицы
Альфа-субъединицы циклического нуклеотидного канала включают:
- Циклический нуклеотид-управляемый канал альфа 1
- Циклический нуклеотид-управляемый канал альфа 2
- Циклический нуклеотид-управляемый канал альфа 3
- Циклический нуклеотид-управляемый канал альфа 4
Бета-субъединицы
Циклические нуклеотидно-управляемые бета-субъединицы канала включают:
Поры
Структура поры аналогична другим ионным каналам, содержащим P-петли. P-петля входит в мембрана поры с внеклеточной стороны и выходит в внутриклеточный сторона. Петля P входит как альфа-спираль и существует как размотанная нить. Спирали, покрывающие внутренняя мембрана выровняйте канал. Они также образуют 6 пучок спиралей что означает вход. Для того, чтобы открыть поры, конформационное изменение должен находиться во внутреннем пучке из шести спиралей.[5]
Циклический нуклеотид-связывающий домен
А Циклический нуклеотид-связывающий домен это внутриклеточный домен, расположенный в C-конец области и имеет последовательность, аналогичную последовательности других белков, связывающих циклические нуклеотиды. Предполагается, что домен состоит из β-гофрированный лист и два α-спирали. Β-гофрированный лист состоит из восьми антипараллельный пряди. Спирали α называются спиралями B и C. А лиганд первоначально связывается с β-гофрированным листом и через аллостерическая регуляция вызывает движение по α-спирали к β-складчатому листу. Α-спираль гибка в закрытых каналах. Когда α-спираль CNGA1 субъединица находится в непосредственной близости от другой α-спирали, они образуют межсубъединичную дисульфидные связи. Это происходит в основном в закрытых каналах, препятствуя движению α-спирали к β-складчатому листу. Когда лиганд связывается с β-складчатым листом, этот связанный циклический нуклеотид стабилизирует движение α-спирали к β-складчатому листу в каждой субъединице, отталкивая α-спирали друг от друга.[5][6]
C-линкер
С-линкер - это область, которая соединяет CNBD с сегментом S6. Область С-линкера способствует контакту между субъединицами канала, а также способствует тетрамеризации, образованию тетрамеры. Есть много остатки которые играют роль в модуляции каналов CNG. В этом процессе используются такие металлы, как никель, цинк, медь, и магний. С-линкерная область участвует в связывании связывания лиганда с открытием поры. С-линкерная область образует дисульфидные связи с N-концевыми участками. Дисульфидные связи изменяют функцию канала, поэтому они, скорее всего, лежат близко к третичная структура. Дисульфидные связи уменьшают свободная энергия открытого состояния по сравнению с закрытым состоянием. Конкретные цистеин остаток C481 в области C-линкера расположен всего в нескольких аминокислотах от связывающий домен. В закрытом состоянии C481 неактивен; C481 должен пройти конформационное изменение чтобы он был доступен для открытия канала. Дисульфидные связи образуются между соседними субъединицами и C481. Одновременно имеется остаток цистеина C35 на N-концевой области C-линкера, которая может достигать двух остатков C481, создавая более благоприятную дисульфидную связь по сравнению со связью C481-C481.[5][6]
S6 регион
Спонтанный дисульфидная связь формирование зависит от государства, подразумевая, что конформационное изменение в пучке спиралей связан со стробированием канала. Когда ионные каналы CNG закрыты, цитоплазматические концы спиралей S6 находятся в непосредственной близости друг от друга. Маленький катионы могут пройти через проем, что означает, что ворота находятся за пределами пучок спиралей и что спирали S6 связаны с конформационными изменениями в фильтре селективности.[6]
P регион
Область P образует петлю, петлю пор, соединяющую области S5 и S6, которые простираются до центральной оси канала. Ионные свойства определяются остатками в петле между S5 и S6. трансмембранный сегменты. P-область определяет ионную селективность управляемых циклическими нуклеотидами ионных каналов, которые также определяют диаметр пор каналов CNG. P-область функционирует как затвор канала, поскольку он предотвращает проникновение ионов в закрытом состоянии. Пора может быть заблокирована небольшими конформационными изменениями в этой области. Область P действует как фильтр ионной селективности, который изменяет структуру в открытой конформации. В открытом состоянии четыре идентичных субъединицы вносят вклад в одну область P-петли, которая формирует фильтр селективности.[6]
Семейство каналов CNG
У позвоночных семейство генов каналов CNG состоит из шести членов. Эти гены делятся на основе сходства последовательностей на два подтипа CNGA и CNGB.[7] Дополнительные гены, кодирующие каналы CNG, были клонированы из Caenorhabditis elegans и Drosophila melanogaster. Подблок канала CNG CNGA1, ранее называвшаяся субъединицей α стержня, экспрессировалась в фоторецепторах стержня и продуцировала функциональные каналы, которые управлялись cGMP при внешнем выражении в любом Xenopus ооциты или у человека эмбриональный линия клеток киндни (HEK293). У людей мутировавшие гены CNGA1 приводят к аутосомно-рецессивный форма пигментный ретинит, дегенеративная форма слепоты. CNGB1, ранее называемая стержневой β-субъединицей, является второй субъединицей стержневого канала. В отличие от CNGA1, субъединицы CNGB1, экспрессируемые по отдельности, не производят функциональные каналы CNG, но совместная экспрессия субъединиц CNGA1 и CNGB1 производит гетеромерный каналы с модуляцией, проникновение, фармакологияи специфичность циклических нуклеотидов сравнима со специфичностью нативных каналов.[8]
Форма каналов КПГ тетрамеры, и недавние исследования показывают, что нативные стержневые каналы состоят из трех субъединиц CNGA1 и одной субъединицы CNGB1. CNGA3 субъединицы, ранее называемые α-субъединицами конуса, образуют функциональные каналы, когда их экспрессия происходит экзогенно. С другой стороны, CNGB3, ранее называвшаяся β-субъединицей конуса, не имеет. Мутации в человеческих CNGA3 и CNGB3 участвуют в полном ахроматопсия, который является редким, аутосомно-рецессивным наследственным и врожденное заболевание характеризуется полным отсутствием цветового различия.[8]
CNGA2, ранее называемая обонятельной α-субъединицей, CNGA4, ранее называемые обонятельной субъединицей β, и CnGB1b участвуют в трансдукции одорант сигналы в обонятельных сенсорных нейронах, для которых субъединица стехиометрия и расположение неизвестны.[8]
В беспозвоночные, субъединица канала CNG под названием CNG-P1 была клонирована из D. melanogaster и выражается в усики и визуальная система, показывающая, что каналы CNG могут быть связаны с преобразованием света у беспозвоночных. Вторая предполагаемая CNG-подобная субъединица под названием CNGL, клонированная из D. melanogaster, экспрессируется в головном мозге. Два субблока канала CNG, Tax-2 и Tax-4, были клонированы в C. elegans и отвечают за химиочувствительность, термочувствительность, и нормальный аксон рост некоторых сенсорных нейронов в C. elegans.[8]
Связывающее событие
Лиганд может быть помещен на дно полости из-за взаимодействия с кассетой связывания фосфата (PBC). Эта полость относится к области CNBD, образованной β-валком, двухпетлевым β спираль. Изменения, вызванные связыванием лиганда, происходят в α-спиралях (αA, αB, αC и спираль PBC). Ролик β претерпевает лишь небольшие изменения во время связывания. После установки лиганда спирали αB и αC располагаются так, что образуют крышку над полостью. Как связывание влияет на спираль αA, пока неясно.[9]
Совместная и некооперативная активация
Резкая концентрация между каналами CNG и концентрацией лиганда показывает, что необходимы по крайней мере два или три циклических нуклеотида. Считается, что второй лиганд необходим для перехода канала из закрытого в открытый. Когда третий и четвертый лиганды связываются, открытое состояние канала стабилизируется.[9]У бактерий открытие каналов CNG является результатом некооперативного связывания.[9]С разной концентрацией лигандов, совместная привязка и некооперативное связывание возникает для адаптации к этим различным средам. При низких концентрациях лиганда кооперативное связывание лиганда редко, потому что кооперативное связывание при низких концентрациях ослабляет связывание между каналом и лигандом, снижая чувствительность канала.[9]
Селективность лиганда
Путем измерения токов, активируемых в иссеченных наизнанку участках мембраны при суперфузии с различными лиганд концентрации, чувствительность лиганда и селективность обоих эндогенно и экзогенно выраженные каналы КПГ были изучены. Все собственные каналы CNG реагируют на оба лагерь и cGMP, но для активации и открытия каналов необходимы меньшие концентрации цГМФ, чем цАМФ. Каналы CNG резко избирательны между цГМФ и цАМФ в палочках и колбочках, тогда как в OSN каналы одинаково хорошо реагируют на оба лиганда. Каналы CNG, обнаруженные в OSN, намного более чувствительны как к цГМФ, так и к цАМФ, чем каналы фоторецептора CNG. Исследования отношения доза-реакция показали, что активация канала сильно зависит от концентрации цГМФ; несколько молекул цГМФ кооперативно связываются с каналом. Поскольку каждая субъединица содержит один сайт связывания cNMP, и гомомерный и гетеромерный каналы, скорее всего, образуют тетрамерный комплекса, максимум четыре молекулы лиганда могут связываться с каналом. Селективность может быть достигнута путем дифференциального контроля близость для связывания лиганда, эффективности стробирования или их комбинации. Аффинность связывания означает, насколько прочно циклические нуклеотиды связываются с каналом. Под эффективностью понимается способность лиганда активировать и открывать канал после его связывания. Хотя эти процессы полезны для понимания селективности, они неразрывно связаны друг с другом, поэтому очень трудно экспериментально отделить один от другого.[3]
Каналы CNG не различают Na+ и K+ ионы, а также позволяют Ca2+ и Mg2+ пройти, хотя и медленнее. Прохождение этих двухвалентный ионы подавляют ток, переносимый Na+ и K+. Высококонсервативный остаток глютаминовая кислота в фильтре селективности каналов CNG образует высокоаффинный сайт связывания для Ca2+. Более того, бактериальный неселективный катионный канал, называемый каналом NaK, содержит последовательность фильтра селективности, аналогичную таковой для каналов CNG. в Кристальная структура канала NaK, дискретный Ca2+-связывающий сайт во внеклеточном отверстии поры был идентифицирован.[9]
Подавление каналов CNG
Исследования показали дифференциальное ингибирование каналов CNG посредством диацилглицерин (DAG) в Xenopus ооциты. DAG можно использовать как ингибитор закрытого состояния. Использование DAG для подавления гомомультимерных стержневых каналов или каналов, содержащих два или более одинаковых пептидные цепи, было похоже на ингибирование собственных стержневых каналов. Использование DAG для подавления гомомультимерных обонятельных каналов было не столь эффективным, даже при высокой концентрации DAG. Для эффективного ингибирования канала требуется более одной молекулы DAG. Молекулы DAG позиционируются, чтобы стабилизировать закрытое состояние канала CNG, связываясь с каналом или изменяя взаимодействие между липидный бислой из клеточная мембрана и канал. Исследования с химеры палочка и обонятельные каналы предполагают, что различия в ингибировании DAG обусловлены различиями в прикрепленной петле трансмембранный сегмент.[10]
Физиологическое значение
Фоторецепторы
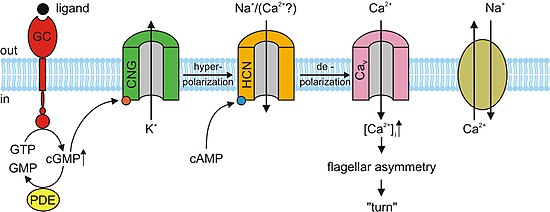
В отсутствие света cGMP связывается с каналами CNG в фоторецепторах. Эта привязка заставляет каналы открываться, что позволяет натрий (Na+) и кальций (Ca2+) ионы поступают в клетку, заставляя внешний сегмент фоторецептора деполяризовать. Этот деполяризующий поток ионов известен как темное течение. Когда сетчатка Если глаз улавливает свет, возникает реакция, известная как каскад фототрансдукции. Это преобразование сигнала путь, который приводит к активации фермента фосфодиэстераза, который гидролизует цГМФ в 5’-GMP, снижая концентрацию цГМФ. В отсутствие цГМФ каналы КПГ в фоторецепторах закрываются, предотвращая прохождение вышеупомянутого темнового тока. Это, в свою очередь, вызывает гиперполяризация внешнего сегмента фоторецептора, предотвращая распространение потенциал действия и выпуск глутамат.[3][5] Исследования показали, что чрезмерная активация cGMP-зависимых каналов CNG в фоторецепторах может привести к их дегенерации. Если каналы CNG на фоторецепторе постоянно активированы, Ca2+ и Na+ поток ионов во внешний сегмент фоторецептора будет увеличиваться, так что он деполяризуется за пределы темнового тока. Через петлю положительной обратной связи это увеличило бы ток Ca2+ в камеру. Высокая концентрация Са2+ в фоторецепторной клетке приведет к ее гибели, запрограммированной гибели клетки или апоптоз.[11]
Пигментный ретинит
Пигментный ретинит (РП) - это генетический заболевание, при котором пациенты страдают дегенерацией фоторецепторов палочки и колбочки. Утрата начинается с периферийное зрение и переходит в центральную поле зрения, оставляя пациента слепым к среднему возрасту.
Около 1% пациентов с РП имеют мутации в cGMP альфа-субъединица. Выявлено восемь мутаций, четыре из них бессмысленные мутации, один - это удаление это включает большую часть транскрипционной единицы. Остальные три миссенс-мутации и мутации сдвига рамки считывания, что приводит к укорочению аминокислотной последовательности на С-конце. До сих пор не известно, почему отсутствие cGMP-управляемых катионных каналов вызывает деградацию фоторецепторов. Мутации, вызывающие RP, также были обнаружены в родопсин ген и в альфа- и бета-субъединицах стержня фосфодиэстераза, которые кодируют стержень фототрансдукция каскады. Мутация этих субъединиц косвенно нарушает функцию стержневых cGMP-управляемых каналов, что означает, что существует общий механизм деградации фоторецепторов.[12]
Клетки кардиостимулятора
В нервной системе, сердце и некоторых внутренних органах клетки содержат закрытые циклическими нуклеотидами каналы, которые определяют ритм органа. Эти каналы, формально называемые активируемыми гиперполяризацией циклическими нуклеотидными каналами (Каналы HCN), также называются «каналами кардиостимулятора» из-за этой важной функции. Как следует из их названия, они открыты в условиях гиперполяризации и закрыты во время деполяризации. Значение этого в синоатриальный узел (и в качестве резервной копии в атриовентрикулярный узел) заключается в том, что когда сердце перезагружается или гиперполяризуется после каждого удара, каналы HCN открываются, позволяя положительным ионам устремляться в клетку (так называемый смешной ток), вызывая еще одно событие деполяризации и последующее сердечное сокращение. Это придает сердцу автоматизм. Первичный циклический нуклеотид, действующий вместе с каналом HCN, - это цАМФ.[13]
Обонятельные сенсорные нейроны
Почти все отзывы на одоранты в обонятельные сенсорные нейроны (OSN) поддерживаются каналами CNG. Когда одорант связывается со своим специфическим рецептором в химиочувствительных реснички мембрану, он активирует G протеин, что вызывает последующую реакцию, активирующую фермент аденилилциклаза (AC). Этот фермент отвечает за увеличение концентрации цАМФ в OSN. цАМФ связывается с каналами CNG в мембране OSN, открывая их и делая клетку очень проницаемой для Ca2+. Ионы кальция поступают в клетку, вызывая деполяризация. Как и во всех других типах ячеек, каналы CNG в OSN также позволяют Na+ течь в ячейку. Кроме того, повышенный Ca2+ концентрация внутри клетки активирует Ca2+-зависимый хлорид (Cl−) каналы, которые вызывают внутриклеточный Cl− ионы также выходят из клетки, усиливая событие деполяризации. Эта деполяризация стимулирует потенциал действия что в конечном итоге сигнализирует о приеме одоранта. Помимо цАМФ-управляемых ионных каналов, небольшая подгруппа OSN также имеет цГМФ-селективные каналы CNG, которые содержат субъединицу CNGA3.[3]
Сперматозоиды
лагерь и cGMP опосредуют несколько клеточных реакций, таких как акросомный экзоцитоз, или слияние мужчины сперма женщине яйцо, и хемотаксис. в морской еж разновидность, Стронгилоцентротус пурпуратус, speract, короткое пептид, был изучен. Speract активирует рецепторного типа гуанилатциклаза (GC) и стимулирует рост внутриклеточный Концентрации цГМФ. Speract также увеличивает концентрацию кальций. Хотя до сих пор не установлено прямой причинно-следственной связи, ранее упомянутые наблюдения предполагают, что цГМФ активирует кальций. проводимость. Каналы CNG являются главными кандидатами на путь проникновения кальция из-за их высокой проницаемости для кальция. Каналы CNG еще предстоит обнаружить путем проверки гомологии. В млекопитающие, то яичко Выраженные субъединицы канала CNG - это A3, B1 и B3. Гетерологичное выражение субъединицы A3 клонированный из яички и произвел каналы, которые были чувствительны и селективны к цГМФ. Возможно, что эти каналы участвуют в потоке кальция, стимулированном цГМФ, в сперма. Однако более обширная характеристика канала не была проведена из-за низкой вероятности обнаружения активности канала. Поскольку субъединица A3 нокаутные мыши находятся плодородныйКаналы CNG могут участвовать в той или иной форме контроля подвижности и даже в хемотаксическом плавании или в акросомном экзоцитозе. Однако GC рецепторного типа в сперме млекопитающих еще предстоит идентифицировать. Сперма мыши экспрессирует другие каналы, такие как CatSper1. Мужское бесплодие может быть достигнуто путем нарушения гена CatSper1; кроме того, приток кальция, вызванный цАМФ, устраняется в мутант мышей. Несмотря на то что CatSper необходимы дополнительные субъединицы, чтобы стать функциональными, они не связаны с каналами CNG, потому что CatSper не имеет сайта связывания cAMP / cGMP. Возможно, что субъединицы CNG и CatSper собираются с образованием проницаемых для кальция и циклических нуклеотид-чувствительных ионных каналов.[3]
Почка
cGMP-чувствительные каналы были проанализированы в мозговое вещество почекособенно в сборный канал клетки, влияющие на электролит и баланс жидкости. Активность канала КПГ контролируется взаимодействием между цГМФ-зависимая протеинкиназа и белок G1 из-за участия цГМФ в фосфорилирование механизмы. В клетках внутреннего мозгового собирательного канала каналы CNG демонстрируют удельную катионную селективность, проницаемость и проницаемость для кальция. фармакология очень похож на циклические нуклеотидные ионные каналы. А стимулятор, предсердный натрийуретический фактор (АНФ) увеличивает производство цГМФ в почках, что увеличивает функцию клубочки сочетанием расслабления и сжатия артериолы.[14] Различия между кДНК сетчатки и почек были связаны с функциональными различиями между каналами CNG в этих двух тканях.[3]
Гонадотропин-рилизинг-гормон
Идентифицированы субъединицы A2, A4 и B1 ионного канала CNG в линии нейрональных клеток, которые секретируют гонадотропин-рилизинг-гормон (GrH). Эти три субъединицы образуют каналы CNG на химиочувствительных реснички OSN. При высоком уровне внеклеточного кальция удельная проводимость каналов CNG в палочках и OSN значительно меньше, чем измеренная в нейрональной линии. Представляется сомнительным, что каналы CNG могут создавать большую удельную проводимость.[3]
Растения
Каналы ионов КПГ у растений аналогичны аминокислотная последовательность и структура неизбирательная катион Каналы CNG у животных, а также трансмембранные K+-селективные семейные каналы шейкер. Однако есть существенные различия, которые наблюдаются исключительно в каналах заводского КПГ. Аминокислотная последовательность поры последовательности в каналах CNG растений не хватает фильтра селективности, обнаруженного в каналах CNG животных, а также отсутствует глицин-тирозин-глицин-аспартат (GYGD) мотив в K+-последовательность фильтра избирательности. Другие различия в последовательностях наблюдаются в каналах CNG растений, особенно в циклическом нуклеотиде. связывающий домен (CNBD). У растений Кальмодулин-связывающий домен (CaMBD) перекрывается α-спираль C в CNBD каналов CNG. У животных CaMBD расположены далеко от CNBD.[15]Каналы КПГ играют большую роль в заводе иммунитет и ответ на патогены или внешние инфекционные агенты. Они также были замешаны в апоптоз в растениях. Считается, что ионные каналы КПГ также участвуют в пыльца развитие у растений, однако его точная роль в этом механизме до сих пор неизвестна.[15]
В отличие от каналов CNG животных, каналы CNG растений не подвергались обширному биохимическому анализу в отношении их структуры.[15]
Прокариоты
Ионные каналы CNG обладают высокой степенью последовательности и структурного сходства с каналами CNG млекопитающих. [16] Подобно каналам CNG млекопитающих, связывание циклические нуклеотиды к CNBDs, как было показано, регулируют активность канала и изменяют конформационное состояние канала.[16][17] Поскольку эти каналы были обнаружены в спирохета и лептоспира разновидность,[16] их точная физиологическая функция у этих организмов остается неизвестной. В комбинации с фотоактивированный аденилилциклазы, они использовались как оптогенетический инструменты для подавления потенциал действия генерация в нейронах.[18]
Текущие и будущие исследования
Исследователи ответили на многие важные вопросы, касающиеся функций ионных каналов КПГ в зрении и обоняние. В других физиологических областях роль каналов CNG менее определена. С технологическим ростом теперь существует больше возможностей для понимания этих механизмов.[3]
Потому что оксид азота (NO) участвует в стимулировании синтеза цГМФ, проводятся дальнейшие исследования для понимания физиологического взаимодействия NO с каналами CNG, особенно в ковалентной модификации каналов CNG в OSN.[3]
Ученые дополняют механизм, участвующий во взаимодействии сайтов связывания и интерфейсов субъединиц. Это может отсутствовать в не взаимодействующих каналах CNG. Также возможно, что сайт связывания и ворота прикреплены к одной субъединице. Чтобы развить эти идеи, двойной электронно-электронный резонанс (DEER) и методы быстрой фиксации могут показать эти механистические движения.[9]
Исследование 2007 года предполагает, что из-за различных и сложных регуляторных свойств в дополнение к большому количеству каналов CNG в растениях необходимо провести многопрофильное исследование для исследования каналов CNG на заводе.[15] Другое исследование, проведенное в марте 2011 года, признает недавние данные обратной генетики, которые помогли в дальнейшем понимании каналов CNG в растениях, а также предлагает провести дополнительные исследования для выявления факторов, лежащих выше и ниже по течению, в передаче сигнала, опосредованной CNGC, у растений.[19]
Ученые предполагают, связывается ли DAG напрямую с каналом CNG во время ингибирования. Возможно, что DAG может встраиваться в трансмембранные домены в канале. Также возможно, что DAG вставляется в интерфейс между каналом и двухуровневым слоем. Молекулярный механизм ингибирования DAG до сих пор полностью не изучен.[10]
Смотрите также
Рекомендации
- ^ Фесенко Е.Е., Колесников С.С., Любарский А.Л. (1985). «Индукция циклическим GMP катионной проводимости в плазматической мембране наружного сегмента стержня сетчатки». Природа. 313 (6000): 310–3. Bibcode:1985Натура.313..310F. Дои:10.1038 / 313310a0. PMID 2578616.
- ^ Яу К.В. (апрель 1994 г.). «Циклические нуклеотид-управляемые каналы: расширяющееся новое семейство ионных каналов». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 91 (9): 3481–3. Bibcode:1994PNAS ... 91.3481Y. Дои:10.1073 / пнас.91.9.3481. ЧВК 43603. PMID 7513422.
- ^ а б c d е ж грамм час я j k л м Kaupp UB, Seifert R; Зайферт (июль 2002 г.). «Циклические нуклеотидно-управляемые ионные каналы». Physiol. Rev. 82 (3): 769–824. Дои:10.1152 / Physrev.00008.2002. PMID 12087135.
- ^ Герстнер А., Зонг X, Хофманн Ф., Биль М. (февраль 2000 г.). «Молекулярное клонирование и функциональная характеристика нового модулятора y циклической нуклеотидной субъединицы канала сетчатки мыши». Журнал неврологии. 20 (4): 1324–1332. Дои:10.1523 / JNEUROSCI.20-04-01324.2000. ЧВК 6772363. PMID 10662822.
- ^ а б c d е Матулеф, Кимберли; Заготта, Уильям Н. (2003). «Циклические нуклеотидно-управляемые ионные каналы». Ежегодный обзор клеточной биологии и биологии развития. 19 (1): 23–44. Дои:10.1146 / annurev.cellbio.19.110701.154854. PMID 14570562.
- ^ а б c d Ван, Цзэнчао; Цзайн, Юнцин; Личжи Лу; Руихуа Хуанг; Цинчао Хоу; Фансюн Ши (2007). "Молекулярные механизмы стробирования циклических нуклеотидных ионных каналов". Журнал генетики и геномики. 34 (6): 477–485. Дои:10.1016 / S1673-8527 (07) 60052-6. PMID 17601606.
- ^ Брэдли, Джонатан (2001). «Номенклатура субъединиц ионных каналов». Наука. 294 (5549): 2095–2096. Дои:10.1126 / science.294.5549.2095. ЧВК 2901924. PMID 11764791.
- ^ а б c d Матулеф К., Заготта В.Н.; Заготта (2003). «Циклические нуклеотидно-управляемые ионные каналы». Анну. Rev. Cell Dev. Биол. 19 (1): 23–44. Дои:10.1146 / annurev.cellbio.19.110701.154854. PMID 14570562.
- ^ а б c d е ж Cukkamane A, Seifert R, Kaupp UB (январь 2011 г.). «Кооперативные и некооперативные циклические нуклеотидно-управляемые ионные каналы». Тенденции в биохимических науках. 36 (1): 55–64. Дои:10.1016 / j.tibs.2010.07.004. PMID 20729090.
- ^ а б Crary JI, Dean DM, Nguitragool W., Kurshan PT, Zimmerman AL (декабрь 2000 г.). «Механизм ингибирования циклических нуклеотидных ионных каналов диацилглицерином». Журнал общей физиологии. 116 (6): 755–768. Дои:10.1085 / jgp.116.6.755. ЧВК 2231817. PMID 11099345.
- ^ Валлацца-Дешам, Жеральдин; Циа, Дэвид; Гонг, Цзе; Джеллали, Абдельджелил; Форстер, Валери; Сахель, Хосе А; Тессье, Люк-Анри; Пико, Серж (2005). «Чрезмерная активация циклических нуклеотид-управляемых каналов способствует нейрональной дегенерации фоторецепторов». Европейский журнал нейробиологии. 22 (5): 1013–1022. Дои:10.1111 / j.1460-9568.2005.04306.x. PMID 16176343.
- ^ Эшкрофт, Фрэнсис (1999). Ионные каналы и болезнь. Академическая пресса. ISBN 978-0-12-065310-2.
- ^ Ларссон, Х. П. (2010). «Как регулируется частота сердечных сокращений в синоатриальном узле? Еще одна часть головоломки».. Журнал общей физиологии. 136 (3): 237–241. Дои:10.1085 / jgp.201010506. ЧВК 2931147. PMID 20713549.
- ^ Биль, Мартин; Цзун, Сянган; Дистлер, Мадлен; Боссе, Ева; Клугбауэр, Норберт; Мураками, Манабу; Flockerzi, Veit; Хофманн, Франц (1994). «Другой член семейства циклических нуклеотид-управляемых каналов, экспрессируется в яичках, почках и сердце». Труды Национальной академии наук Соединенных Штатов Америки. 91 (9): 3505–3509. Bibcode:1994PNAS ... 91.3505B. Дои:10.1073 / пнас.91.9.3505. ЧВК 43608. PMID 8170936.
- ^ а б c d Каплан Б., Шерман Т., Фромм Х (май 2007 г.). «Циклические нуклеотид-управляемые каналы в растениях». FEBS Lett. 581 (12): 2237–46. Дои:10.1016 / j.febslet.2007.02.017. PMID 17321525.
- ^ а б c Brams, M .; Kusch, J .; Spurny, R .; Benndorf, K .; Уленс, К. (2014). «Семейство прокариотных циклических нуклеотидно-модулированных ионных каналов». Труды Национальной академии наук. 111 (21): 7855–7860. Bibcode:2014ПНАС..111.7855Б. Дои:10.1073 / pnas.1401917111. ISSN 0027-8424. ЧВК 4040583. PMID 24821777.
- ^ Джеймс, Захари М .; Борст, Эндрю Дж .; Хайтин, Йони; Френц, Брэндон; ДиМайо, Франк; Zagotta, William N .; Вислер, Дэвид (2017). «КриоЭМ структура прокариотического ионного канала с циклическими нуклеотидами». Труды Национальной академии наук. 114 (17): 4430–4435. Дои:10.1073 / pnas.1700248114. ISSN 0027-8424. ЧВК 5410850. PMID 28396445.
- ^ Бек, Себастьян; Ю-Стшельчик, Цзин; Полс, Деннис; Константин, Оана М .; Господи, Кристин Е .; Эманн, Надин; Киттель, Роберт Дж .; Нагель, Георг; Гао, Шицян (2018). «Синтетические активируемые светом ионные каналы для оптогенетической активации и ингибирования». Границы неврологии. 12: 643. Дои:10.3389 / fnins.2018.00643. ISSN 1662-453X. ЧВК 6176052. PMID 30333716.
- ^ Мёдер, Вольфганг; Уркхарт, Уильям; Унг, Хуэй; Йошиока, Кейко (2011). «Роль циклических нуклеотидно-управляемых ионных каналов в иммунитете растений». Молекулярный завод. 4 (3): 442–452. Дои:10.1093 / mp / ssr018. PMID 21459831.