WikiDer > Диазо
В диазо группа это органический часть состоящий из двух связанных азот атомы (азо) в конечной позиции. Общий заряд нейтральный органические соединения содержащие диазогруппу, связанную с атомом углерода, называются диазосоединения или диазоалканы[1] и описываются общей структурной формулой R2C = N+= N–. Простейшим примером диазосоединения является диазометан, CH2N2. Диазосоединения (R2C = N2) не следует путать с азосоединения типа R-N = N-R или с соединения диазония типа Р-Н2+.
Структура
В электронная структура диазосоединений характеризуется π-электронной плотностью, делокализованной по α-углероду и двум атомам азота, наряду с ортогональной π-системой с делокализацией электронной плотности только по концевым атомам азота. Потому что все Правило октета-удовлетворительные резонансные формы диазосоединений имеют формальные заряды, они являются членами класса соединений, известных как 1,3-диполи. Некоторые из наиболее стабильных диазосоединений представляют собой α-диазо-β-дикетоны и α-диазо-β-диэфиры, в которых электронная плотность дополнительно делокализована в электроноакцепторную карбонильную группу. Напротив, большинство диазоалканов без электроноакцепторных заместителей, включая сам диазометан, взрывоопасны. Коммерчески подходящим диазосоединением является этилдиазоацетат (N2CHCOOEt). Группа изомерных соединений с немногими схожими свойствами представляет собой диазирины, где углерод и два атома азота связаны кольцом.
Четыре резонансные структуры можно нарисовать:[2]
Соединения с диазогруппой следует отличать от диазоний соединения, которые имеют ту же концевую азогруппу, но несут общий положительный заряд, и азо соединения, в которых азогруппа связывает два органических заместителя.
История
Диазосоединения впервые были произведены Питер Грисс который открыл новую универсальную химическую реакцию, как подробно описано в его статье 1858 г. «Предварительное замечание о влиянии азотистой кислоты на аминонитро- и аминодинитрофенол».[3][4]
Синтез
Существует несколько методов получения диазосоединений.[5][6]
Из аминов
Альфа-акцептор-замещенный первичный алифатический амины R-CH2-NH2 (R = COOR, CN, CHO, COR) реагируют с азотистая кислота для образования диазосоединения.
Из диазометильных соединений
Пример электрофильное замещение использование диазометильного соединения представляет собой реакцию между ацилгалогенид и диазометан,[7] например, первый шаг в Синтез Арндта-Эйстера.
Путем диазопереноса
В диазоперенос определенный угольные кислоты реагировать с тозилазид в присутствии слабого основания, такого как триэтиламин или DBU. Побочным продуктом является соответствующий тозиламид (п-толуолсульфонамид). Эту реакцию еще называют Regitz диазоперенос.[8] Примеры: синтез трет-бутилдиазоацетата.[9] и диазомалонат.[10] Метил фенилдиазоацетат образуется таким образом путем обработки метилфенилацетата п-ацетамидобензолсульфонилазидом в присутствии основания.[11][12]

Механизм включает атаку енолята на концевом азоте, перенос протона и вытеснение аниона сульфонамида. Использование β-карбонилальдегида приводит к деформирующему варианту переноса Регитца, который полезен для получения диазосоединений, стабилизированных только одной карбонильной группой.[14]
От N-алкил-N-нитрозосоединения
Диазосоединения можно получить в реакция элиминации из N-алкил-N-нитрозосоединения,[15] например, при синтезе диазометана из Диазальда или MNNG:
(Показанный здесь механизм является одной из возможностей.[16] Для альтернативного механизма аналогичного образования диазометана из N-нитрозосульфонамид, см. страницу на Диазальд.)
Из гидразонов
Гидразоны находятся окисленный (дегидрирование) например с оксид серебра или оксид ртути например синтез 2-диазопропан из гидразона ацетона.[17] Другие окисляющие реагенты: тетраацетат свинца, диоксид марганца и Реактив Сверна. Тозилгидразоны RRC = N-NHT реагируют с основанием, например триэтиламин в синтезе кротилдиазоацетата[18] и в синтезе фенилдиазометан от ФЧНХТ и метоксид натрия.[19]
Реакция карбонил группа с гидразин 1,2-бис (трет-бутилдиметилсилил) гидразин с образованием гидразона сопровождается реакцией с йодан дифториодбензол дает диазосоединение:[20][21]
Из азидов
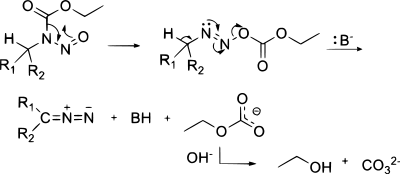
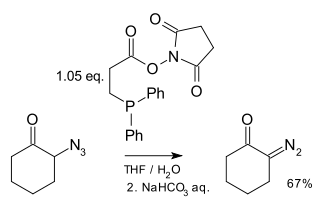
Описан один метод синтеза диазосоединений из азиды с помощью фосфины:[22]
Реакции
В циклоприсоединениях
Реакция взаимодействия диазосоединений как 1,3-диполей в диазоалкан 1,3-диполярные циклоприсоединения.
В качестве предшественников карбенов
Диазосоединения используются в качестве предшественников карбены, которые образуются в результате термолиза или фотолиза, например, в Перестановка Вольфа. Как таковые они используются в циклопропанирование например в реакции этилдиазоацетат с участием стирол.[23] Некоторые диазосоединения могут соединяться с образованием алкены в формальном димеризация карбена реакция.
Диазосоединения являются промежуточными продуктами в Реакция Бэмфорда-Стивенса из тозилгидразоны в алкены, опять же с промежуточным карбеном:
в Дойл-Кирмс реакция некоторые диазосоединения реагируют с аллилсульфидами с образованием гомоаллилсульфида. Внутримолекулярные реакции диазокарбонильных соединений обеспечить доступ к циклопропанам. в Расширение кольца Бюхнера диазосоединения реагируют с ароматическими кольцами с расширением цикла.
Как нуклеофил
В Реакция Бюхнера-Курциуса-Шлоттербека дает кетоны из альдегидов и алифатических диазосоединений:
Тип реакции нуклеофильное присоединение.
Встречаемость в природе
Два семейства продуктов природного происхождения включают диазогруппу: кинамицин и ломаивитицин. Эти молекулы являются интеркаляторами ДНК с диазофункциональностью в качестве «боеголовок». Потеря N2, индуцируемый восстановительно, образует расщепляющий ДНК флуоренильный радикал.
Смотрите также
использованная литература
- ^ Термин диазоалкан используется некоторыми авторами для обозначения любого замещенного диазометана (то есть всех диазосоединений). Однако другие авторы используют этот термин для обозначения исключительно диазосоединений с алкильными заместителями, которые не содержат других функциональных групп (что исключает такие соединения, как диазо (дифенил) метан или этилдиазоацетат).
- ^ F.A. Кэри Р.Дж. Сундберг Продвинутая органическая химия, 2-е издание
- ^ Тревор И. Уильямс, «Грисс, (Иоганн) Питер (1829–1888)», Оксфордский национальный биографический словарь, Oxford University Press, 2004 г.
- ^ Питер Грисс (1858) "Vorläufige Notiz über die Einwirkung von salpetriger Säure auf Amidinitro- und Aminitrophenylsäure", (Предварительное уведомление о реакции азотистой кислоты с пикрамовой кислотой и аминонитрофенолом), Annalen der Chemie und Pharmacie, 106 : 123-125.
- ^ Марш, Джерри (1985), Продвинутая органическая химия: реакции, механизмы и структура (3-е изд.), Нью-Йорк: Wiley, ISBN 0-471-85472-7
- ^ Новые синтезы диазосоединений Герхард Маас Энгью. Chem. Int. Эд. 2009, 48, 8186 – 8195 Дои:10.1002 / anie.200902785
- ^ пример Органический синтез, Сб. Vol. 3, стр.119 (1955); Vol. 26, стр.13 (1946).Ссылка на сайт
- ^ M. Regitz, Angew. Chem., 79, 786 (1967); Энгью. Chem. Междунар. Эд. Англ., 6, 733 (1967).
- ^ Organic Syntheses, Coll. Vol. 5, стр. 179 (1973); Vol. 48, стр. 36 (1968). Ссылка на сайт
- ^ Organic Syntheses, Coll. Vol. 6, стр. 414 (1988); Vol. 59, стр.66 (1979). Ссылка на сайт
- ^ Хью М. Л. Дэвис; Вэнь-хао Ху; Дун Син (2015). «Метилфенилдиазоацетат». EEROS: 1–10. Дои:10.1002 / 047084289X.rn00444.pub2. ISBN 9780470842898.
- ^ Сельварадж, Рамаджеям; Chintala, Srinivasa R .; Тейлор, Майкл Т .; Фокс, Джозеф М. (2014). «3-гидроксиметил-3-фенилциклопропен». Орг. Синтезатор. 91: 322. Дои:10.15227 / orgsyn.091.0322.
- ^ Шишков, И. В .; Rominger, F .; Хофманн, П. (2009). «Замечательно стабильные α-карбонильные карбены меди (I): синтез, структура и механистические исследования реакций циклопропанирования алкенов». Металлоорганические соединения. 28 (4): 1049–1059. Дои:10.1021 / om8007376.
- ^ Курти, Ласло (2005). Стратегические применения названных реакций в органическом синтезе: история вопроса и подробные механизмы. Чако, Барбара. Берлингтон: Elsevier Science. ISBN 9780080575414. OCLC 850164343.
- ^ Пример: Organic Syntheses, Coll. Vol. 6, стр.981 (1988); Vol. 57, стр.95 (1977). Ссылка на сайт
- ^ Химия диазония и диазогрупп. Часть 1. Патай, Саул., Wiley InterScience (Интернет-служба). Чичестер: Вайли. 1978 г. ISBN 9780470771549. OCLC 501316965.CS1 maint: другие (ссылка на сайт)
- ^ Organic Syntheses, Coll. Vol. 6, стр. 392 (1988); Vol. 50, стр. 27 (1970). Ссылка на сайт
- ^ Organic Syntheses, Coll. Vol. 5, стр. 258 (1973); Vol. 49, стр. 22 (1969). Ссылка на сайт
- ^ Organic Syntheses, Coll. Vol. 7, стр. 438 (1990); Vol. 64, с.207 (1986).http://www.orgsyn.org/orgsyn/prep.asp?prep=CV7P0438
- ^ Лей, X .; Порко Джа, Дж. (2006). «Полный синтез диазобензофлуоренового антибиотика (-) - кинамицина С1». Журнал Американского химического общества. 128 (46): 14790–14791. Дои:10.1021 / ja066621v. PMID 17105273.
- ^ Неуловимый натуральный продукт синтезирован Стю Борман Новости химии и машиностроения 31 октября 2006 г. Ссылка на сайт В архиве 2008-08-28 на Wayback Machine.
- ^ Фосфин-опосредованное превращение азидов в диазосоединения Эдди Л. Майерс и Рональд Т. Рейнс Энгью. Chem. Int. Эд. 2009, 48, 2359 –2363 Дои:10.1002 / anie.200804689
- ^ Organic Syntheses, Coll. Vol. 6, стр. 913 (1988); Vol. 50, стр.94 (1970).Ссылка на сайт