WikiDer > Антагонист H3 рецептора
An ЧАС3 антагонист рецепторов это классификация наркотики используется для блокировки действия гистамин на ЧАС3 рецептор.
В отличие от H1 и H2 рецепторы, которые имеют преимущественно периферическое действие, но вызывают седация если они заблокированы в головном мозге, H3 рецепторы в основном находятся в головном мозге и представляют собой тормозные ауторецепторы, расположенные на гистаминергических нервных окончаниях, которые модулируют высвобождение гистамин. Высвобождение гистамина в головном мозге вызывает вторичное высвобождение возбуждающих веществ. нейротрансмиттеры такие как глутамат и ацетилхолин через стимуляцию H1 рецепторы в кора головного мозга. Следовательно, в отличие от H1 антагонист антигистаминные препараты успокаивающие, H3 антагонисты стимулятор и ноотропный эффекты и исследуются как потенциальные лекарства для лечения нейродегенеративных состояний, таких как Болезнь Альцгеймера.
Примеры селективного H3 антагонисты включают клобенпропит,[1] ABT-239,[2] ципроксифан,[3] Conessine, A-349 821,[4] бетагистин, и питолизант.[5]
История
Гистамин H3 рецептор (H3R) был открыт в 1983 году и был одним из последних рецепторов, обнаруженных с помощью обычных фармакологический методы.[6] Его структура была обнаружена позже в рамках попытки идентифицировать обычно выражаемый Рецептор, связанный с G-белком (GPCR) в Центральная нервная система (ЦНС).[7] Фармакология H3R очень сложен, что затрудняет разработку лекарств. Много разного функционала изоформы H3R существует, что означает, что теоретически возможно нацелить конкретную на одну изоформу. Однако это может быть сложно из-за генетической изменчивости изоформ, а также из-за разной функциональности каждой из них.[8]
ЧАС3р лиганды теперь классифицируются как агонисты, антагонисты или обратные агонисты, в зависимости от используемого анализа передачи сигналов.[9][10]
Механизм действия
H3R представляет собой GPCR и был описан как пресинаптический ауторецептор, регулирующий высвобождение гистамина, а также как гетерорецептор, регулирующие нейротрансмиттеры, такие как ацетилхолин, дофамин, серотонин, норэпинефрин и ГАМК.[11] Рецептор имеет высокую конститутивную активность, что означает, что он может передавать сигналы без активации агонистом.[10] ЧАС3R регулирует высвобождение нейромедиаторов, влияя на количество внутриклеточных кальций. При активации он блокирует приток кальция, что приводит к подавлению высвобождения нейротрансмиттеров.[7] Антагонисты рецепторов вызывают синтез и высвобождение этих нейромедиаторов, что способствует пробуждению.[12] ЧАС3Rs в основном выражены на гистаминергические нейроны ЦНС, но также могут быть обнаружены в различных областях периферическая нервная система.[10] H3R был обнаружен в высоких плотностях в базальный ганглий, гиппокамп и корковый области, которые являются всеми областями мозга, связанными с познание.[11] Гистаминергическая система была описана как играющая роль в патофизиология когнитивных симптомов таких заболеваний, как болезнь Альцгеймера, шизофрения и нарколепсия.[7]
Разработка
Ранний фармакофор
В начале разработки H3R-лиганды основное внимание уделялось агонисту гистамину, который содержит имидазол кольцо в его структуре. Структурное разнообразие среди H3R ограничен, и все известные H3Сегодня агонисты содержат имидазольное кольцо.[10][9] Проблема с соединениями, содержащими имидазол, заключалась в ингибировании цитохром P450 изоферменты что привело к серьезным лекарственным взаимодействиям.[11][10] Им также было трудно пересечь гематоэнцефалический барьер. Были протестированы многие соединения, но они оказались слишком токсичными, чтобы быть полезными.[6]
Включение целевой функции ЧАС4р и другие рецепторы также были проблемой с антагонистами на основе имидазола. Широкое разнообразие потенциальных патофизиологов H3R при заболеваниях головного мозга делает H3R-антагонисты, интересующие разработка лекарств.[7]
Тиоперамид
Первым разработанным антагонистом на основе имидазола был тиоперамид который был очень сильным и селективным, но не мог использоваться в качестве лекарства из-за гепатотоксичность. Первоначально он был разработан для улучшения бодрствования и нарушения когнитивных функций.[6] Недавнее исследование показало, что тиоперамид может лечить циркадный ритм пациентов с болезнь Паркинсона.[13]
Новый фармакофор
Основное внимание было обращено на неимидазол H3Антагонисты R. По всей видимости, они не взаимодействуют с семейством CYP на том же уровне, что и H на основе имидазола.3R антагонисты и легче достигают ЦНС. К сожалению, возникли другие проблемы, такие как сильная привязка к hERG K+ канал, фосфолипидоз а также проблемы с P-gp субстрат. Сильная связь с hERG K+ канал может привести к Удлинение интервала QT.[11]
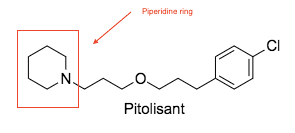
Питолизант
Питолизант был первым антагонистом /обратный агонист перейти к клинические испытания и является единственным лекарством, одобренным регулирующими органами США и Европы. Он очень селективен для H3 рецептор. Питолизант имеет высокий пероральный биодоступность и легко получает доступ к мозгу. Он проходит обширную эффекты первого прохода сквозь CYP4A4 фермент в кишечнике. Целый метаболический путь еще не установлено, но включает несколько ферментов CYP.[14] Доказано, что он полезен для поддержания бодрствования в дневное время у людей с нарколепсией.[6] Побочные эффекты обнаруженные в клинических испытаниях оказались дозозависимыми. Как и ожидалось, некоторые из побочных эффектов были психоневрологический по характеру наиболее распространенными из которых были бессонница, Головная боль и беспокойство. Питолизант также потенциально может вызвать удлинение интервала QT, поэтому пациентам с сердечными заболеваниями рекомендуется соблюдать осторожность. Сохранение максимально низких доз может минимизировать риск побочных эффектов.[14]
Он выпускается под торговой маркой Wakix и считается орфанный препарат. Он был одобрен Европейской комиссией 31 марта 2016 года. Он доступен в таблетках по 4,5 и 18 мг.[15]
Структура деятельности Взаимосвязь
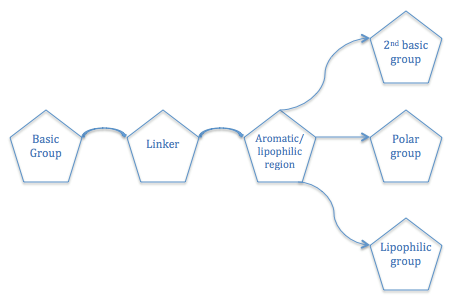
Общий структурный образец, необходимый для сродства антагониста к H3R был описан. An H3Антагонист R должен иметь базовый амин группа, которая связана с ароматный/липофильный область, которая связана либо с полярной группой, либо с другой основной группой, либо с липофильной областью.[7]
Клиническое значение
ЧАС3Антагонисты / обратные агонисты R демонстрируют возможный способ лечения заболеваний ЦНС, например болезни Альцгеймера (AD), синдром дефицита внимания и гиперактивности (СДВГ), шизофрения (SCH), боль и нарколепсия.[16]
Нарколепсия
Нарколепсия - это нарушение сна, которое характеризуется хронической сонливостью. Катаплексия, гипнагогические галлюцинации паралич сна также может присутствовать при нарколепсии.[17] ЧАС3Антагонизм R приводит к высвобождению гистамина в спинномозговая жидкость который способствует бодрствованию. Следовательно, H3Антагонисты R изучались в надежде на лечение нарколепсии. Питолизант одобрен для лечения нарколепсии.[7] и другие H3Антагонисты R проходят клинические испытания.[8]
Болезнь Альцгеймера (AD)
Болезнь Альцгеймера - прогрессирующая нейродегенеративный заболевание головного мозга. Гистамин играет хорошо задокументированную роль при БА, однако различные уровни гистамина в разных областях мозга затрудняют демонстрацию прямой связи между гистаминергической нейротрансмиссией и патологией БА.[16] В естественных условиях Исследования показали, что ряд антагонистов H3R облегчают обучение и память.[7] Блокирует тиоперамид H3R и вызывает увеличение нейронального высвобождения гистамина, который затем изменяет процессы познания через H1R и H2R и другие рецепторы (например, холинергические и ГАМК). Дегенерация гистаминергических нейронов при AD не коррелирует с H3R-выражения, поскольку большая часть H3R в головном мозге расположены в других местах глубоко в корковых и таламокортикальный нейроны среди прочего.[16]
Синдром дефицита внимания с гиперактивностью (СДВГ)
СДВГ - это расстройство нервной системы, которое наиболее выражено у детей. Современные фармакологические методы лечения состоят из стимуляторов. лекарства (например, метилфенидат), не стимулирующие препараты (например, атомоксетин) и α2 агонисты. Эти лекарства могут вызывать побочные эффекты, а некоторые из них могут вызвать зависимость. Поэтому желательна разработка альтернативных методов лечения. В естественных условиях исследования показывают потенциал использования H3Антагонисты R при СДВГ для улучшения внимания и когнитивной активности за счет увеличения высвобождения нейротрансмиттеров, таких как ацетилхолин и дофамин.[16]
Шизофрения
В шизофрения, дофаминергические путисреди других нейротрансмиттерных систем играют важную роль в развитии заболевания.[7][16] Современные методы лечения основаны на антипсихотических средствах первого и второго поколения. Эти препараты в основном являются антагонистами дофамина и могут вызывать множество нежелательных побочных эффектов. Гистаминергические нейроны, по-видимому, также играют роль в шизофрении, а H3 рецепторы совместно локализованы с рецепторами дофамина в ГАМКергический нейроны. ЧАС3 антагонисты рецепторов могут быть полезны при лечении негативных и когнитивных симптомов шизофрении, даже если они неэффективны при лечении ее позитивных симптомов. [7]
Рекомендации
- ^ Йонеяма Х., Симода А., Араки Л. и др. (Март 2008 г.). «Эффективные подходы к S-алкил-N-алкилизотиомочевинам: синтезы антагониста гистамина H3 клобенпропита и его аналогов». Журнал органической химии. 73 (6): 2096–104. Дои:10.1021 / jo702181x. PMID 18278935.
- ^ Fox GB, Esbenshade TA, Pan JB, Radek RJ, Krueger KM, Yao BB, Browman KE, Buckley MJ, Ballard ME, Komater VA, Miner H, Zhang M, Faghih R, Rueter LE, Bitner RS, Drescher KU, Wetter J , Марш К., Лемэр М., Порсольт Р.Д., Беннани Ю.Л., Салливан Дж. П., Коварт М.Д., Декер М.В., Хэнкок А.А. (апрель 2005 г.). «Фармакологические свойства ABT-239 [4- (2- {2 - [(2R) -2-метилпирролидинил] этил} бензофуран-5-ил) бензонитрил]: II. Нейрофизиологическая характеристика и широкая доклиническая эффективность в познании и шизофрении мощный и селективный гистамин H3 антагонист рецепторов ». Журнал фармакологии и экспериментальной терапии. 313 (1): 176–90. Дои:10.1124 / jpet.104.078402. ISSN 1521-0103. PMID 15608077.
- ^ Ligneau X, Lin J, Vanni-Mercier G, Jouvet M, Muir JL, Ganellin CR, Stark H, Elz S, Schunack W., Schwartz J (ноябрь 1998 г.). "Нейрохимические и поведенческие эффекты ципроксифана, мощного гистамина H3-рецепторный антагонист ". Журнал фармакологии и экспериментальной терапии. 287 (2): 658–66. PMID 9808693.
- ^ Эсбеншад Т.А., Фокс Г.Б., Крюгер К.М., Барановски Д.Л., Миллер Т.Р., Кан С.Х., Денни Л.И., Витте Д.Г., Яо ББ, Пан Дж.Б., Фагих Р., Беннани Ю.Л., Уильямс М., Хэнкок А.А. «Фармакологические и поведенческие свойства A-349821, селективного и сильного антагониста человеческого гистаминового рецептора H3». Биохимическая фармакология. 68 (5): 933–45. Дои:10.1016 / j.bcp.2004.05.048. PMID 15294456.
- ^ Ligneau X, Perrin D, Landais L, Camelin JC, Calmels TP, Berrebi-Bertrand I, Lecomte JM, Parmentier R, Anaclet C, Lin JS, Bertaina-Anglade V, la Rochelle CD, d'Aniello F, Rouleau A, Gbahou Ф, Аранг Дж. М., Ганеллин С. Р., Старк Х, Шунак В., Шварц Дж. К. (январь 2007 г.). «BF2.649 [1- {3- [3- (4-хлорфенил) пропокси] пропил} пиперидин, гидрохлорид], нонимидазоловый обратный агонист / антагонист гистаминового рецептора H3 человека: доклиническая фармакология». Журнал фармакологии и экспериментальной терапии. 320 (1): 365–75. Дои:10.1124 / jpet.106.111039. PMID 17005916.
- ^ а б c d Шварц, Жан-Шарль (2011-06-01). «Рецептор гистамина H3: от открытия до клинических испытаний питолизанта». Британский журнал фармакологии. 163 (4): 713–721. Дои:10.1111 / j.1476-5381.2011.01286.x. ISSN 1476-5381. ЧВК 3111674. PMID 21615387.
- ^ а б c d е ж грамм час я Садек, Бассем; Саад, Али; Садек, Адель; Джалал, Фахрейя; Старк, Хольгер (2016). «Рецептор гистамина H3 как потенциальная мишень для когнитивных симптомов при нервно-психических заболеваниях». Поведенческие исследования мозга. 312: 415–430. Дои:10.1016 / j.bbr.2016.06.051. PMID 27363923.
- ^ а б Берлин, Майкл; Бойс, Кристофер У .; де Лера Руис, Мануэль (13 января 2011 г.). «Рецептор гистамина H3 как цель открытия лекарств». Журнал медицинской химии. 54 (1): 26–53. Дои:10.1021 / jm100064d. ISSN 0022-2623. PMID 21062081.
- ^ а б Вайтманс, Майкел; Лерс, Роб; Эш, Иван де (2007-07-01). «Лиганды гистаминовых рецепторов H3 открывают широкие возможности для использования в различных терапевтических областях». Заключение эксперта по исследуемым препаратам. 16 (7): 967–985. Дои:10.1517/13543784.16.7.967. ISSN 1354-3784. PMID 17594183.
- ^ а б c d е Селанир, Сильвен; Вайтманс, Майкел; Талага, Патрис; Лерс, Роб; Эш, Иван Дж. П. де (2005). «Основной обзор: антагонисты гистаминовых рецепторов H3 обращаются в клинику». Открытие наркотиков сегодня. 10 (23–24): 1613–1627. Дои:10.1016 / с 1359-6446 (05) 03625-1. PMID 16376822.
- ^ а б c d Gemkow, Mark J .; Давенпорт, Адам Дж .; Харич, Силке; Ellenbroek, Bart A .; Цезура, Андреа; Халлетт, Дэвид (2009). «Рецептор гистамина H3 в качестве терапевтического лекарственного средства для лечения расстройств ЦНС». Открытие наркотиков сегодня. 14 (9–10): 509–515. Дои:10.1016 / j.drudis.2009.02.011. PMID 19429511.
- ^ Ледневки, Иштван; Tapolcsányi, Pál; Габор, Эстер; Элеш, Янош; Грейнер, Иштван; Шмидт, Ива; Немети, Жолт; Кедвес, Рита Соукупне; Балаж, Оттилия (2017). «Открытие новых антагонистов / обратных агонистов стероидных гистаминовых рецепторов H 3». Письма по биоорганической и медицинской химии. 27 (19): 4525–4530. Дои:10.1016 / j.bmcl.2017.08.060. PMID 28888822.
- ^ Masini, D .; Lopes-Aguiar, C .; Bonito-Oliva, A .; Papadia, D .; Andersson, R .; Fisahn, A .; Фисоне, Г. (2017-04-11). «Антагонист гистаминовых рецепторов Н3 тиоперамид восстанавливает циркадный ритм и функцию памяти при экспериментальном паркинсонизме». Трансляционная психиатрия. 7 (4): e1088. Дои:10.1038 / tp.2017.58. ЧВК 5416699. PMID 28398338.
- ^ а б Коллб-Селецка, Марта; Демолис, Пьер; Эммерих, Джозеф; Марки, Грег; Салмонсон, Томас; Хаас, Мануэль (2017). «Обзор питолизанта для лечения нарколепсии Европейским агентством по лекарственным средствам: краткое изложение научной оценки, проведенной Комитетом по лекарственным средствам для человека». Снотворное. 33: 125–129. Дои:10.1016 / j.sleep.2017.01.002. PMID 28449891.
- ^ «Европейское агентство по лекарствам - Найди лекарство - Вакикс». www.ema.europa.eu. Получено 2017-09-27.
- ^ а б c d е Вохора, Дивья; Бховмик, малайский (2012). «Антагонисты рецептора гистамина H3 / обратные агонисты на когнитивные и моторные процессы: актуальность для болезни Альцгеймера, СДВГ, шизофрении и злоупотребления наркотиками». Границы системной нейробиологии. 6: 72. Дои:10.3389 / fnsys.2012.00072. ISSN 1662-5137. ЧВК 3478588. PMID 23109919.
- ^ Скаммелл, Томас Э. (30 декабря 2015 г.). «Нарколепсия». Медицинский журнал Новой Англии. 373 (27): 2654–2662. Дои:10.1056 / nejmra1500587. PMID 26716917.