WikiDer > Кинетохора
А кинетохора (/kɪˈпɛтəkɔːr/, /-ˈпятəkɔːr/) представляет собой дискообразную белок структура, связанная с дублированием хроматиды в эукариотический ячейки, где волокна веретена прикрепить во время деление клеток тянуть сестринские хроматиды Кроме.[1] Кинетохора собирается на центромера и связывает хромосому с микротрубочка полимеры из митотическое веретено в течение митоз и мейоз. Его белки также помогают удерживать сестринские хроматиды вместе и играют роль в хромосома редактирование.[2] Подробная информация о конкретных регионах происхождения неизвестна.
Моноцентрический У организмов, включая позвоночных, грибы и большинство растений, есть одна центромерная область на каждой хромосоме, которая собирает одну локализованную кинетохору. Холоцентрические организмы, Такие как нематоды а некоторые растения собирают кинетохору по всей длине хромосомы.[3]
Кинетохоры запускают, контролируют и контролируют поразительные движения хромосом во время деления клеток. Во время митоза, который происходит после того, как хромосомы дублированный в S фазадве сестринские хроматиды удерживаются вместе центромерой. Каждая хроматида имеет свои собственные кинетохоры, которые обращены в противоположные стороны и прикрепляются к противоположным полюсам аппарата митотического веретена. После перехода от метафаза к анафазасестринские хроматиды отделяются друг от друга, и индивидуальные кинетохоры на каждой хроматиде управляют своим движением к полюсам веретена, которые будут определять две новые дочерние клетки. Следовательно, кинетохора важна для сегрегации хромосом, которая классически связана с митозом и мейозом.
Структура кинетохоры
Кинетохора содержит две области:
- внутренняя кинетохора, которая тесно связана с центромерой ДНК и собран в специальной форме хроматина, который сохраняется на протяжении всего клеточный цикл;
- внешняя кинетохора, которая взаимодействует с микротрубочки; внешняя кинетохора представляет собой очень динамичную структуру со многими идентичными компонентами, которые собираются и функционируют только во время деления клетки.
Даже самые простые кинетохоры состоят из более чем 19 различных белков. Многие из этих белков консервативны между видами эукариот, включая специализированные гистон Вариант H3 (называется CENP-A или CenH3), который помогает кинетохоре ассоциироваться с ДНК. Другие белки кинетохоры прикрепляют ее к микротрубочкам (MT) митотическое веретено. Это также моторные белки, включая оба динеин и кинезин, которые генерируют силы, перемещающие хромосомы во время митоза. Другие белки, такие как Mad2, контролировать прикрепление микротрубочек, а также натяжение между сестринскими кинетохорами и активировать КПП шпинделя чтобы остановить клеточный цикл, когда любой из них отсутствует.[4] Фактический набор генов, необходимых для функции кинетохор, варьируется от одного вида к другому.[5][6]
Функции кинетохор включают прикрепление хромосом к MT в веретене, проверку закрепления, активацию контрольной точки веретена и участие в генерации силы для продвижения движения хромосом во время деления клеток.[7] С другой стороны, микротрубочки представляют собой метастабильные полимеры, состоящие из α- и β-тубулин, чередование фаз роста и сжатия, явление, известное как динамическая нестабильность.[8] MT представляют собой высокодинамичные структуры, поведение которых интегрировано с функцией кинетохор для управления перемещением и сегрегацией хромосом. Также сообщалось, что организация кинетохор различается между митозом и мейозом, и целостность мейотической кинетохоры важна для специфических для мейоза событий, таких как спаривание гомологичных хромосом, моноориентация сестринских кинетохор, защита центромерного когезина и когезия и дупликация тела полюса веретена.[9][10]
В клетках животных
Кинетохора состоит из нескольких слоев, первоначально наблюдаемых с помощью обычных методов фиксации и окрашивания электронная микроскопия,[11][12] (рассмотрено К. Ридером в 1982 г.[13]) а в последнее время быстрым замораживанием и заменой.[14]

Самый глубокий слой в кинетохоре - это внутренняя пластина, который организован на структуре хроматина, содержащей нуклеосомы представляя специализированный гистон (назван CENP-A, который заменяет гистон H3 в этой области), вспомогательные белки и ДНК. Организация ДНК в центромера (спутниковая ДНК) является одним из наименее изученных аспектов кинетохор позвоночных. Внутренняя пластина выглядит как дискретная гетерохроматин домен во всем клеточный цикл.
Снаружи от внутренней пластины находится внешняя плита, который состоит в основном из белков. Эта структура собирается на поверхности хромосом только после ядерная оболочка ломается.[11] Наружная пластинка кинетохоров позвоночных содержит около 20 участков закрепления (+) концов МТ (названных kMT, после кинетохора МТ), тогда как внешняя пластина кинетохоры у дрожжей (Saccharomyces cerevisiae) содержит только один сайт привязки.
Самый удаленный домен в кинетохоре образует фиброзную корону, которую можно визуализировать с помощью обычных микроскопия, но только при отсутствии МП. Эта корона образована динамической сетью резидентных и временных белков, участвующих в КПП шпинделя, в закреплении микротрубочек и в регуляции поведения хромосом.
Во время митоза каждый сестринская хроматида образуя полную хромосому, имеет свою кинетохору. Отчетливые сестринские кинетохоры можно наблюдать сначала в конце Фаза G2 в культивируемых клетках млекопитающих.[15] Эти ранние кинетохоры обнаруживают зрелую ламинарную структуру до того, как ядерная оболочка разрушается.[16] Молекулярный путь сборки кинетохор у высших эукариоты был изучен с использованием нокауты генов у мышей и в культивируемых куриных клетках, а также с использованием РНК-интерференция (RNAi) в C. elegans, Дрозофила и человеческие клетки, но ни один простой линейный путь не может описать полученные данные.[нужна цитата]
Первый белок, который собирается на кинетохоре, - это CENP-A (Cse4 в Saccharomyces cerevisiae). Этот белок является специализированным изоформа из гистон H3.[17] CENP-A необходим для включения белков внутренней кинетохоры CENP-C, CENP-H и CENP-I / MIS6.[18][19][20][21][22] Отношение этих белков в CENP-A-зависимом пути полностью не определено. Например, для локализации CENP-C требуется CENP-H в куриных клетках, но он не зависит от CENP-I / MIS6 в клетках человека. В C. elegans и метазоа, включение многих белков во внешнюю кинетохору в конечном итоге зависит от CENP-A.
Белки кинетохор можно сгруппировать в соответствии с их концентрацией в кинетохорах во время митоза: некоторые белки остаются связанными на протяжении деления клетки, тогда как концентрация других изменяется. Более того, они могут рециклироваться в своем сайте связывания на кинетохорах либо медленно (они довольно стабильны), либо быстро (динамически).
- Белки, уровни которых остаются стабильными с профаза до поздней анафазы включают в себя составные компоненты внутренней пластины и стабильные компоненты внешнего кинетокора, такие как Ndc80 сложный,[23][24] Белки KNL / KBP (кинетохор-нуль/KNL-связывающий белок),[25] MIS белки[25] и CENP-F.[26][27] Вместе с конститутивными компонентами эти белки, по-видимому, организуют ядерное ядро внутренней и внешней структур кинетохоры.
- К динамическим компонентам, которые различаются по концентрации на кинетохорах во время митоза, относятся: молекулярные моторы CENP-E и динеин (а также их целевые компоненты ZW10 и ROD), а КПП шпинделя белки (такие как Безумный1, Mad2, BubR1 и Cdc20). Эти белки собираются на кинетохоре в высоких концентрациях в отсутствие микротрубочек; однако, чем больше количество MTs, прикрепленных к кинетохоре, тем ниже концентрации этих белков.[28] В метафазе уровни CENP-E, Bub3 и Bub1 снижаются примерно в три-четыре раза по сравнению со свободными кинетохорами, тогда как уровни динеина / динактина, Mad1, Mad2 и BubR1 снижаются более чем в 10-100 раз.[28][29][30][31]
- Принимая во внимание, что уровни белка контрольной точки веретена, присутствующие во внешней пластине, уменьшаются по мере того, как MTs закрепляются,[31] другие компоненты, такие как EB1, APC и белки в Ран путь (RanGap1 и RanBP2) ассоциируют с кинетохорами только тогда, когда MT закреплены.[32][33][34][35] Это может принадлежать механизму в кинетохоре, который распознает плюс-конец (+) микротрубочек, обеспечивая их правильное закрепление и регулируя их динамическое поведение, пока они остаются закрепленными.
В исследовании 2010 года использовался комплексный метод (названный «комбинаторная протеомика мультиклассификаторов» или MCCP) для анализа протеомный состав хромосом позвоночных, включая кинетохоры.[36] Хотя это исследование не включает биохимическое обогащение кинетохор, полученные данные включают все центромерные субкомплексы с пептиды из всех 125 известных центромерных белков. Согласно этому исследованию, до сих пор существует около сотни неизвестных кинетохорных белков, удваивающих известную структуру во время митоза, что подтверждает, что кинетохора является одной из самых сложных клеточных субструктур. Соответственно, всесторонний обзор литературы показал, что уже экспериментально показано, что по крайней мере 196 белков человека локализуются на кинетохорах.[37]
Функция
Количество микротрубочек, прикрепленных к одной кинетохоре, варьируется: в Saccharomyces cerevisiae только один MT связывает каждую кинетохору, тогда как у млекопитающих с каждой кинетохорой может быть связано 15–35 MT.[38] Однако не все МТ в веретене прикрепляются к одной кинетохоре. Есть MT, которые простираются от одного центросома к другому (и они отвечают за длину шпинделя), а некоторые более короткие вставляются между длинными MT. Профессор Б. Никлас (Университет Дьюка) показал, что если сломать прикрепление MT-кинетохоры с помощью лазерный луч, хроматиды больше не могут двигаться, что приводит к аномальному распределению хромосом.[39] Эти эксперименты также показали, что кинетохоры обладают полярностью и что прикрепление кинетохор к MTs, исходящим от одной или другой центросомы, будет зависеть от ее ориентации. Эта специфичность гарантирует, что только одна хроматида будет перемещаться с каждой стороны веретена, обеспечивая тем самым правильное распределение генетического материала. Таким образом, одна из основных функций кинетохор - это прикрепление MT к веретену, которое важно для правильного разделения сестринских хроматид. Если привязка неправильная, могут возникнуть ошибки, анеуплоидия, с катастрофическими последствиями для клетки. Чтобы этого не происходило, существуют механизмы обнаружения и исправления ошибок (например, КПП шпиндельной сборки), компоненты которого также находятся на кинетохорах. Движение одной хроматиды к центросоме в основном происходит за счет деполимеризации МТ в сайте связывания с кинетохорами. Эти движения требуют также создания силы, включая молекулярные моторы также расположены на кинетохорах.
Заякорение хромосом в МТ в митотическом веретене
Захват МТ
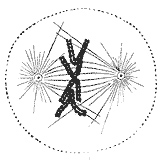
Во время фазы синтеза (S-фаза) в клеточный цикл, то центросома начинает дублировать. В самом начале митоза оба центриоли в каждой центросоме достигают своей максимальной длины, центросомы привлекают дополнительный материал и их способность к зарождению микротрубочки увеличивается. По мере развития митоза обе центросомы разделяются, чтобы установить митотическое веретено.[40] Таким образом, веретено в митотической клетке имеет два полюса, исходящие из микротрубочек. Микротрубочки - это длинные белковые филаменты с асимметричными крайними точками, «минус» (-) конец, относительно стабильный рядом с центросомой, и «плюс» (+) конец, выдерживающие чередующиеся фазы роста-сокращения, исследующие центр клетки. Во время этого процесса поиска микротрубочка может встретить и захватить хромосому через кинетохору.[41][42] Микротрубочки, которые находят и прикрепляют кинетохоры, стабилизируются, тогда как оставшиеся свободными микротрубочки быстро деполимеризуются.[43] Поскольку хромосомы имеют две кинетохоры, связанные спина к спине (по одной на каждой сестринской хроматиде), когда одна из них присоединяется к микротрубочкам, генерируемым одним из клеточных полюсов, кинетохора на сестринской хроматиде оказывается экспонированной для противоположного полюса; по этой причине в большинстве случаев вторая кинетохора прикрепляется к микротрубочкам, исходящим из противоположного полюса,[44] таким образом, что хромосомы теперь двунаправленный, одна фундаментальная конфигурация (также называемая амфителический), чтобы обеспечить правильное разделение обеих хроматид при делении клетки.[45][46]
Когда только одна микротрубочка прикреплена к одной кинетохоре, она начинает быстрое движение связанной хромосомы к полюсу, генерирующему эту микротрубочку. Это движение, вероятно, опосредовано двигательной активностью по направлению к «минусу» (-) моторный белок цитоплазматический динеин,[47][48] который очень сконцентрирован в кинетохорах, не связанных с MT.[49] Движение к полюсу замедляется по мере того, как кинетохоры приобретают kMTs (MT, закрепленные на кинетохорах), и движение становится направленным изменениями длины kMTs. Динеин высвобождается из кинетохоров по мере того, как они приобретают kMT.[28] а в культивируемых клетках млекопитающих он необходим для КПП шпинделя инактивация, но не для конгрессии хромосом на экваторе веретена, приобретения kMTs или анафаза А во время сегрегации хромосом.[50] В высших растениях или дрожжах нет никаких признаков динеина, но есть другие кинезины в сторону (-) конца может компенсировать недостаток динеина.

Другой моторный белок, участвующий в начальном захвате MT, - это CENP-E; это высокая молекулярная масса кинезин связаны с фиброзной короной на кинетохорах млекопитающих от прометафазы до анафазы.[51] В клетках с низким уровнем CENP-E хромосомы испытывают недостаток в этом протеине на своих кинетохорах, которые довольно часто не обладают способностью к конгрессу на метафазной пластинке. В этом случае некоторые хромосомы могут оставаться хронически моноориентированными (привязанными только к одному полюсу), хотя большинство хромосом могут правильно собираться в метафазной пластинке.[52]
Широко признано, что волокно kMTs (пучок микротрубочек, связанных с кинетохорой) возникает в результате захвата МТ, полимеризованных на центросомы и полюса веретена в культивируемых клетках млекопитающих.[41] Однако МТ, непосредственно полимеризованные на кинетохорах, также могут вносить значительный вклад.[53] Способ, которым центромерная область или кинетохора инициирует образование kMT, и частота, с которой это происходит, является важным вопросом,[согласно кому?] потому что этот механизм может вносить вклад не только в начальное образование kMTs, но также и в способ, которым кинетохоры корректируют дефектное закрепление MTs и регулируют движение вдоль kMTs.
Роль комплекса Ndc80
МТ, связанные с кинетохорами, обладают особыми характеристиками: по сравнению со свободными МТ, кМТ намного более устойчивы к деполимеризации, вызванной холодом, высоким гидростатическим давлениям или воздействию кальция.[54] Более того, kMT рециклируются намного медленнее, чем астральные MT и веретенные MT со свободными (+) концами, и если kMT высвобождаются из кинетохор с помощью лазерного луча, они быстро деполимеризуются.[39]
Когда стало ясно, что ни динеин, ни CENP-E не важны для образования kMTs, другие молекулы должны нести ответственность за стабилизацию kMTs. Пионерская генетическая работа на дрожжах показала важность комплекса Ndc80 в закреплении kMTs.[23][55][56][57] В Saccharomyces cerevisiae, комплекс Ndc80 состоит из четырех компонентов: Ndc80p, Nuf2p, Spc24p и Spc25p. Мутанты, лишенные какого-либо из компонентов этого комплекса, демонстрируют потерю связи кинетохора-микротрубочка, хотя структура кинетохоры не потеряна полностью.[23][55] Однако мутанты, у которых структура кинетохор утрачена (например, мутанты Ndc10 у дрожжей[58]) недостаточны как в связи с микротрубочками, так и в способности активировать КПП шпинделявозможно потому, что кинетохоры работают как платформа, на которой собираются компоненты ответа.
Комплекс Ndc80 является высококонсервативным и был идентифицирован в С. Помбе, C. elegans, Ксенопус, курица и люди.[23][24][55][59][60][61][62] Исследования Hec1 (высоко экспрессируется в раковых клетках 1), человеческого гомолога Ndc80p, показывают, что он важен для правильной конгрессии хромосом и митотической прогрессии, и что он взаимодействует с компонентами когезин и конденсин комплексы.[63]
В различных лабораториях показано, что комплекс Ndc80 необходим для стабилизации заякоривания кинетохора-микротрубочка, необходимого для поддержания центромерного натяжения, участвующего в установлении правильной хромосомной конгрессии в высоких эукариоты.[24][60][61][62] Клетки с нарушенной функцией Ndc80 (при использовании РНКи, нокаут гена, или же антитело микроинъекции) имеют аномально длинные веретена, отсутствие напряжения между сестринскими кинетохорами, хромосомы, неспособные собираться в метафазной пластинке, и несколько или любые связанные с ними kMT.
Существует множество убедительных подтверждений способности комплекса Ndc80 напрямую связываться с микротрубочками и формировать консервативный компонент ядра интерфейса кинетохора-микротрубочка.[64] Однако формирование устойчивых взаимодействий кинетохора-микротрубочка может также потребовать функции дополнительных белков. В дрожжах для этого соединения необходимо наличие комплекса Dam1-DASH-DDD. Некоторые члены этого комплекса связываются непосредственно с MT, тогда как некоторые другие связываются с комплексом Ndc80.[56][57][65] Это означает, что комплекс Dam1-DASH-DDD может быть важным адаптером между кинетохорами и микротрубочками. Однако у животных аналогичный комплекс не обнаружен, и этот вопрос остается в стадии интенсивных исследований.
Проверка фиксации кинетохора – МТ
В течение S-фаза, клетка дублирует всю генетическую информацию, хранящуюся в хромосомах, в процессе, называемом Репликация ДНК. В конце этого процесса каждый хромосома включает двух сестер хроматиды, которые представляют собой две полные и идентичные молекулы ДНК. Обе хроматиды остаются связанными когезин комплексы до анафазы, когда происходит сегрегация хромосом. Если хромосомная сегрегация происходит правильно, каждая дочерняя клетка получает полный набор хроматид, и для этого каждая сестринская хроматида должна закрепиться (через соответствующую кинетохору) с MT, генерируемыми на противоположных полюсах митотического веретена. Эта конфигурация называется амфителический или же двунаправленный.
Однако в процессе привязки также могут появиться некоторые неправильные конфигурации:[66]

- монотелический: только одна из хроматид прикреплена к MT, вторая кинетохора не прикреплена; в этой ситуации нет центромерного напряжения, и КПП шпинделя активируется, задерживая вход в анафазу и давая ячейке время исправить ошибку. Если это не исправить, незакрепленная хроматида может случайным образом закончиться любой из двух дочерних клеток, генерируя анеуплоидия: одна дочерняя клетка будет иметь избыток хромосом, а другая не будет иметь некоторых хромосом.
- синтетический: обе хроматиды прикреплены к МТ, исходящим из одного и того же полюса; эта ситуация также не создает центраерного напряжения, и контрольная точка шпинделя будет активирована. Если его не исправить, обе хроматиды закончатся одной дочерней клеткой, что приведет к анеуплоидии.
- меротелический: по крайней мере, одна хроматида прикреплена одновременно к МТ, исходящим от обоих полюсов. В этой ситуации возникает центромерное натяжение, и по этой причине контрольная точка шпинделя не активируется. Если это не исправить, хроматида, связанная с обоими полюсами, останется в анафазе как отстающая хромосома и, наконец, будет разбита на два фрагмента, распределенных между дочерними клетками, порождая анеуплоидию.
И монотелическая, и синтелическая конфигурации не способны генерировать центромерное натяжение и обнаруживаются контрольной точкой шпинделя. Напротив, меротельная конфигурация не определяется этим механизмом управления. Однако большинство этих ошибок обнаруживаются и исправляются до того, как клетка входит в анафазу.[66] Ключевым фактором в исправлении этих ошибок якорения является хромосомный пассажирский комплекс, который включает киназа белок Aurora B, его мишень и активирующая субъединица INCENP и две другие субъединицы, Survivin и Borealin / Dasra B (обзор Adams и соавторов в 2001 г.[67]). Клетки, в которых функция этого комплекса была отменена доминирующий отрицательный мутанты РНКи, антитело микроинъекция или использование селективных препаратов накапливают ошибки в закреплении хромосом. Многие исследования показали, что Aurora B необходима для дестабилизации неправильного закрепления кинетохора-MT, способствуя образованию амфителических связей. Гомолог Aurora B у дрожжей (Ipl1p) фосфорилирует некоторые кинетохорные белки, такие как конститутивный белок Ndc10p и члены комплексов Ndc80 и Dam1-DASH-DDD.[68] Фосфорилирование компонентов комплекса Ndc80 вызывает дестабилизацию закрепления kMTs. Было высказано предположение, что локализация Aurora B важна для его функции: поскольку она расположена во внутренней области кинетохоры (в центромерном гетерохроматине), когда возникает напряжение центромеры, сестринские кинетохоры разделяются, и Aurora B не может достичь своих субстратов. так что kMTs стабилизированы. Аврора B часто сверхэкспрессируется при нескольких типах рака, и в настоящее время она является мишенью для разработки противоопухолевых препаратов.[69]
Активация контрольной точки шпинделя
Контрольная точка шпинделя, или SAC (для КПП шпиндельной сборки), также известный как митотическая контрольная точка, это клеточный механизм, отвечающий за обнаружение:
- правильная сборка митотического веретена;
- биполярное прикрепление всех хромосом к митотическому веретену;
- конгресс всех хромосом на метафазной пластинке.
Когда только одна хромосома (по какой-либо причине) остается отстающей во время конгресса, механизм контрольной точки веретена вызывает задержку в прогрессировании клеточного цикла: клетка останавливается, давая время механизмам восстановления для решения обнаруженной проблемы. Через некоторое время, если проблема не будет решена, ячейка будет нацелена на апоптоз (запрограммированная гибель клеток), механизм безопасности, позволяющий избежать образования анеуплоидия, ситуация, которая обычно имеет драматические последствия для организма.
В то время как структурные центромерные белки (такие как CENP-B), остаются стабильно локализованными на протяжении митоза (в том числе во время телофаза) компоненты checkpoint веретена собираются на кинетохоре в высоких концентрациях в отсутствие микротрубочек, и их концентрации уменьшаются по мере увеличения числа микротрубочек, прикрепленных к кинетохоре.[28]
В метафазе CENP-E, Bub3 и Bub1 уровни снижаются в 3-4 раза по сравнению с уровнями на несвязанных кинетохорах, тогда как уровни динеин / динактин, Mad1, Mad2 и BubR1 уменьшение> 10-100 раз.[28][29][30][31] Таким образом, в метафазе, когда все хромосомы выровнены на метафазной пластинке, все белки контрольной точки высвобождаются из кинетохоры. Исчезновение белков контрольной точки из кинетохор указывает на момент, когда хромосома достигла метафазной пластинки и находится под биполярным напряжением. В этот момент белки контрольной точки, которые связываются и ингибируют Cdc20 (Mad1-Mad2 и BubR1), высвобождают Cdc20, который связывает и активирует APC / CCdc20, и этот комплекс запускает разделение сестринских хроматид и, следовательно, вступление в анафазу.
Несколько исследований показывают, что комплекс Ndc80 участвует в регуляции стабильной ассоциации Mad1-Mad2 и динеина с кинетохорами.[24][61][62] Тем не менее, белки, ассоциированные с кинетохорами, CENP-A, CENP-C, CENP-E, CENP-H и BubR1 не зависят от Ndc80 / Hec1. Длительный арест прометафазы, наблюдаемый в клетках с низкими уровнями Ndc80 / Hec1, зависит от Mad2, хотя эти клетки показывают низкие уровни Mad1, Mad2 и динеина на кинетохорах (<10-15% по отношению к неприсоединенным кинетохорам). Однако, если уровни как Ndc80 / Hec1, так и Nuf2 уменьшаются, Mad1 и Mad2 полностью исчезают из кинетохор и контрольная точка веретена инактивируется.[70]
Шугошин (Sgo1, MEI-S332 в Drosophila melanogaster[71]) являются центромерными белками, которые необходимы для поддержания когезин связаны с центромерами до анафазы. Гомолог человека, hsSgo1, связывается с центромерами во время профазы и исчезает, когда начинается анафаза.[72] Когда уровень Шугошина снижается на РНКи в HeLa В клетках когезин не может оставаться на центромерах во время митоза, и, следовательно, сестринские хроматиды разделяются синхронно до того, как инициируется анафаза, что вызывает длительную остановку митоза.
С другой стороны, Дассо и его сотрудники обнаружили, что белки, участвующие в Выполнить цикл можно обнаружить на кинетохорах во время митоза: RanGAP1 (белок, активирующий ГТФазу, который стимулирует превращение Ran-GTP в Ran-GDP) и связывающий белок Ran, называемый RanBP2 / Nup358.[73] Во время интерфазы эти белки располагаются в ядерные поры и участвуют в нуклео-цитоплазматическом транспорте. Локализация этих белков в кинетохорах, по-видимому, является функционально значимой, потому что некоторые методы лечения, которые увеличивают уровни Ran-GTP, ингибируют высвобождение кинетохорами Bub1, Bub3, Mad2 и CENP-E.[74]
Orc2 (белок, относящийся к комплекс распознавания происхождения -ORC- причастен к Репликация ДНК инициация во время S фаза) также локализуется на кинетохорах во время митоза в клетках человека;[75] в соответствии с этой локализацией, некоторые исследования показывают, что Orc2 в дрожжах участвует в слипании сестринских хроматид, и когда он удаляется из клетки, КПП шпинделя следует активация.[76] Некоторые другие компоненты ORC (например, orc5 в С. Помбе) также участвуют в сплоченности.[77] Однако белки ORC, по-видимому, участвуют в молекулярном пути, который дополняет когезин путь, и это в основном неизвестно.
Генерация силы для движения хромосом
Большинство перемещений хромосом по отношению к полюсам веретена связано с удлинением и укорочением kMTs. Один из самых интересных[согласно кому?] Особенностью кинетохор является их способность изменять состояние связанных с ними kMT (около 20) от состояния деполимеризации на их (+) конце до состояния полимеризации. Это позволяет кинетохорам из клеток в прометафазе проявлять «направленную нестабильность»,[78] переходя между устойчивыми фазами движения к полюсу (к полюсу) или перевернутый (антиполярный), которые связаны с чередованием состояний деполимеризации и полимеризации kMTs соответственно. Эта би-стабильность кинетохор, по-видимому, является частью механизма выравнивания хромосом на экваторе веретена без потери механической связи между кинетохорами и полюсами веретена. Считается, что би-стабильность кинетохора основана на динамической нестабильности kMTs (+) конца и частично контролируется натяжением, присутствующим в кинетохоре. В культивируемых клетках млекопитающих низкое напряжение на кинетохорах способствует изменению в сторону деполимеризации kMTs, а высокое напряжение способствует изменению в направлении полимеризации kMTs.[79][80]
Белки кинетохор и белки, связывающиеся с концом MT (+) (вместе называемые + TIP), регулируют движение кинетохор посредством регуляции динамики конца kMT (+).[81] Однако интерфейс кинетохора-микротрубочка очень динамичен, и некоторые из этих белков, по-видимому, являются добросовестный компоненты обеих конструкций. Две группы белков кажутся особенно важными: кинезины которые действуют как деполимеразы, такие как кинезины KinI; и белки, связанные с MT (+) концами, + TIP, способствующие полимеризации, возможно, противодействующие эффекту деполимеразы.[82]
- Кинезины KinI названы «I», потому что они представляют внутренний моторный домен, который использует АТФ для ускорения деполимеризации полимера тубулина, микротрубочек. У позвоночных наиболее важным кинезином KinI, контролирующим динамику сборки (+) концов, является MCAK.[83] Однако похоже, что есть и другие кинезины.
- Есть две группы + TIP с кинетохорными функциями.
- Первый включает белок аденоматозный полипоз кишечной палочки (APC) и связанный с ним белок EB1, которым необходимы МТ для локализации на кинетохорах. Оба белка необходимы для правильного разделения хромосом.[84] EB1 связывается только с MT в состоянии полимеризации, предполагая, что он способствует стабилизации kMT во время этой фазы.
- Вторая группа + TIP включает белки, которые могут локализоваться на кинетохорах даже в отсутствие MT. В эту группу входят два широко изученных белка: CLIP-170 и связанные с ними белки CLASPs (CLIP-ассоциированные белки). Роль CLIP-170 в кинетохорах неизвестна, но экспрессия доминантно-негативного мутанта вызывает задержку прометафазы,[85] предполагая, что он играет активную роль в выравнивании хромосом. Белки CLASPs необходимы для выравнивания хромосом и поддержания биполярного веретена в Дрозофила, люди и дрожжи.[86][87]
Рекомендации
- ^ Сантагида, Стефано; Мусаккио, Андреа (2 сентября 2009 г.). «Жизнь и чудеса кинетохор». Журнал EMBO. 28 (17): 2511–2531. Дои:10.1038 / emboj.2009.173. ISSN 1460-2075. ЧВК 2722247. PMID 19629042.
- ^ Брукер, Роберт Дж. (2016). Концепции генетики. Нью-Йорк: Образование Макгроу Хилл.
- ^ Albertson, D.G .; Томсон, Дж. (1993), "Сегрегация голоцентрических хромосом в мейозе у нематод, Caenorhabditis elegans", Хромосомные исследования, 1 (1): 15–26, Дои:10.1007 / BF00710603, PMID 8143084
- ^ Питер Де Вульф, Уильям С. Эрншоу, Кинетохора: от молекулярных открытий до терапии рака
- ^ ван Хофф, Джолиен Дже Тромер, Элко ван Вейк, Лени М. Снель, Беренд Копс, Герт Джейпл (сентябрь 2017 г.). Эволюционная динамика кинетохорной сети у эукариот, выявленная сравнительной геномикой. Издательская группа "Природа". OCLC 1130165006.CS1 maint: несколько имен: список авторов (связь)
- ^ Виджай, Нагарджун (29 сентября 2020 г.). «Утрата генов внутренних кинетохор связана с переходом к нетрадиционной точечной центромере у почкующихся дрожжей». PeerJ. 8: e10085. Дои:10.7717 / peerj.10085. ISSN 2167-8359.
- ^ а б Maiato, H .; Deluca, J .; Лосось, E.D .; Эрншоу, W.C. (2004), "Динамический интерфейс кинетохора-микротрубочка", Журнал клеточной науки, 117 (22): 5461–5477, Дои:10.1242 / jcs.01536, PMID 15509863
- ^ Mitchison, T .; Киршнер, М. (1984), «Динамическая нестабильность роста микротрубочек» (PDF), Природа, 312 (5991): 237–242, Дои:10.1038 / 312237a0, PMID 6504138, заархивировано из оригинал (PDF) на 2010-06-22, получено 2010-08-23
- ^ Mehta, G.D .; Agarwal, M .; Гош, С.К. (2014), «Функциональная характеристика белка кинетохор, Ctf19 в мейозе I: следствие дифференциального воздействия Ctf19 на сборку митотических и мейотических кинетохор в Saccharomyces cerevisiae», Молекулярная микробиология, 91 (6): 1179–1199, Дои:10.1111 / мм. 12527, PMID 24446862
- ^ Агарвал, Минакши; Мехта, Гунджан; Гош, Сантану К. (01.03.2015). «Роль подкомплексов Ctf3 и COMA в мейозе: значение в поддержании Cse4 на центромере и числовых полюсах веретена». Biochimica et Biophysica Acta (BBA) - Исследование молекулярных клеток. 1853 (3): 671–684. Дои:10.1016 / j.bbamcr.2014.12.032. ISSN 0167-4889. PMID 25562757.
- ^ а б Brinkley, B.R .; Стабблфилд, Э. (1966), "Тонкая структура кинетохоры клетки млекопитающих in vitro", Хромосома, 19 (1): 28–43, Дои:10.1007 / BF00332792, PMID 5912064
- ^ Йокелайнен, П. (1967), «Ультраструктура и пространственная организация метафазной кинетохоры в митотических клетках крысы», J Ultrastruct Res, 19 (1): 19–44, Дои:10.1016 / S0022-5320 (67) 80058-3, PMID 5339062
- ^ Ридер, К. (1982), «Формирование, структура и состав кинетохор и кинетохорных волокон млекопитающих», Инт Рев Цитол, Международный обзор цитологии, 79: 1–58, Дои:10.1016 / S0074-7696 (08) 61672-1, ISBN 978-0-12-364479-4, PMID 6185450
- ^ McEwen, B.F .; Hsieh, C.E .; Mattheyses, A.L .; Ридер, К. (1998), «Новый взгляд на структуру кинетохор в соматических клетках позвоночных с использованием замораживания под высоким давлением и замещения замораживания», Хромосома, 107 (6): 366–375, Дои:10.1007 / s004120050320, ЧВК 2905855, PMID 9914368
- ^ Brenner, S .; Pepper, D .; Berns, M.W .; Tan, E .; Бринкли, Б. (1981), "Структура кинетохор, дупликация и распределение в клетках млекопитающих: анализ человеческими аутоантителами от пациентов со склеродермией", Журнал клеточной биологии, 91 (1): 95–102, Дои:10.1083 / jcb.91.1.95, ЧВК 2111947, PMID 7298727
- ^ Pluta, A.F .; MacKay, A.M .; Ainsztein, A.M .; Goldberg, I.G .; Эрншоу, W.C. (1995), "Центромера: центр хромосомной активности", Наука, 270 (5242): 1591–4, Дои:10.1126 / science.270.5242.1591, PMID 7502067
- ^ Палмер, Д.К .; О'Дей, К .; Trong, H.L .; Charbonneau, H .; Марголис, Р.Л. (1991), «Очистка центромер-специфического белка CENP-A и демонстрация того, что это отличительный гистон», Труды Национальной академии наук, 88 (9): 3734–3738, Дои:10.1073 / pnas.88.9.3734, ЧВК 51527, PMID 2023923
- ^ Howman, E.V .; Fowler, K.J .; Ньюсон, А.Дж .; Redward, S .; MacDonald, A.C .; Калицис, П .; Чу, К.Х.А. (2000), «Раннее нарушение организации центромерного хроматина у мышей с нулевым центромерным белком A (Cenpa)», Труды Национальной академии наук, 97 (3): 1148–1153, Дои:10.1073 / pnas.97.3.1148, ЧВК 15551, PMID 10655499
- ^ Oegema, K .; Desai, A .; Рыбина, С .; Киркхэм, М .; Хайман, А.А. (2001), "Функциональный анализ сборки кинетохор у Caenorhabditis elegans", Журнал клеточной биологии, 153 (6): 1209–1226, Дои:10.1083 / jcb.153.6.1209, ЧВК 2192036, PMID 11402065
- ^ Van Hooser, A.A .; Успенский, И.И .; Gregson, H.C .; Starr, D.A .; Йен, Т.Дж .; Goldberg, M.L .; Yokomori, K .; Эрншоу, W.C .; Салливан, К.Ф. (2001), "Спецификация кинетохорообразующего хроматина с помощью гистона H3 варианта CENP-A", Журнал клеточной науки, 114 (19): 3529–3542, PMID 11682612
- ^ Fukagawa, T .; Mikami, Y .; Nishihashi, A .; Regnier, V .; Haraguchi, T .; Hiraoka, Y .; Sugata, N .; Тодокоро, К .; Brown, W. (2001), «CENP-H, составляющий компонент центромеры, необходим для нацеливания на центромеры CENP-C в клетках позвоночных», Журнал EMBO, 20 (16): 4603–4617, Дои:10.1093 / emboj / 20.16.4603, ЧВК 125570, PMID 11500386
- ^ Goshima, G .; Киёмицу, Т .; Йода, К .; Янагида М. (2003), «Человеческий центрерный белок хроматина hMis12, необходимый для равной сегрегации, не зависит от пути загрузки CENP-A», Журнал клеточной биологии, 160 (1): 25–39, Дои:10.1083 / jcb.200210005, ЧВК 2172742, PMID 12515822
- ^ а б c d Wigge, Philip A .; Килмартин, Джон В. (2001), "Комплекс Ndc80p из Saccharomyces cerevisiae содержит консервативные компоненты центромеры и выполняет функцию сегрегации хромосом", Журнал клеточной биологии, 152 (2): 349–360, Дои:10.1083 / jcb.152.2.349, ЧВК 2199619, PMID 11266451
- ^ а б c d Deluca, J.G .; Moree, B .; Hickey, J.M .; Kilmartin, J.V .; Лосось, E.D. (2002): «Ингибирование hNuf2 блокирует стабильное прикрепление кинетохор к микротрубочкам и вызывает гибель митотических клеток в клетках HeLa», Журнал клеточной биологии, 159 (4): 549–555, Дои:10.1083 / jcb.200208159, ЧВК 2173110, PMID 12438418
- ^ а б Cheeseman, I.M .; Niessen, S .; Андерсон, С .; Hyndman, F .; Yates, J.R .; Oegema, K .; Desai, A. (2004), «Консервативная белковая сеть контролирует сборку внешней кинетохоры и ее способность выдерживать напряжение», Гены и развитие, 18 (18): 2255–2268, Дои:10.1101 / gad.1234104, ЧВК 517519, PMID 15371340
- ^ Rattner, J.B .; Rao, A .; Fritzler, M.J .; Валенсия, D.W .; Йен, Т. (1993), «CENP-F представляет собой кинетохорный белок Ca 400 кДа, локализация которого зависит от клеточного цикла», Цитоскелет клеточного мотиля, 26 (3): 214–26, Дои:10.1002 / см. 970260305, PMID 7904902
- ^ Liao, H .; Winkfein, RJ; Мак, G; Раттнер, JB; Йен, Т.Дж. (1995), «CENP-F представляет собой белок ядерного матрикса, который собирается на кинетохорах в конце G2 и быстро разрушается после митоза», Журнал клеточной биологии, 130 (3): 507–518, Дои:10.1083 / jcb.130.3.507, ЧВК 2120529, PMID 7542657
- ^ а б c d е Хоффман, ДБ; Hoffman, D.B .; Pearson, C.G .; Йен, Т.Дж .; Howell, B.J .; Лосось, E.D. (2001), «Зависимые от микротрубочек изменения в сборке моторных белков микротрубочек и белков контрольных точек митотического веретена на кинетохорах PtK1», Молекулярная биология клетки, 12 (7): 1995–2009, Дои:10.1091 / mbc.12.7.1995, ЧВК 55648, PMID 11451998
- ^ а б Кинг, С. (2000), "Динеиновый двигатель микротрубочек", Biochimica et Biophysica Acta (BBA) - Исследование молекулярных клеток, 1496 (1): 60–75, Дои:10.1016 / S0167-4889 (00) 00009-4, PMID 10722877
- ^ а б Howell, B.J .; Moree, B .; Фаррар, E.M .; Стюарт, S .; Fang, G .; Лосось, E.D. (2004), "Динамика белка контрольной точки веретена на кинетохорах в живых клетках", Текущая биология, 14 (11): 953–964, Дои:10.1016 / j.cub.2004.05.053, PMID 15182668
- ^ а б c Shah, J.V .; Botvinick, E .; Бондай, З .; Фурнари, Ф .; Berns, M .; Кливленд, Д.В. (2004), «Динамика влияния белков центромер и кинетохор на сигнализацию контрольных точек и молчание» (PDF), Текущая биология, 14 (11): 942–952, Дои:10.1016 / j.cub.2004.05.046, PMID 15182667
- ^ Tirnauer, Jennifer S .; Canman, Julie C .; Лосось, E.D .; Митчисон, Тимоти Дж. (2002), "EB1 нацелена на кинетохоры с прикрепленными, полимеризуемыми микротрубочками", Молекулярная биология клетки, 13 (12): 4308–4316, Дои:10.1091 / mbc.E02-04-0236, ЧВК 138635, PMID 12475954
- ^ Каплан, К.Б .; Burds, A.A .; Сведлоу, J.R .; Бекир, С.С .; Sorger, P.K .; Нэтке, И. (2001), «Роль белка Adenomatous Polyposis Coli в хромосомной сегрегации», Природа клеточной биологии, 3 (4): 429–432, Дои:10.1038/35070123, PMID 11283619
- ^ Joseph, J .; Лю, S.T .; Jablonski, S.A .; Йен, Т.Дж .; Дассо, М. (2004), «Комплекс RanGAP1-RanBP2 необходим для взаимодействий микротрубочек и кинетохор in vivo», Текущая биология, 14 (7): 611–617, Дои:10.1016 / j.cub.2004.03.031, PMID 15062103
- ^ Салина, Давиде; Энарсон, Пол; Rattner, J.B .; Берк, Брайан (2003), «Nup358 объединяет разрушение ядерной оболочки со сборкой кинетохор», Журнал клеточной биологии, 162 (6): 991–1002, Дои:10.1083 / jcb.200304080, ЧВК 2172838, PMID 12963708
- ^ Ohta S, Bukowski-Wills JC, Sanchez-Pulido L, Alves Fde L, Wood L, Chen ZA, Platani M, Fischer L, Hudson DF, Ponting CP, Fukagawa T, Earnshaw WC, Rappsilber J (сентябрь 2010 г.), "The Белковый состав митотических хромосом, определенный с использованием мультиклассификатора комбинаторной протеомики », Клетка, 142 (5): 810–21, Дои:10.1016 / j.cell.2010.07.047, ЧВК 2982257, PMID 20813266
- ^ Типтон А.Р., Ван К., Оладимеджи П., Суфи С., Гу Зи, Лю С.Т. (2012), «Идентификация новых регуляторов митоза посредством интеллектуального анализа данных с использованием белков центромер / кинетохор человека в качестве групповых запросов», BMC Cell Biol, 13: 15, Дои:10.1186/1471-2121-13-15, ЧВК 3419070, PMID 22712476
- ^ McEwen, B.F .; Heagle, A.B .; Cassels, G.O .; Buttle, K.F .; Ридер, К. (1997), «Созревание кинетохорных волокон в клетках PtK1 и его значение для механизмов хромосомной конрессии и начала анафазы», Журнал клеточной биологии, 137 (7): 1567–1580, Дои:10.1083 / jcb.137.7.1567, ЧВК 2137823, PMID 9199171
- ^ а б Nicklas, R.B .; Кубай, Д.Ф. (1985), «Микротрубочки, движение хромосом и переориентация после отделения хромосом от веретена путем микроманипуляции», Хромосома, 92 (4): 313–324, Дои:10.1007 / BF00329815, PMID 4042772
- ^ Мэр, Т .; Meraldi, P .; Stierhof, Y.D .; Nigg, E.A .; Фрай, А. (1999), «Протеинкиназы, контролирующие цикл центросом», Письма FEBS, 452 (1–2): 92–95, Дои:10.1016 / S0014-5793 (99) 00534-7, PMID 10376685
- ^ а б Киршнер, М .; Митчисон, Т. (1986), "Помимо самосборки: от микротрубочек к морфогенезу", Клетка, 45 (3): 329–342, Дои:10.1016/0092-8674(86)90318-1, PMID 3516413
- ^ Holy, T. E .; Лейблер, С. (1994), "Динамическая нестабильность микротрубочек как эффективный способ поиска в космосе", Труды Национальной академии наук Соединенных Штатов Америки, 91 (12): 5682–5685, Дои:10.1073 / пнас.91.12.5682, ЧВК 44060, PMID 8202548
- ^ Hayden, J.H .; Баузер, СС; Rieder, CL (1990), "Кинетохоры захватывают астральные микротрубочки во время прикрепления хромосом к митотическому веретену: прямая визуализация в живых клетках легких тритона", Журнал клеточной биологии, 111 (3): 1039–1045, Дои:10.1083 / jcb.111.3.1039, ЧВК 2116290, PMID 2391359
- ^ Никлас, Р. Б. (1997), "Как клетки получают правильные хромосомы", Наука, 275 (5300): 632–7, Дои:10.1126 / science.275.5300.632, PMID 9005842
- ^ Loncarek, J .; Кисурина-евгеньева, О .; Виноградова, Т .; Hergert, P .; La Terra, S .; Капур, Т.М .; Ходжаков, А. (2007), «Геометрия центромеры, необходимая для безошибочного митоза, контролируется силами веретена», Природа, 450 (7170): 745–9, Дои:10.1038 / природа06344, ЧВК 2586812, PMID 18046416
- ^ Dewar, H .; Tanaka, K .; Nasmyth, K .; Танака, Т.У. (2004), «Напряжение между двумя кинетохорами достаточно для их би-ориентации на митотическом веретене», Природа, 428 (6978): 93–7, Дои:10.1038 / природа02328, PMID 14961024
- ^ Echeverri, C.J .; Paschal, B.M .; Vaughan, K.T .; Валле, Р. Б. (1996), «Молекулярная характеристика 50-кД субъединицы динактина показывает функцию комплекса в выравнивании хромосом и организации веретена во время митоза», Журнал клеточной биологии, 132 (4): 617–633, Дои:10.1083 / jcb.132.4.617, ЧВК 2199864, PMID 8647893
- ^ Шарп, Д.Дж .; Rogers, G.C .; Scholey, J.M. (2000), «Цитоплазматический динеин необходим для движения хромосом по направлению к полюсу во время митоза у эмбрионов дрозофилы», Природа клеточной биологии, 2 (12): 922–930, Дои:10.1038/35046574, PMID 11146657
- ^ Бэнкс, J.D .; Хилд, Р. (2001), "Движение хромосом: выход динеина на кинетохоре", Текущая биология, 11 (4): 128–131, Дои:10.1016 / S0960-9822 (01) 00059-8, PMID 11250166
- ^ Howell, B.J .; McEwen, B.F .; Canman, J.C .; Hoffman, D.B .; Фаррар, E.M .; Rieder, C.L .; Лосось, E.D. (2001), «Цитоплазматический динеин / динактин управляет транспортом белка кинетохор к полюсам веретена и играет роль в инактивации контрольных точек митотического веретена», Журнал клеточной биологии, 155 (7): 1159–1172, Дои:10.1083 / jcb.200105093, ЧВК 2199338, PMID 11756470
- ^ Cooke, CA; Schaar, B .; Йен, Т.Дж .; Эрншоу, W.C. (1997), "L-локализация CENP-E в фиброзной короне и внешней пластинке кинетохор млекопитающих от прометафазы через анафазу", Хромосома, 106 (7): 446–455, Дои:10.1007 / s004120050266, PMID 9391217
- ^ Weaver, Beth A.A .; Бондай, Захид К .; Putkey, Frances R .; Kops, Geert J.P.L .; Шелк, Ален Д .; Кливленд, Дон В. (2003), «Связанный с центромерой белок-E необходим для митотической контрольной точки млекопитающих, чтобы предотвратить анеуплоидию из-за потери одной хромосомы», Журнал клеточной биологии, 162 (4): 551–563, Дои:10.1083 / jcb.200303167, ЧВК 2173788, PMID 12925705
- ^ а б Maiato, H .; Rieder, C.L .; Ходжаков, А. (2004), "Кинетохорное образование кинетохорных волокон способствует сборке веретена во время митоза животных", Журнал клеточной биологии, 167 (5): 831–840, Дои:10.1083 / jcb.200407090, ЧВК 2172442, PMID 15569709
- ^ Митчисон, Т.Дж. (1988), "Динамика микротрубочек и функция кинетохор при митозе", Ежегодный обзор клеточной биологии, 4 (1): 527–545, Дои:10.1146 / annurev.cb.04.110188.002523, PMID 3058165
- ^ а б c Он, X .; Rines, D.R .; Espelin, C.W .; Соргер, П. (2001), «Молекулярный анализ прикрепления кинетохор к микротрубочкам у почкующихся дрожжей», Клетка, 106 (2): 195–206, Дои:10.1016 / S0092-8674 (01) 00438-X, PMID 11511347
- ^ а б Вестерманн, Стефан; Cheeseman, Iain M .; Андерсон, Скотт; Йейтс, Джон Р .; I. I. I., DG; Друбин, Дэвид Г .; Барнс, Джорджана (2003), «Архитектура кинетохоры почкующихся дрожжей обнаруживает консервативное молекулярное ядро», Журнал клеточной биологии, 163 (2): 215–22, Дои:10.1083 / jcb.200305100, ЧВК 2173538, PMID 14581449
- ^ а б De Wulf, P .; McAinsh, A.D .; Соргер, П.К. (2003), «Иерархическая сборка кинетохор почкующихся дрожжей из множества субкомплексов», Гены и развитие, 17 (23): 2902–2921, Дои:10.1101 / gad.1144403, ЧВК 289150, PMID 14633972
- ^ Goh, P.Y .; Килмартин, Дж. В. (1993), "NDC10: ген, участвующий в сегрегации хромосом у Saccharomyces cerevisiae", Журнал клеточной биологии, 121 (3): 503–12, Дои:10.1083 / jcb.121.3.503, ЧВК 2119568, PMID 8486732
- ^ Nabetani, A .; Koujin, T .; Цуцуми, C .; Haraguchi, T .; Hiraoka, Y. (2001), «Консервативный белок Nuf2 участвует в соединении центромеры с веретеном во время сегрегации хромосомы: связь между функцией кинетохор и контрольной точкой веретена», Хромосома, 110 (5): 322–334, Дои:10.1007 / s004120100153, PMID 11685532
- ^ а б Хау, Мэри; McDonald, Kent L .; Альбертсон, Донна Дж .; Мейер, Барбара Дж. (2001), «Him-10 необходим для структуры и функции кинетохор на голоцентрических хромосомах Caenorhabditis elegans», Журнал клеточной биологии, 153 (6): 1227–1238, Дои:10.1083 / jcb.153.6.1227, ЧВК 2192032, PMID 11402066
- ^ а б c Мартин-Илуэсма, Сильвия; Stucke, Volker M .; Нигг, Эрих А. (2002), "Роль Hec1 в передаче сигналов контрольной точки веретена и рекрутировании кинетохор Mad1 / Mad2", Наука, 297 (5590): 2267–2270, Дои:10.1126 / science.1075596, PMID 12351790
- ^ а б c McCleland, M.L .; Gardner, R.D .; Kallio, M.J .; Daum, J.R .; Горбский, Г.Дж .; Берк, Д.Дж .; Стукенберг, П. (2003), «Высококонсервативный комплекс Ndc80 необходим для сборки кинетохор, хромосомной конгресса и активности контрольных точек веретена», Гены и развитие, 17 (1): 101–114, Дои:10.1101 / gad.1040903, ЧВК 195965, PMID 12514103
- ^ Zheng, L .; Chen, Y .; Ли, W.H. (1999), "Hec1p, эволюционно законсервированный белок со спиральной спиралью, модулирующий сегрегацию хромосом посредством взаимодействия с белками SMC", Молекулярная и клеточная биология, 19 (8): 5417–5428, Дои:10.1128 / mcb.19.8.5417, ЧВК 84384, PMID 10409732
- ^ Вэй, Ронни Р .; Аль-бассам, Джавдат; Харрисон, Стивен С. (2007), «Комплекс Ndc80 / HEC1 является точкой контакта для прикрепления кинетохора и микротрубочек», Структурная и молекулярная биология природы, 14 (1): 54–59, Дои:10.1038 / nsmb1186, PMID 17195848
- ^ Courtwright, A.M .; Он, X. (2002), "Dam1 - правильный фосфорегулятор биориентации кинетохор", Клетка развития, 3 (5): 610–611, Дои:10.1016 / S1534-5807 (02) 00332-5, PMID 12431367
- ^ а б Cimini, D .; Moree, B .; Canman, J.C .; Лосось, E.D. (2003), «Ориентация меротелических кинетохор часто происходит во время ранних митозов в тканевых клетках млекопитающих, и исправление ошибок достигается двумя разными механизмами», Журнал клеточной науки, 116 (20): 4213–4225, Дои:10.1242 / jcs.00716, PMID 12953065
- ^ Adams, R.R .; Кармена, М .; Эрншоу, W.C. (2001), "Хромосомные пассажиры и (полярное сияние) азбука митоза", Тенденции в клеточной биологии, 11 (2): 49–54, Дои:10.1016 / S0962-8924 (00) 01880-8, PMID 11166196
- ^ Cheeseman, I.M .; Андерсон, С .; Jwa, M .; Green, E.M .; Kang, J .; Yates, J.R .; Chan, C.S.M .; Друбин, Д.Г .; Барнс, Г. (2002), "Фосфорегуляция прикрепления кинетохор к микротрубочкам с помощью киназы Aurora Ipl1p", Клетка, 111 (2): 163–172, Дои:10.1016 / S0092-8674 (02) 00973-X, PMID 12408861
- ^ Гаучи, Оливер; Хайуэй, Джим; Мак, Филип С .; Purnell, Phillip R .; Lara, Primo N .; Jr,.; Гандара, Дэвид Р. (2008), «Киназы полярного сияния как мишени противораковых лекарств», Клинические исследования рака, 14 (6): 1639–48, Дои:10.1158 / 1078-0432.CCR-07-2179, PMID 18347165CS1 maint: числовые имена: список авторов (связь)
- ^ Meraldi, P .; Дравиам, В.; Соргер, П.К. (2004), «Время и контрольные точки в регуляции митотической прогрессии», Клетка развития, 7 (1): 45–60, Дои:10.1016 / j.devcel.2004.06.006, PMID 15239953
- ^ Tang, T.T.L .; Bickel, S.E .; Янг, L.M .; Орр-Уивер, Т. (1998), "Поддержание сцепления сестринских хроматид в центромере белком MEI-S332 Drosophila", Гены и развитие, 12 (24): 3843–3856, Дои:10.1101 / gad.12.24.3843, ЧВК 317262, PMID 9869638
- ^ McGuinness, B.E .; Hirota, T .; Кудо, Н.Р .; Peters, J.M .; Нэсмит, К. (2005), «Шугошин предотвращает диссоциацию когезина от центромер во время митоза в клетках позвоночных», ПЛОС Биол, 3 (3): e86, Дои:10.1371 / journal.pbio.0030086, ЧВК 1054882, PMID 15737064
- ^ Джозеф, Иомон; Тан, Шых-Хан; Карпова, Татьяна С .; МакНелли, Джеймс Дж .; Дассо, Мэри (2002), «SUMO-1 нацеливает RanGAP1 на кинетохоры и митотические веретена», Журнал клеточной биологии, 156 (4): 595–602, Дои:10.1083 / jcb.200110109, ЧВК 2174074, PMID 11854305
- ^ Арнаутов, А .; Дассо, М. (2003), "Ran GTPase регулирует функцию кинетохор", Клетка развития, 5 (1): 99–111, Дои:10.1016 / S1534-5807 (03) 00194-1, PMID 12852855
- ^ Prasanth, S.G .; Prasanth, K.V .; Siddiqui, K .; Spector, D.L .; Стиллман, Б. (2004), «Человек Orc2 локализуется в центросомах, центромерах и гетерохроматине во время наследования хромосом», Журнал EMBO, 23 (13): 2651–2663, Дои:10.1038 / sj.emboj.7600255, ЧВК 449767, PMID 15215892
- ^ Shimada, K .; Гассер, С. (2007), "Функции комплекса распознавания происхождения в сплочении сестрин-хроматид у Saccharomyces cerevisiae", Клетка, 128 (1): 85–99, Дои:10.1016 / j.cell.2006.11.045, PMID 17218257
- ^ Като, Н; Matsunaga, F; Миядзаки, S; Инь, L; D'urso, G; Танака, К; Мураками, Y (2008), «Schizosaccharomyces pombe Orc5 играет множество ролей в поддержании стабильности генома на протяжении всего клеточного цикла», Клеточный цикл, 7 (8): 1085–96, Дои:10.4161 / cc.7.8.5710, PMID 18414064
- ^ Skibbens, R.V .; Скин, В.П .; Лосось, E.D. (1993), «Направленная нестабильность подвижности кинетохор во время хромосомной конгрессии и сегрегации в митотических клетках легких тритона: двухтактный механизм», Журнал клеточной биологии, 122 (4): 859–875, Дои:10.1083 / jcb.122.4.859, ЧВК 2119582, PMID 8349735
- ^ Rieder, C.L .; Лосось, E.D. (1994), «Подвижные кинетохоры и полярные силы выброса определяют положение хромосом на митотическом веретене позвоночных», Журнал клеточной биологии, 124 (3): 223–33, Дои:10.1083 / jcb.124.3.223, ЧВК 2119939, PMID 8294508
- ^ Skibbens, RV; Rieder, CL; Salmon, ED (1995), «Подвижность кинетохор после разделения сестринских центромер с помощью лазерной микрохирургии: доказательства того, что направленная нестабильность и положение кинетохор регулируется натяжением», Журнал клеточной науки, 108 (7): 2537–48, PMID 7593295
- ^ Askham, J.M .; Vaughan, K. T .; Goodson, H.V .; Моррисон, Э. Э. (2002), "Доказательства того, что взаимодействие между EB1 и p150Glued необходимо для образования и поддержания радиального массива микротрубочек, закрепленных на центросоме", Молекулярная биология клетки, 13 (10): 3627–3645, Дои:10.1091 / mbc.E02-01-0061, ЧВК 129971, PMID 12388762
- ^ Schuyler, S.C .; Пеллман, Д. (2001), «Микротрубочки», отслеживающие плюс-конец, «Конец - это только начало», Клетка, 105 (4): 421–424, Дои:10.1016 / S0092-8674 (01) 00364-6, PMID 11371339
- ^ Howard, J .; Хайман, А.А. (2003), «Динамика и механика плюс-конца микротрубочки: цитоскелет», Природа, 422 (6933): 753–758, Дои:10.1038 / природа01600, PMID 12700769
- ^ Green, R.A .; Wollman, R .; Каплан, К.Б. (2005), «APC и EB1 действуют вместе при митозе, чтобы регулировать динамику веретена и выравнивание хромосом», Молекулярная биология клетки, 16 (10): 4609–4622, Дои:10.1091 / mbc.E05-03-0259, ЧВК 1237068, PMID 16030254
- ^ Dujardin, D .; Wacker, U.I .; Моро, А .; Schroer, T.A .; Rickard, J.E .; Де Мей, J.R. (1998), "Доказательства роли CLIP-170 в установлении метафазного хромосомного выравнивания", Журнал клеточной биологии, 141 (4): 849–862, Дои:10.1083 / jcb.141.4.849, ЧВК 2132766, PMID 9585405
- ^ Maiato, H .; Ходжаков, А .; Ридер, К. (2004), «CLASP дрозофилы необходим для включения субъединиц микротрубочек в потоки кинетохорных волокон», Природа клеточной биологии, 7 (1): 42–47, Дои:10.1038 / ncb1207, ЧВК 2596653, PMID 15592460
- ^ Maiato, H .; Fairley, E.A.L .; Rieder, C.L .; Сведлоу, J.R .; Sunkel, C.E .; Эрншоу, W.C. (2003), «Человеческий CLASP1 представляет собой компонент внешней кинетохоры, который регулирует динамику микротрубочек веретена», Клетка, 113 (7): 891–904, Дои:10.1016 / S0092-8674 (03) 00465-3, HDL:10216/53832, PMID 12837247