WikiDer > MG132
Эта статья включает в себя список общих использованная литература, но он остается в основном непроверенным, потому что ему не хватает соответствующих встроенные цитаты. (Ноябрь 2015) (Узнайте, как и когда удалить этот шаблон сообщения) |
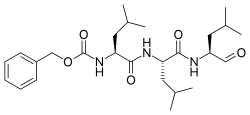 | |
| Имена | |
|---|---|
| Название ИЮПАК Бензил N-[(2S) -4-метил-1 - [[(2S) -4-метил-1 - [[(2S) -4-метил-1-оксопентан-2-ил] амино] -1-оксопентан-2-ил] амино] -1-оксопентан-2-ил] карбамат | |
| Другие имена N-Бензилоксикарбонил-L-лейцил-L-лейцил-L-лейцинал Z-Leu-Leu-Leu-al | |
| Идентификаторы | |
3D модель (JSmol) | |
| ChemSpider | |
PubChem CID | |
| UNII | |
| |
| |
| Свойства | |
| C26ЧАС41N3О5 | |
| Молярная масса | 475.630 г · моль−1 |
| Внешность | Белое твердое вещество |
| Растворимость | 100 мМ дюйм EtOH и ДМСО |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
MG132 является мощным, обратимым и проницаемым для клеток ингибитор протеасомы [1] (Kя = 4 нМ). Он принадлежит к классу синтетических пептидных альдегидов.[2][3] Это снижает деградацию убиквитин-конъюгированные белки в клетках млекопитающих и проницаемые штаммы дрожжей посредством комплекса 26S, не влияя на его АТФаза или изопептидаза деятельность. MG132 активирует c-Jun N-терминальная киназа (JNK1), который инициирует апоптоз. MG132 также подавляет NF-κB активация с IC50 3 мкМ и предотвращает β-секретаза расщепление.
Молекулярный механизм
Есть несколько ингибиторов, которые могут легко проникать в клетку и селективно ингибировать путь деградации. Это включает пептидные альдегиды, например Cbz-лей-лей-лейцинал (MG132), Cbz-лей-лей-норвалинал (MG115) и ацетил-лей-лей-норлейцинал (ALLN).[1] Это аналоги субстратов и сильнодействующие ингибиторы переходного состояния из химотрпсин как деятельность протеасома машины.[4][5] Известно также, что пептидные альдегиды ингибируют некоторые лизосомный цистеиновые протеазы и Calpains следовательно, MG132 не может быть исключительным ингибитором протеасомного пути.[4]
использованная литература
- ^ а б Ли, До Хи; Гольдберг, Альфред Л. (октябрь 1998 г.). «Ингибиторы протеасом: новые ценные инструменты для клеточных биологов». Тенденции в клеточной биологии. 8 (10): 397–403. Дои:10.1016 / S0962-8924 (98) 01346-4. PMID 9789328.
- ^ Ито А., Такахаши Р., Муира С., Баба И. (1975). «Синтетическое исследование пептидных альдегидов». Химико-фармацевтический бюллетень. 12 (23): 3106–3113. Дои:10.1248 / cpb.23.3106.
- ^ Хаяси М., Сайто И., Кавасима С. (31 января 1992 г.). «Активация кальпаина необходима для слияния мембран эритроцитов в присутствии экзогенного Ca2 +». Biochem Biophys Res Commun. 182 (2): 939–946. Дои:10.1016 / 0006-291x (92) 91822-8. PMID 1734892.
- ^ а б Rock, Kenneth L .; Грамм, Колетт; Ротштейн, Лиза; Кларк, Карен; Штейн, Росс; Дик, Лоуренс; Хван, Даниэль; Гольдберг, Альфред Л. (сентябрь 1994 г.). «Ингибиторы протеасомы блокируют деградацию большинства клеточных белков и образование пептидов, представленных на молекулах MHC класса I». Ячейка. 78 (5): 761–771. Дои:10.1016 / s0092-8674 (94) 90462-6. ISSN 0092-8674. PMID 8087844. S2CID 22262916.
- ^ Ли, До Хи; Гольдберг, Альфред Л. (1 ноября 1996 г.). «Селективные ингибиторы протеасомозависимого и вакуолярного путей деградации белка у Saccharomyces cerevisiae». Журнал биологической химии. 271 (44): 27280–27284. Дои:10.1074 / jbc.271.44.27280. ISSN 0021-9258. PMID 8910302. S2CID 40396862.