WikiDer > Мигаластат
 | |
| Клинические данные | |
|---|---|
| Произношение | миль GAL в стат |
| Торговые наименования | Галафолд |
| Другие имена | DDIG, AT1001, 1-дезоксигалактоноджиримицин |
| AHFS/Drugs.com | Монография |
| Данные лицензии | |
| Беременность категория |
|
| Маршруты администрация | Устно (капсулы) |
| Код УВД | |
| Легальное положение | |
| Легальное положение | |
| Фармакокинетический данные | |
| Биодоступность | 75% |
| Связывание с белками | Никто |
| Метаболиты | О-глюкурониды (<15%) |
| Устранение период полураспада | 3–5 часов (разовая доза) |
| Экскреция | Моча (77%), кал (20%) |
| Идентификаторы | |
| |
| Количество CAS |
|
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| ЧЭМБЛ | |
| Химические и физические данные | |
| Формула | C6ЧАС13NО4 |
| Молярная масса | 163.173 г · моль−1 |
| 3D модель (JSmol) | |
| |
| |
Мигаластат, продается под торговой маркой Галафолд, это лекарство для лечения Болезнь Фабри, редкое генетическое заболевание. Он был разработан Amicus Therapeutics. Соединенные штаты Управление по контролю за продуктами и лекарствами (FDA) предоставило это орфанный препарат статус в 2004 году,[1] и Европейская комиссия последовала в 2006 году.[2] Европейское агентство по лекарственным средствам Комитет по лекарственным средствам для человека (CHMP) в мае 2016 года предоставила лекарству разрешение на продажу под названием Galafold.[3][4][5]
Соединенные штаты. Управление по контролю за продуктами и лекарствами (FDA) считает, что это первое в своем классе лекарство.[6]
Медицинское использование
Мигаластат используется для длительного лечения болезни Фабри у взрослых и подростков в возрасте 16 лет и старше с поддающейся мутацией фермента. альфа-галактозидаза А (α-GalA). «Поддающаяся» мутация - это та, которая приводит к неправильная укладка фермента, но в противном случае существенно не ухудшит его функцию.[4]
На основании in vitro Test Amicus Therapeutics опубликовала список из 269 поддающихся и почти 600 не поддающихся изменению мутаций. Приблизительно от 35 до 50% людей с Фабри подвержены изменению мутации.[4]
Побочные эффекты
Наиболее частый побочный эффект у клинические испытания была головная боль (примерно у 10% людей). Менее распространенные побочные эффекты (от 1 до 10% людей) включали неспецифические симптомы, такие как головокружение, усталость, и тошнота, но и депрессия. Возможные редкие побочные эффекты не могли быть оценены из-за небольшого количества субъектов в клинических испытаниях, в которых оценивались побочные эффекты.[4]
Взаимодействия
В сочетании с внутривенный агалсидаза альфа или бета, которые рекомбинантный версии фермента α-GalA, мигаластат увеличивает концентрацию функционального α-GalA в тканях по сравнению с агалсидазой, вводимой отдельно. Это ожидаемый и желаемый эффект.[требуется медицинская цитата]
Мигаластат не ингибирует и не индуцирует цитохром P450 ферменты печени или белки-переносчики и поэтому ожидается, что он имеет низкий потенциал взаимодействия с другими лекарствами.[4]
Фармакология
Механизм действия
Болезнь Фабри - это генетическое расстройство вызванные различными мутациями фермента α-GalA, который отвечает за расщепление сфинголипид глоботриаозилцерамид (Gb3), среди прочего гликолипиды и гликопротеины. Некоторые из этих мутаций приводят к неправильной укладке α-GalA, что впоследствии не позволяет контролировать качество белка в эндоплазматический ретикулум и разлагается. Отсутствие функциональной α-GalA приводит к накоплению Gb3 в кровеносных сосудах и других тканях с широким спектром симптомов, включая проблемы с почками, сердцем и кожей.[7]
Мигаластат является сильнодействующим, доступным перорально ингибитор α-GalA (IC50: 4 мкМ).[7] Связываясь с дефектной α-GalA, он сдвигает поведение сворачивания в сторону правильной конформации, что приводит к появлению функционального фермента при условии, что мутация поддается изменению.[4] Молекулы с таким механизмом называются фармакологические шапероны.[7]
Когда фермент достигает места назначения, лизосома, мигаластат диссоциирует из-за низкого pH и относительное содержание Gb3 и других субстраты, оставляя α-GalA свободным выполнять свою функцию. В зависимости от мутации ЕС50 составляет от 0,8 мкМ до более 1 мМ в клеточных моделях.[8]
Фермент альфа-галактозидаза А (α-GalA)
Глоботриаозилцерамид (Gb3), а субстрат α-GalA, имеет концевой D-галактоза структурно похож на мигаластат.[9]
Фармакокинетика
Мигаластат практически полностью всасывается из кишечника; прием препарата вместе с пищей снижает его абсорбцию примерно на 40%. Всего биодоступность составляет около 75% при приеме без еды. Вещество не связывается с кровью белки плазмы.[4]
Лишь небольшая часть дозы мигаластата метаболизируется, в основном до трех дегидрированный О-глюкурониды (4% от дозы) и ряд неуточненных метаболитов (10%). Препарат выводится в основном с мочой (77%) и в меньшей степени с фекалиями (20%). Практически все метаболиты выводятся с мочой. Период полувыведения составляет от трех до пяти часов после однократного приема.[4]
Химия

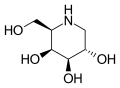
Мигаластат используется в виде гидрохлорид, который представляет собой белое кристаллическое твердое вещество, растворимое в воде.[10]:11 В молекуле четыре асимметричный углерод атомы с тем же стереохимия как сахар D-галактоза, но отсутствует первый гидроксил группа. Он имеет атом азота в кольце вместо кислорода, что делает его иминосахар.[11]
Структура формально происходит от ноджиримицин.
История
Мигаластат был выделен как ферментация продукт бактерии Streptomyces lydicus (напряжение PA-5726) в 1988 году и назвал 1-дезоксигалактоноджиримицин.[11][12] В 2004 году FDA США присвоило ему статус орфанного препарата для лечения болезни Фабри.[1] и в 2006 году Европейский CHMP поступил так же.[13]Спонсорство препарата передавалось несколько раз в течение следующих лет: от Amicus Therapeutics к Shire Pharmaceuticals в 2008 году, вернувшись к Amicus в 2010 году, чтобы Glaxo в 2011 году и снова в Amicus в 2014 году.[14]
В период с 2009 по 2015 гг. Были проведены два клинических испытания фазы III с участием около 110 субъектов, одно двойной слепой сравнивая препарат с плацебои одно сравнение его с рекомбинантным α-GalA без ослепления. Мигаластат стабилизировал сердце и функция почек за 30-месячный период этих испытаний.[4]
В сентябре 2015 года Amicus объявил, что представит применение нового препарата (NDA) для ускоренное утверждение мигаластата в FDA до конца 2015 г.[15] CHMP рекомендовал одобрение в апреле 2016 года, но FDA отклонило заявку в ноябре из-за недостаточности данных в ноябре 2016 года.[16] Препарат был одобрен в Европейском Союзе в мае 2016 года.[3] Германия была первой страной, где был запущен мигаластат.[3] После Скотт Готтлиб стал комиссаром FDA в 2017 году, генеральный директор Amicus начал лоббировать его напрямую, чтобы FDA приняло NDA, а в феврале 2018 года FDA приняло его и пообещало ответ к августу 2018 года.[17]
Смотрите также
- Миглустат, препарат для лечения болезни Гоше, с аналогичной структурой
- 1-дезоксиноджиримицин, стереоизомер мигаластата
использованная литература
- ^ а б «Обозначения и одобрения орфанных лекарственных средств Мигаластат». НАС. Управление по контролю за продуктами и лекарствами (FDA). Получено 16 сентября 2020.
- ^ "EU / 3/06/368". Европейское агентство по лекарствам (EMA). Получено 16 сентября 2020.
- ^ а б c «Amicus Therapeutics объявляет об одобрении Европейской комиссией применения галафольда (мигаластата) для лечения пациентов с болезнью Фабри в Европейском союзе». GlobeNewswire. 31 мая 2016.
- ^ а б c d е ж г час я «Краткое описание характеристик продукта Galafold» (PDF). Европейское агентство по лекарствам. Июнь 2016 г.
- ^ «Галафолд EPAR». Европейское агентство по лекарствам (EMA). Получено 16 сентября 2020.
- ^ Разрешения на новую лекарственную терапию 2018 г. (PDF). НАС. Управление по контролю за продуктами и лекарствами (FDA) (Отчет). Январь 2019. Получено 16 сентября 2020.
- ^ а б c Санчес-Фернандес Е.М., Гарсиа Фернандес Дж.М., Меллет CO (апрель 2016 г.). «Фармакологические шапероны на основе гликомиметиков при лизосомных нарушениях накопления: уроки Гоше, GM1-ганглиозидоз и болезни Фабри» (PDF). Химические коммуникации. 52 (32): 5497–515. Дои:10.1039 / C6CC01564F. PMID 27043200.
- ^ Бенджамин Э. Р., Фланаган Дж. Дж., Шиллинг А., Чанг Х. Х., Агарвал Л., Кац Е. и др. (Июнь 2009 г.). «Фармакологический шаперон 1-дезоксигалактоноджиримицин увеличивает уровни альфа-галактозидазы А в клеточных линиях пациентов Фабри». Журнал наследственных метаболических заболеваний. 32 (3): 424–40. Дои:10.1007 / s10545-009-1077-0. PMID 19387866. S2CID 12629461.
- ^ Warnock DG, Bichet D.G., Holida M, Goker-Alpan O, Nicholls K, Thomas M и др. (2015). «Пероральный Мигаластат HCl приводит к большему системному воздействию и повышению тканевых уровней активной α-галактозидазы А у пациентов Фабри при одновременном применении с инфузированной агалсидазой». PLOS ONE. 10 (8): e0134341. Bibcode:2015PLoSO..1034341W. Дои:10.1371 / journal.pone.0134341. ЧВК 4529213. PMID 26252393.
- ^ «Отчет об оценке EMA / 272226/2016» (PDF). EMA. 1 апреля 2016 г.
- ^ а б Асано, Н. (2007). «Встречающиеся в природе иминосахары и родственные алкалоиды: структура, активность и применение». В Compain, P; Мартин, штат Орегон (ред.). Иминосахары: от синтеза до терапевтического применения. Wiley and Sons. п. 17. ISBN 978-0-470-03391-3.
- ^ Мияке Й, Эбата М (1988). «Структуры ингибитора β-галактозидазы, Галактостатина и его производных». Agric Biol Chem. 52: 661–666. Дои:10.1271 / bbb1961.52.661.
- ^ «Галафольд». Европейское агентство по лекарствам. 1 апреля 2016 г.
- ^ «Публичное изложение мнения о признании сиротами». Европейское агентство по лекарственным средствам. 29 апреля 2014 г.
- ^ «Amicus Therapeutics планирует представить NDA на Мигаластат при болезни Фабри после положительной встречи с FDA перед NDA». Drugs.com. 15 сентября 2015.
- ^ Адамс Б. (29 ноября 2016 г.). «FDA отвергает быстрое рассмотрение препарата Amicus Fabry, новых данных не ожидается до 2019 года». FierceBiotech.
- ^ Кэрролл Дж. (12 февраля 2018 г.). «После отказа FDA теперь расстилает короткую красную ковровую дорожку для мигаластата Амикуса». Конечные точки.
внешние ссылки
- «Мигаластат». Портал информации о наркотиках. Национальная медицинская библиотека США.