WikiDer > N-бромсукцинимид - Википедия
| Имена | |||
|---|---|---|---|
| Название ИЮПАК 1-бром-2,5-пирролидиндион | |||
| Другие имена N-бромосукцинимид; NBS | |||
| Идентификаторы | |||
3D модель (JSmol) | |||
| 113916 | |||
| ЧЭБИ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.004.435 | ||
| Номер ЕС |
| ||
| 26634 | |||
PubChem CID | |||
| UNII | |||
| |||
| |||
| Характеристики | |||
| C4ЧАС4BrNО2 | |||
| Молярная масса | 177.985 г · моль−1 | ||
| Внешность | Белое твердое вещество | ||
| Плотность | 2,098 г / см3 (твердый) | ||
| Температура плавления | От 175 до 178 ° C (от 347 до 352 ° F, от 448 до 451 K) | ||
| Точка кипения | 339 ° С (642 ° F, 612 К) | ||
| 14,7 г / л (25 ° С) | |||
| Растворимость в ККл4 | Нерастворим (25 ° C) | ||
| Опасности | |||
| Главный опасности | Раздражающий | ||
| Паспорт безопасности | [1] | ||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
N-Бромсукцинимид или же NBS это химический реагент используется в радикальное замещение, электрофильная добавка, и электрофильное замещение реакции в органическая химия. NBS может быть удобным источником Br•, то бром радикальный.
Подготовка
NBS имеется в продаже. Его также можно синтезировать в лаборатории. Для этого едкий натр и бром добавляют к раствору ледяной воды сукцинимид. Продукт NBS осаждает и могут быть собраны фильтрацией.[1]
Нефть NBS дает лучшую доходность в Реакция Воля-Циглера. В других случаях нечистый NBS (слегка желтого цвета) может дать ненадежные результаты. Его можно очистить перекристаллизацией из воды 90–95 ° C (10 г NBS на 100 мл воды).[2]
Реакции
Дополнение к алкенам
NBS будет реагировать с алкенами 1 в водных растворителях, чтобы дать бромгидрины 2. Предпочтительными условиями являются порционное добавление NBS к раствору алкена в 50% водном растворе. ДМСО, DME, THF, или же терт-бутанол при 0 ° C.[3] Формирование ион бромония и немедленная атака водой дает сильную Марковникова сложение и анти стереохимическая селективность.[4]
Побочные реакции включают образование α-бромкетонов и дибромосоединений. Их можно свести к минимуму, используя только что перекристаллизованный NBS.
С добавлением нуклеофилы, вместо водымогут быть синтезированы различные бифункциональные алканы.[5]
Аллильное и бензильное бромирование
Стандартные условия для использования NBS в аллильных и / или бензильных бромирование включает кипячение раствора NBS в безводный CCl4 с радикальным инициатором - обычно азобисизобутиронитрилом (AIBN) или же перекись бензоила, облучение или и то, и другое для воздействия радикальный инициация.[6][7] Аллильные и бензильные промежуточные радикалы, образующиеся во время этой реакции, более стабильны, чем другие углеродные радикалы, и основными продуктами являются аллильные и бензильные бромиды. Это также называется Реакция Воля – Циглера.[8][9]
В четыреххлористый углерод необходимо поддерживать безводным на протяжении всей реакции, так как присутствие воды может вероятно гидролизовать желаемый продукт.[10] Карбонат бария часто добавляют для поддержания безводных и бескислотных условий.
В указанной выше реакции, хотя возможна смесь изомерных аллильных бромидных продуктов, создается только одна смесь из-за большей стабильности радикала в 4-м положении по сравнению с метилцентрированным радикалом.
Бромирование карбонильных производных
NBS может α-бромировать карбонильные производные либо радикальным путем (как указано выше), либо посредством кислотного катализа. Например, гексаноилхлорид 1 может быть бромирован в альфа-положении NBS с использованием кислотного катализа.[11]
Реакция енолирует, енольные эфиры, или же енол ацетаты с NBS является предпочтительным методом α-бромирования, так как он дает высокий выход с небольшим количеством побочных продуктов.[12][13]
Бромирование ароматических производных
Электронно-богатый ароматный соединения, такие как фенолы, анилины, и различные ароматические гетероциклы,[14] можно бромировать с помощью NBS.[15][16] С помощью DMF как растворитель дает высокий уровень пара-селективности.[17]
Перегруппировка Гофмана
NBS, при наличии сильной базы, такой как DBU, реагирует с первичными амиды произвести карбамат через Перегруппировка Гофмана.[18]
Селективное окисление спиртов
Это необычно, но возможно для NBS окислять спирты. Э. Дж. Кори и другие. обнаружил, что можно выборочно окислять вторичный спирты в присутствии первичных спиртов с использованием NBS в водной диметоксиэтан (DME).[19]
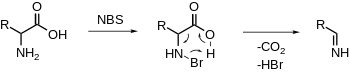
Окислительное декарбоксилирование α-аминокислот
NBS электрофильно бромирует амин, за чем следует декарбоксилирование и высвобождение имина. Дальнейший гидролиз даст альдегид и аммиак.[20][21] (ср. неокислительное PLP-зависимое декарбоксилирование)
Меры предосторожности
Хотя с NBS легче и безопаснее обращаться, чем с бромом, следует соблюдать меры предосторожности, чтобы избежать вдыхания. НБС следует хранить в холодильнике. NBS со временем разлагается с выделением брома. Чистый NBS имеет белый цвет, но часто бывает, что он не совсем белый или коричневый из-за брома.
Обычно реакции с участием NBS экзотермичны. Поэтому при крупномасштабном использовании следует принимать дополнительные меры предосторожности.
Смотрите также
Рекомендации
- ^ Ziegler, K .; Späth, A. (1942). "Die Halogenierung ungesättigter Substanzen in der Allylstellungs". Анна. Chem. 551 (1): 80–119. Дои:10.1002 / jlac.19425510103.
- ^ Dauben, H.J., Jr; Маккой, Л. Л. (1959). "N-Бромсукцинимид. I. Аллильное бромирование, общий обзор реакционных переменных ». Варенье. Chem. Soc. 81 (18): 4863–4873. Дои:10.1021 / ja01527a027.
- ^ Ханзлик, Р. П. «Селективное эпоксидирование концевых двойных связей». Органический синтез.; Коллективный объем, 6, п. 560
- ^ Бегер, Дж. (1991). "Препаративный аспект электрофильных трехкомпонентных реакций с алкенами". J. Prakt. Chem. 333 (5): 677–698. Дои:10.1002 / prac.19913330502.
- ^ Haufe, G .; Alvernhe, G .; Laurent, A .; Ernet, T .; Goj, O .; Kröger, S .; Саттлер, А. (2004). «Бромфторирование алкенов». Органический синтез.; Коллективный объем, 10, п. 128
- ^ Джерасси, Карл (1948). "Бромирование с N-Бромсукцинимид и родственные соединения. Реакция Воля – Циглера ». Chem. Ред. 43 (2): 271–317. Дои:10.1021 / cr60135a004. PMID 18887958.
- ^ Greenwood, F. L .; Kellert, M.D .; Седлак, Дж. (1963). «4-Бром-2-гептен». Органический синтез.; Коллективный объем, 4, п. 108
- ^ Воль, А. (1919). "Bromierung ungesättigter Verbindungen mit N-Бром-ацетамид, ein Beitrag zur Lehre vom Verlauf chemischer Vorgänge " [Бромирование непредельных соединений с N-бромоацетамид, вклад в теорию протекания химических процессов. Berichte der Deutschen Chemischen Gesellschaft (серии A и B). 52: 51–63. Дои:10.1002 / cber.19190520109.
- ^ Ziegler, K .; Schenck, G .; Krockow, E.W .; Зиберт, А .; Wenz, A .; Вебер, Х. (1942). "Die Synthese des Cantharidins" [Синтез кантаридина]. Annalen der Chemie Юстуса Либиха. 551: 1–79. Дои:10.1002 / jlac.19425510102.
- ^ Binkley, R.W .; Гоуи, Г. С .; Джонстон, Дж. (1984). «Региоселективное раскрытие кольца выбранных бензилиденацеталей. Фотохимически инициированная реакция для частичного снятия защиты с углеводов». J. Org. Chem. 49 (6): 992. Дои:10.1021 / jo00180a008.
- ^ Harpp, D. N .; Bao, L.Q .; Coyle, C .; Gleason, J. G .; Горович, С. (1988). «2-бромгексаноилхлорид». Органический синтез.; Коллективный объем, 6, п. 190
- ^ Stotter, P.L .; Хилл, К. А. (1973). «α-Галогенкарбонильные соединения. II. Получение α-бромкетонов в зависимости от положения путем бромирования енолятов лития. Введение α, β-ненасыщенности в несимметричные кетоны в зависимости от положения». J. Org. Chem. 38 (14): 2576. Дои:10.1021 / jo00954a045.
- ^ Лихтенталер, Ф. В. (1992). «Различные доноры гликозила с функцией кетона или оксима рядом с аномерным центром: легкая подготовка и оценка их избирательности в гликозидации». Синтез. 1992: 179–84. Дои:10.1055 / с-1992-34167.
- ^ Амат, М .; Hadida, S .; Sathyanarayana, S .; Боск, Дж. (1998). «Региоселективный синтез 3-замещенных индолов». Органический синтез.; Коллективный объем, 9, п. 417
- ^ Gilow, H.W .; Бертон, Д. Э. (1981). «Бромирование и хлорирование пиррола и некоторых реакционноспособных 1-замещенных пирролов». J. Org. Chem. 46 (11): 2221. Дои:10.1021 / jo00324a005.
- ^ Brown, W. D .; Гуляев, А. Х. (2005). «Синтез 5-бромизохинолина и 5-бром-8-нитроизохинолина». Органический синтез. 81: 98.
- ^ Mitchell, R.H .; Lai, Y. H .; Уильямс, Р. В. (1979). "N-Бромсукцинимид-диметилформамид: мягкий, селективный ядерный реагент монобромирования для реакционноспособных ароматических соединений ». J. Org. Chem. 44 (25): 4733. Дои:10.1021 / jo00393a066.
- ^ Keillor, J. W .; Хуанг, X. (2004). «Образование метилкарбамата посредством модифицированных реакций перегруппировки Хофмана». Органический синтез.; Коллективный объем, 10, п. 549
- ^ Кори, Э. Дж.; Исигуро, М. (1979). «Полный синтез (±) -2-изоцианопупукеанана». Tetrahedron Lett. 20 (30): 2745–2748. Дои:10.1016 / S0040-4039 (01) 86404-2.
- ^ Рамачандран, М. С .; Ишварамурти, Д .; Rajasingh, V .; Вивеканандам, Т.С. (01.01.1990). "N-Хлорсукцинимид-промотируемое окислительное декарбоксилирование α-аминокислот в водной щелочной среде ». Бюллетень химического общества Японии. 63 (8): 2397–2403. Дои:10.1246 / bcsj.63.2397.
- ^ Сун, Сюэчжэн; Джу, Хун; Чжао, Чуньмэй; Ласанаяк, Йи (2014-10-15). "Новая стратегия для выпуска и маркировки N-Гликаны для функциональной гликомики ». Биоконъюгат Химия. 25 (10): 1881–1887. Дои:10.1021 / bc500366v. ISSN 1043-1802. ЧВК 4197647. PMID 25222505.
внешняя ссылка
- Использование N-бромосукцинимид в органическом синтезе
- Реакции с NBS