WikiDer > Элиас Джеймс Кори
E.J. Кори | |
|---|---|
 Кори в 2007 году | |
| Родился | Элиас Джеймс Кори 12 июля 1928 г. Метуэн, Массачусетс, Соединенные Штаты |
| Национальность | Соединенные Штаты |
| Альма-матер | Массачусетский Институт Технологий |
| Известен | Ретросинтетический анализ |
| Награды |
|
| Научная карьера | |
| Поля | Органическая химия |
| Учреждения | Университет Иллинойса в Урбане-Шампейн Гарвардский университет |
| Докторант | Джон С. Шиэн |
| Известные студенты | |
| Интернет сайт | химия |
Элиас Джеймс "E.J." Кори (родился 12 июля 1928 г.) - американец химик-органик. В 1990 году он выиграл Нобелевская премия по химии "за развитие теории и методологии органический синтез",[3] конкретно ретросинтетический анализ.[4][5] Считающийся многими одним из величайших современных химиков, он разработал множество синтетических реагенты, методологии и тотальный синтез и значительно продвинул науку об органическом синтезе.
биография
E.J. Кори (фамилия была англизирована от Ливанский арабский Хури, смысл священник) родился в Христианин Ливанские иммигранты в Метуэн, Массачусетс, В 50 км к северу от Бостона.[6] Его мать изменила его имя на «Элиас» в честь отца, который умер через восемнадцать месяцев после рождения Кори. Его овдовевшая мать, брат, две сестры, тетя и дядя жили вместе в просторном доме, преодолевая трудности. Великая депрессия. В детстве Кори был независимым и увлекался такими видами спорта, как бейсбол, футбол и пешие прогулки. Он учился в католической начальной школе и Средняя школа Лоуренса в Лоуренс, Массачусетс.
В 16 лет Кори поступил Массачусетский технологический институт, где он заработал степень бакалавра в 1948 г. и Кандидат наук. под руководством профессора Джон С. Шиэн в 1951 году. Поступив в Массачусетский технологический институт, Кори имел только математический опыт, и он начал свою карьеру в колледже, получив степень инженера. После первого урока химии на втором курсе он начал переосмысливать свои долгосрочные карьерные планы и окончил университет со степенью бакалавра химии. Сразу после этого, по приглашению профессора Джона С. Шихана, Кори остался в Массачусетском технологическом институте, чтобы получить степень доктора философии. После окончания аспирантуры ему предложили место в Университет Иллинойса в Урбане-Шампейн, где он стал полноправным профессором химии в 1956 году в возрасте 27 лет. Он был инициирован как член главы Зетов Альфа Хи Сигма в Университете Иллинойса в 1952 году.[7] В 1959 году он переехал в Гарвардский университет, где он в настоящее время является почетным профессором органической химии с активной исследовательской программой Corey Group. Он решил работать в области органической химии из-за «присущей ей красоты и большого значения для здоровья человека».[8] Он также был советником Pfizer более 50 лет.[9]
Среди множества наград Кори был удостоен награды Национальная медаль науки в 1988 г.[10] то Нобелевская премия по химии в 1990 г.,[5] и Американское химическое обществовеличайшая честь, Медаль Пристли, в 2004 году.[11]
Основные вклады
Реагенты
E.J. Кори разработал несколько новых синтетических реагентов:
- PCC (хлорхромат пиридиния), также называемый Реагент Кори-Саггса, широко используется для окисления спирты соответствующему кетоны и альдегиды.[12] PCC имеет несколько преимуществ перед другими коммерческими окислителями.
Одно из этих преимуществ состоит в том, что этот состав доступен в виде стабильного на воздухе твердого вещества желтого цвета, которое не очень гигроскопично. В отличие от других окислителей, PCC может выполнять однократное окисление всего лишь с 1,5 эквивалентами (схема 1). Спирт выполняет нуклеофильную атаку на электроположительные хром(VI) металл, вытесняющий хлор. В хлористый анион затем действует как основание, давая альдегидный продукт и хром (IV). Слабокислый характер PCC делает его полезным для реакций циклизации со спиртами и алкены (Схема 2).[13]
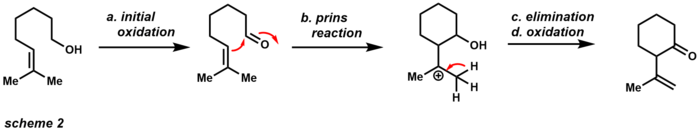
Первоначальное окисление дает соответствующий альдегид, который затем может подвергаться Реакция принса с соседними алкен. После удаления и дальнейшего окисления продукт представляет собой циклический кетон. Если этот продукт нежелательный, измельчите ацетат натрия может использоваться в качестве буфера для достижения только начального окисления. Устойчивость PCC как окислителя также сделала его полезным в области полного синтеза (схема 3). Этот пример показывает, что PCC может выполнять Окислительная перегруппировка Даубена с третичными спиртами через [3,3] -сигматропную перегруппировку.[14]
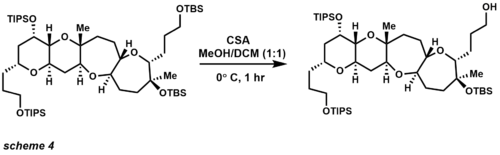
- т-Бутилдиметилсилиловый эфир (TBS),[15] триизопропилсилиловый эфир (TIPS) и метоксиэтоксиметил (MEM): популярные спирты защитные группы. Развитие этих защитных групп позволило синтезировать несколько натуральные продукты у которого не было функциональная группа совместимость выдерживать стандартные химические превращения. Хотя синтетическое сообщество в настоящее время отходит от использования защитных групп, по-прежнему редко когда опубликованный синтез натурального продукта их не использует. С 1972 года группа TBS стала самой популярной. кремний защитная группа. TBS устойчив к хроматография и достаточно лабильны для расщепления в основных и кислых условиях. Что еще более важно, TBS эфиры устойчивы к некоторым нуклеофилам углерода, таким как реактивы Гриньяра и еноляты.[16][17][18]
В области синтеза сложных молекул TBS широко используется как одна из наиболее универсальных защитных групп на основе кремния (схема 4).[19][20] Использование CSA обеспечивает селективное удаление первичного эфира TBS в присутствии третичного эфира TBS и простых эфиров TIPS. Другие способы снятия защиты TBS включают кислоты (также кислоты Льюиса) и фториды. Защитные группы TIPS также были изобретены Кори и обеспечивают повышенную селективность защиты первичного спирта по сравнению с защитой вторичного и третичного спирта. Простые эфиры TIPS более стабильны в кислых и основных условиях, недостатком этой защитной группы по сравнению с простыми эфирами TBS является то, что группа менее лабильна для снятия защиты.[21] Наиболее распространенные реагенты, используемые для расщепления, используют те же условия, что и эфир TBS, но обычно требуется более длительное время реакции.
Обычно простые эфиры TBS разделяются TBAF, но затрудненный эфир TBS, указанный выше, выживает в условиях реакции при первичном удалении TIPS (схема 5).[22] Защитная группа МЕМ была впервые описана Кори в 1976 году.[23] Эта защитная группа аналогична по реакционной способности и стабильности другим алкоксиметиловым эфирам в кислых условиях. Отщепление защитных групп MEM обычно осуществляется в кислых условиях, но координация с галогенидами металлов значительно увеличивает лабильность за счет вспомогательного отщепления (схема 6).[24]
- 1,3-Дитиан были первыми Э.Дж. Кори в 1965 году как временная модификация карбонил группа в реакциях замещения и присоединения. Образование дитиана было первоначальным развитием, которое ввело Umpolung химии и широко используется для обращения реакционной способности. Образование дитианов может осуществляться кислотой Льюиса (схема 7) или непосредственно из карбонильных соединений.[25]
PKa дитианов составляет приблизительно 30, что позволяет депротонировать с помощью алкиллитиевого реагента, обычно н-бутиллитий. Реакция с дитианами и альдегидами теперь известна как Реакция Кори-Зеебаха. Депротонированный дитиан служит ацильным анионом, используемым для атаки входящих электрофилы. После снятия защиты с дитиана, обычно с помощью HgO, наблюдается образование кетонового продукта из замаскированного ацилдитиан-аниона. Применение таких реакций расширило сферу органического синтеза, позволив химикам-синтетикам использовать разобщения Umpolung в полном синтезе (схема 8).[26] 1,3-дитианы также используются в качестве защитных групп для карбонильных соединений, выражая универсальность и полезность этой функциональной группы.
- Кроме того, Кори начал подробные исследования катионных циклизаций полиолефинов, используемых в ферментативном производстве холестерин из более простых растительных терпенов.[27] Кори установил детали замечательного процесса циклизации, сначала изучив биологический синтез стеролов из сквалена.
Методология
Несколько реакций, разработанных в лаборатории Кори, стали обычным явлением в современной синтетической органической химии. С 1950 года в группе Кори было разработано как минимум 302 метода.[28] В его честь названы несколько реакций:
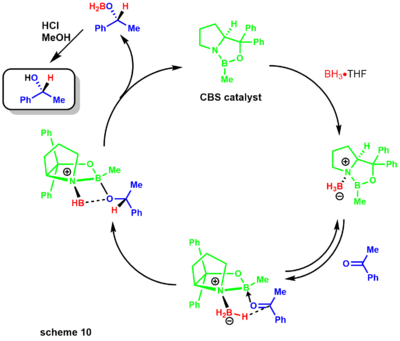
- Редукция Кори-Ицуно, также известное как восстановление Кори-Бакши-Шибаты, представляет собой энантиоселективное восстановление кетонов до спиртов с использованием оксазаборолидина. катализатор и различные бораны в качестве стехиометрического восстановителя.[29] Группа Кори впервые продемонстрировала синтез катализатора с использованием борана и хиральных аминоспиртов. В реакции используется хиральная аминокислота. пролин и в присутствии борана приводит к Катализатор CBS (схема 9).[30][31]
Позже Кори продемонстрировал, что замещенные бораны легче приготовить и гораздо более стабильны. Механизм восстановления начинается с того, что оксазоборолидин лишь слегка щелочной по [азоту], координируясь со стехиометрическим бораном бор-аминного комплекса (схема 10).[31] Отсутствие донорства азота в бор увеличивает его кислотность по Льюису, обеспечивая координацию с кетоновым субстратом. Комплексообразование субстрата происходит из наиболее доступной неподеленной пары кислород что приводит к ограниченному вращению вокруг связи B-O из-за стерически соседней фенильной группы.[32]
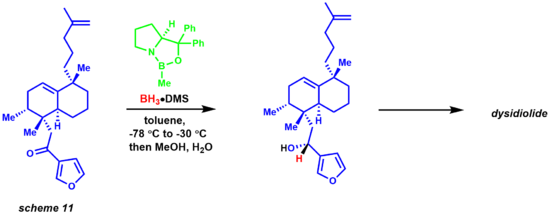
Миграция гидрида от борана к электрофильному кетонному центру происходит через переходное состояние 6-членного кольца, что приводит к промежуточному образованию четырехчленного кольца, в конечном итоге обеспечивающему хиральный продукт и регенерацию катализатора. Реакция также была очень полезна химикам, занимающимся натуральными продуктами (схема 11).[33][34] Синтез дисидиолида Кори и соавторами был достигнут посредством энантиоселективного восстановления CBS с использованием комплекса боран-диметилсульфид.
- Синтез алкинов Кори-Фукса это синтез терминального алкины через одноуглеродную омологацию альдегидов с использованием трифенилфосфин и тетрабромид углерода.[30][35] Механизм аналогичен механизму Реакция Виттига путем образования фосфора илида с трифенилфосфином и тетрабромидом углерода. Взаимодействие илида фосфора с альдегидным субстратом дает дибромолефин.[36]
На лечении двумя эквивалентами п-buLi, обмен галогена лития и депротонирование дает соединение ацетилида лития, которое подвергается гидролизу с образованием конечного алкинового продукта (схема 12).[30] Совсем недавно был разработан однореакторный синтез с использованием модифицированной процедуры.[37] Эта синтетическая трансформация была доказана успешной в полном синтезе (+) - тейлориона W.J. Kerr и соавторами (схема 13).[38]
- В Окисление Кори-Кима было недавно разработанным преобразованием для превращения спиртов в соответствующие альдегиды и кетоны.[30][39] Этот процесс предлагает менее токсичную альтернативу окислению на основе хрома с использованием N-хлорсукцинимидосульфония хлорид (NCS), диметилсульфид (DMS) и триэтиламин (ЧАЙ). Реагент Кори-Кима образуется в место когда NCS и DMS реагируют с образованием разновидностей хлорида диметилсукцинимидосульфония (схема 14).[30]
Соль алкоксисульфония депротонируется по альфа-положению триэтиламином с получением окисленного продукта. Реакция включает широкий спектр функциональных групп, но аллильные и бензильные спирты обычно превращаются в аллильные и бензильные хлориды. Его применение в синтезе основано на мягких условиях протокола и совместимости функциональных и защитных групп. В полном синтезе ингенола Куваджима и его сотрудники использовали окисление Кори-Кима путем селективного окисления менее затрудненного вторичного спирта (схема 15).[40]
- Кори-Винтер олефинирование представляет собой стереоспецифическое превращение 1,2-диолов в алкены с участием диольного субстрата, тиокарбонилдиимидазола и избытка триалкилфосфита.[30][41] Механизм был сужен до двух возможных путей, но точный механизм неизвестен.[42] В частности, реакция между тионокарбонатом и триалкилфосфитом протекает либо через образование разновидностей илида фосфора, либо через промежуточное соединение карбеноидов. Тем не менее, реакция является стереоспецифической для большинства субстратов, если только продукт не приведет к чрезмерно напряженной структуре. Кори и соавторы предприняли попытку образования стерически затрудненных транс-алкенов, присутствующих в 7-членных кольцах, но безуспешно даже при использовании этой новой синтетической методологии, вызывающей огромное напряжение кольца. Что еще более важно, стереоспецифические алкены присутствуют в нескольких природных продуктах, поскольку этот метод продолжает использоваться для получения ряда сложных субстратов. Профессор Т.К.М. Шинг и другие использовали реакцию олефинирования Кори-Винтера для синтеза (+) - боэзеноксида (схема 16).[43]
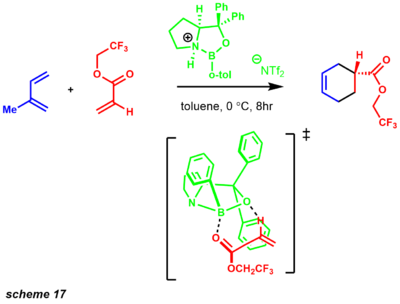
- CBS энантиоселективный Реакция Дильса-Альдера был разработан с использованием каркаса, аналогичного энантиоселективному восстановлению CBS.[31] После развития этой реакции реагент CBS оказался очень универсальным реагентом для ряда мощных синтетических превращений. Использование хиральной кислоты Льюиса, такой как катализатор CBS, включает широкий диапазон ненасыщенных Enones субстраты. Реакция, вероятно, протекает через высокоорганизованное предпереходное состояние 6-членного кольца с получением высокоэнантиообогащенных продуктов (схема 17).[44]
Это переходное состояние, вероятно, происходит из-за благоприятного пи-стэкинга с фенильным заместителем.[31][45] Энантиоселективности процесса способствует приближение диена к диенофилу с противоположной стороны фенильного заместителя. Реакция Дильса-Альдера - одно из самых мощных преобразований в синтетической химии. Синтез природных продуктов с использованием реакции Дильса-Альдера в качестве трансформации был применен, в частности, к образованию шестичленных колец (схема 18).[46]
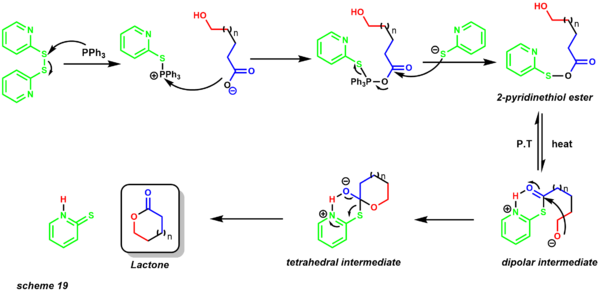
- Макролактонизация Кори-Николау предоставляет первый метод приготовления средних и крупных лактоны.[30][47] Ранее межмолекулярная лактонизация превосходила внутримолекулярную лактонизацию даже при низких концентрациях. Одним из больших преимуществ этой реакции является то, что ее проводят в нейтральных условиях, допускающих присутствие кислотных и неустойчивых к основанию функциональных групп. К настоящему времени этим методом успешно синтезированы кольца от 7 до 48 членов.[48]
Реакция протекает в присутствии 2,2'-дипиридилдисульфида и трифенилфосфина. Реакцию обычно кипятят с обратным холодильником в неполярном растворителе, таком как бензол. Механизм начинается с образования эфира 2-пиридинтиола (схема 19). Перенос протона обеспечивает диполярный промежуточный продукт, в котором алкоксид нуклеофил атакует электрофильный карбонильный центр, обеспечивая тетраэдрический промежуточный продукт, который дает продукт макролактон. Один из первых примеров этого протокола был применен к полному синтезу зеараленон (схема 20).[49]
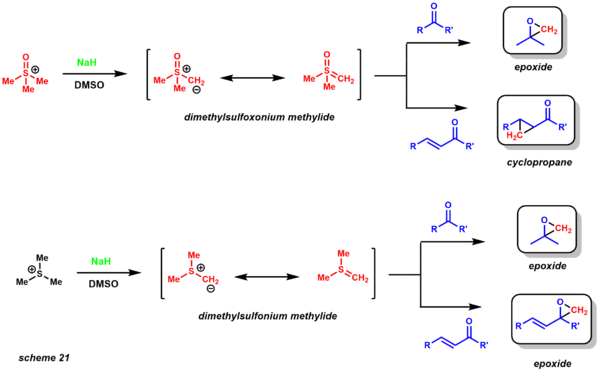
- Реакция Джонсона-Кори-Чайковского полезен для синтеза эпоксиды и циклопропаны.[30] В результате реакции in situ образуется илид серы, который реагирует с енонами, кетонами, альдегидами и имины с образованием соответствующих эпоксидов, циклопропанов и азиридины.[50] Были использованы два варианта илида серы, дающие разные хемеоселективные продукты (схема 21). Метилид диметилсульфоксония дает эпоксиды из кетонов, но дает циклопропаны, когда используются еноны. Метилид диметилсульфония превращает кетоны и еноны в соответствующие эпоксиды. Метилид диметилсульфония намного более реакционноспособен и менее стабилен, чем метилид диметилсульфоксония, поэтому он образуется при низких температурах.[51]
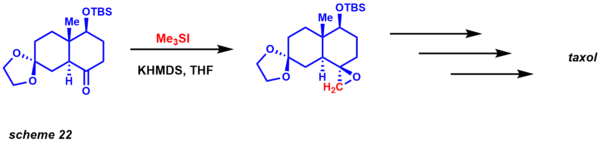
Основываясь на их реакционной способности, еще одно явное преимущество этих двух вариантов состоит в том, что они кинетически различаются по диастереоселективности. Реакция очень хорошо изучена, также были получены энантиоселективные варианты (каталитические и стехиометрические). С точки зрения ретросинтетического анализа, эта реакция представляет собой разумную альтернативу обычным реакциям эпоксидирования алкенами (схема 22). Данишефский использовал эту методологию для синтеза таксола. Диастереоселективность устанавливается 1,3-взаимодействиями в переходном состоянии, необходимом для закрытия эпоксида.[52]
Всего синтезов
Э. Дж. Кори и его исследовательская группа завершили множество общий синтез. С 1950 года в группе Кори было синтезировано не менее 265 соединений.[53]
Его полный синтез 1969 года нескольких простагландины считаются классикой.[54][55][56][57] В частности, синтез простагландина F2α представляет собой несколько проблем. Наличие обоих СНГ и транс олефины, а также пять асимметричных атомов углерода делают молекулу желаемой проблемой для химиков-органиков. Ретросинтетический анализ Кори выделяет несколько ключевых разрывов, которые приводят к упрощенным предшественникам (схема 23).
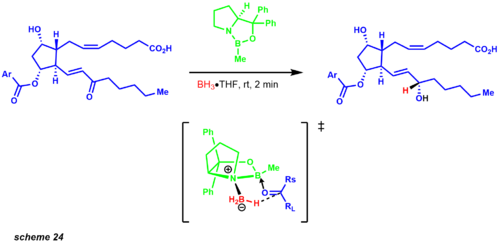
Молекулярное упрощение началось сначала с разъединения обеих углеродных цепей с помощью реакции Виттига и модификации Хорнера-Уодсворта-Эммонса. Реакция Виттига дает СНГ продукт, в то время как Horner-Wadsworth Emmons производит транс олефин. Опубликованный синтез показывает смесь диастереомеров 1: 1 восстановления карбонила с использованием боргидрида цинка. Однако спустя годы Кори и его сотрудники установили сокращение CBS. Одним из примеров, иллюстрирующих этот протокол, был промежуточный продукт в синтезе простагландина, показывающий смесь 9: 1 желаемого диастереомера (схема 24).[33]
Трансформация йодолактонизации дает аллильный спирт, ведущий к ключевому промежуточному соединению Байера-Виллигера. Это окисление региоселективно вставляет атом кислорода между кетоном и наиболее богатым электронами участком. Основное промежуточное соединение приводит к прямому преобразованию в структурную цель Дильса-Альдера, которая обеспечивает углеродный каркас для функционализированного циклопентанового кольца. Позже Кори разработал асимметричную реакцию Дильса-Альдера с использованием хирального оксазоборолидина, что значительно упростило путь синтеза простагландинов.
Другие известные синтезы:
- Лонгифолен[58][59]
- Гинкголиды А[60] и B[61][62]
- Лактацистин[63]
- Мироэстрол[64]
- Эктеинасцидин 743[65]
- Салиноспорамид А[66]
Публикации
E.J. У Кори более 1100 публикаций.[67] В 2002 году Американское химическое общество (ACS) признало его «Самым цитируемым автором по химии». В 2007 году он получил первую награду ACS Publications Division «Цикл за выдающийся вклад в выдающийся вклад».[68] и был признан химиком номер один с точки зрения результатов исследований по индексу Хирша (индекс Хирша).[69] Его книги включают:
- E.J. Кори и Ласло Курти, Энантиоселективный химический синтез: методы, логика и практика, ООО «Директ Бук Паблишинг», 2010 г., ISBN 978-0-615-39515-9
- Элиас Джеймс Кори, Сюэ-Мин Ченг. Логика химического синтеза. Wiley-Interscience, 1995, ISBN 0-471-11594-0.
- Э. Дж. Кори, Барбара Чако, Ласло Кюрти. Молекулы и медицина Джон Вили и сыновья, 2008.
- Назовите реакции в химии гетероциклов / под ред. Джи-Джека Ли; научный редактор, Э.Дж. Кори. Хобокен, штат Нью-Джерси: Wiley-Interscience, 2005.
- Назовите реакции для превращений функциональных групп / под ред. Джи Джека Ли, Э.Дж. Кори. Хобокен, штат Нью-Джерси: Wiley-Interscience, 2007.
Альтом самоубийство
Джейсон Алтом, один из учеников Кори, покончил жизнь самоубийством в 1998 году.[70] Самоубийство Алтома вызвало споры, потому что он прямо обвинил Кори, своего научного консультанта, в своем самоубийстве.[71] В своей прощальной записке в 1998 году Алтом назвал "оскорбительные научные руководители" одной из причин покушения на его жизнь. Предсмертная записка Алтома также содержала четкие инструкции о том, как изменить отношения между студентами и их руководителями.
Хотя Алтом был вторым самоубийцей за столько лет в лаборатории Кори,[72] Кори был опустошен и сбит с толку смертью своего ученика.[73] Кори сказал: «В этом письме нет смысла. В конце концов, Джейсон, должно быть, был в высшей степени бредовым или иррациональным». Кори также утверждал, что никогда не подвергал сомнению интеллектуальный вклад Алтома. «Я приложил все усилия, чтобы направить Джейсона, как горный гид, чтобы направить кого-то, кто поднимается на гору. Я старался изо всех сил на каждом этапе пути», - говорит Кори. «Моя совесть чиста. Все, что сделал Джейсон, было результатом нашего сотрудничества. У нас никогда не было ни малейших разногласий».[70] В Американский фонд предотвращения самоубийств (AFSP) цитируется Нью-Йорк Таймс статья о самоубийстве Алтома в качестве примера проблемного сообщения, в которой утверждается, что Алтом представил предупреждающие признаки депрессии и суицидальных мыслей и что в статье был назван козлом отпущения Кори, несмотря на отсутствие вторичных доказательств того, что поведение советника способствовало страданиям Алтома.[74][75] Согласно с Бостонский глобус По словам студентов и профессоров, Алтом фактически сохранил поддержку Кори.[73]
В результате смерти Альтома химический факультет принял предложение, позволяющее аспирантам попросить двух дополнительных преподавателей сыграть небольшую консультативную роль при подготовке диссертации.[76][71]
Члены группы Кори
По состоянию на 2010 год членами Corey Group было около 700 человек. База данных о 580 бывших участниках и их нынешних членах была разработана к 80-летию Кори в июле 2008 года.[77]
Правила Вудворда – Хоффмана
Когда в 2004 году Э. Дж. Кори был награжден медалью Пристли, он вызвал разногласия, заявив, что он вдохновил Роберт Бернс Вудворд до разработки Правила Вудворда – Хоффмана. Кори писал:
«4 мая 1964 года я предложил своему коллеге Р. Б. Вудворду простое объяснение, включающее симметрию возмущенных (ВЗМО) молекулярных орбиталей для стереоселективных превращений циклобутен → 1,3-бутадиен и 1,3,5-гексатриен → циклогексадиен, что послужили основой для дальнейшего развития этих идей в то, что стало известно как правила Вудворда – Хоффмана ».[78]
Это было первое публичное заявление Кори о том, что начиная с 5 мая 1964 года Вудворд выдвигал объяснение Кори как свою собственную мысль без упоминания Кори и разговора 4 мая. Кори обсуждал свое заявление в частном порядке с Хоффманном и близкими коллегами с 1964 Кори упоминает, что сделал заявление Пристли. "так что историческая запись будет правильной".[79]
Заявление Кори и его вклад были публично опровергнуты Роальд Хоффманн в журнале Angewandte Chemie. В опровержении Хоффманн заявляет, что в ходе долгого обсуждения этого вопроса он спросил Кори, почему Кори не обнародовал этот вопрос. Кори ответил, что, по его мнению, такое публичное разногласие повредит Гарварду и что он «не станет« делать что-либо против Гарварда, которому я был и так предан ». Кори также надеялся, что сам Вудворд исправит исторические записи, «когда станет старше, более внимательным и более чувствительным к своей совести».[80] Вудворд внезапно умер во сне от сердечного приступа в 1979 году.
Награды и отличия
E.J. Кори получил более 40 крупных наград, в том числе Премия Линуса Полинга (1973), Франклин Медаль (1978), Приз Тетраэдра (1983), Премия Вольфа по химии (1986), Национальная медаль науки (1988), Премия Японии (1989), Нобелевская премия по химии (1990), Золотая пластина Американская академия достижений (1991),[81] Роджера Адамса (1993) и Медаль Пристли (2004).[11] Он был введен в должность Альфа Хи Сигма Зал славы 1998 года.[7]По состоянию на 2008 год он был удостоен 19 почетных степеней университетов по всему миру, включая Оксфордский университет (ВЕЛИКОБРИТАНИЯ), Кембриджский университет (Великобритания) и Национальный университет Чунг Ченг.[82] В 2013 году журнал E.J. Институт биомедицинских исследований Кори (CIBR) открылся в Цзянъине, провинция Цзянсу, Китай.[83]
Кори был избран Иностранный член Королевского общества (ForMemRS) в 1998 г..[2]
использованная литература
- ^ Лауреаты Премии Японии В архиве 7 апреля 2016 г. Wayback Machine. japanprize.jp
- ^ а б "Профессор Элиас Кори - иностранный член MEMRS". Лондон: Королевское общество. Архивировано из оригинал на 2015-10-18.
- ^ "Нобелевская премия по химии 1990 г.". Nobelprize.org. Получено 2015-07-25.
- ^ Э. Дж. Кори, X-M. Ченг, Логика химического синтеза, Уайли, Нью-Йорк, 1995, ISBN 0-471-11594-0.
- ^ а б Кори, Э.Дж. (1991). «Логика химического синтеза: многоступенчатый синтез сложных карбогенных молекул (Нобелевская лекция)». Энгью. Chem. Int. Эд. Англ. 30 (5): 455–465. Дои:10.1002 / anie.199104553.
- ^ Элиас Джеймс Кори - Автобиография В архиве 6 июля 2008 г. Wayback Machine. nobelprize.org
- ^ а б Братство - Награды - Зал славы - Alpha Chi Sigma В архиве 26 января 2016 г. Wayback Machine
- ^ Кори, Э.Дж. (1990). "Автобиография Нобелевской премии". Nobelprize.org: официальный сайт Нобелевской премии. Получено 2010-09-09.
- ^ "Собрание сочинений Элиаса Дж. Кори, Notes, Pfizer, Празднование вашего 80-летия". 2008-06-27. Получено 2013-11-15.
- ^ Национальный научный фонд - Национальная медаль президента за науку В архиве 15 октября 2012 г. Wayback Machine
- ^ а б См. Статью E.J. Кори, Об Э.Дж. Кори, вкладка Major Awards "Собрание сочинений Элиаса Дж. Кори". 2008-07-12. Получено 2013-11-15.
- ^ Кори, E.J .; Саггс, В. (1975). «Хлорхромат пиридини. Эффективный реагент для окисления первичных и вторичных спиртов до карбонильных соединений». Tetrahedron Lett. 16 (31): 2647–2650. Дои:10.1016 / с0040-4039 (00) 75204-х.
- ^ Кори, Э. Дж .; Богер, Д. (1978). «Реакции окислительной катионной циклизации, осуществляемые хлорхроматом пиридиния». Tetrahedron Lett. 19 (28): 2461–2464. Дои:10.1016 / с0040-4039 (01) 94800-2.
- ^ Ян; и другие. (2010). «Асимметричный полный синтез карибенола А». JACS. 132 (39): 13608–13609. Дои:10.1021 / ja106585n. PMID 20831198.
- ^ Кори, Э. Дж .; Венкатешварлу, А. (1972). «Защита гидроксильных групп как производные трет-бутилдиметилсилила». Варенье. Chem. Soc. 94 (17): 6190–6191. Дои:10.1021 / ja00772a043.
- ^ Коценски, П.Дж. Защита групп; Георг Тиме Верлаг: Германия, 2000 г.
- ^ Friesen, R.W .; и другие. (1991). «Высокостереоселективное превращение α-алленовых спиртов в производные 1,2-синаминоспирта посредством йодокарбамирования». Tetrahedron Lett. 31 (30): 4249–4252. Дои:10.1016 / S0040-4039 (00) 97592-0.
- ^ Имание; и другие. (1992). «Легкое поколение α-силильных карбанионов». Tetrahedron Lett. 33 (4): 543–546. Дои:10.1016 / s0040-4039 (00) 93991-1.
- ^ Мори; и другие. (1998). «Формальный полный синтез гемибреветоксина B с помощью оксиранил-анионной стратегии». J. Org. Chem. 63 (18): 6200–6209. Дои:10.1021 / jo980320p. PMID 11672250.
- ^ Ферстнер; и другие. (2001). «Метатезис алкинов: разработка новой системы катализатора на основе молибдена и ее применение для полного синтеза эпотилона А и С». Chem. Евро. J. 7 (24): 5299–5317. Дои:10.1002 / 1521-3765 (20011217) 7:24 <5299 :: aid-chem5299> 3.0.co; 2-x. PMID 11822430.
- ^ Огилви; и другие. (1974). «Селективная защита гидроксильных групп дезоксинуклеозидов с помощью алкилсилильных реагентов». Tetrahedron Lett. 116 (33): 2865–2868. Дои:10.1016 / s0040-4039 (01) 91764-2.
- ^ Кадота; и другие. (1998). «Стереоконтролируемый общий синтез гемибреветоксина B». J. Org. Chem. 63 (19): 6597–6606. Дои:10.1021 / jo9807619.
- ^ Кори; и другие. (1976). «Новый общий метод защиты гидроксильной функции». Tetrahedron Lett. 17 (11): 809–812. Дои:10.1016 / с0040-4039 (00) 92890-9.
- ^ Чан; и другие. (1989). «Полный синтез L-659 699, нового ингибитора биосинтеза холестерина». J. Org. Chem. 54 (24): 5708–5712. Дои:10.1021 / jo00285a017.
- ^ Кори, Э. Дж .; Зеебах, Д. (1965). «Синтез 1, n-дикарбонильных производных с использованием карбанионов из 1,3-дитиана». Энгью. Chem. Int. Эд. 4 (12): 1077–1078. Дои:10.1002 / anie.196510771.
- ^ Кори; и другие. (1982). «Полный синтез аплазмомицина». JACS. 104 (24): 6818–6820. Дои:10.1021 / ja00388a074.
- ^ Wendt, K.U .; Schulz, G.E .; Лю, Д.Р .; Кори, Э.Дж. (2000). «Ферментные механизмы образования полициклического тритерпена». Angewandte Chemie International Edition на английском языке. 39 (16): 2812–2833. Дои:10.1002 / 1521-3773 (20000818) 39:16 <2812 :: help-anie2812> 3.3.co; 2-r. PMID 11027983.
- ^ См. Вкладку "Методы""Собрание сочинений Элиаса Дж. Кори". 2008-07-12. Получено 2013-11-15.
- ^ Кори, Э. Дж .; и другие. (1998). «Восстановление карбонильных соединений с помощью хиральных оксазаборолидиновых катализаторов: новая парадигма энантиоселективного катализа и новый мощный метод синтеза». Энгью. Chem. Int. Эд. 37 (15): 1986–2012. Дои:10.1002 / (sici) 1521-3773 (19980817) 37:15 <1986 :: aid-anie1986> 3.0.co; 2-z. PMID 29711061.
- ^ а б c d е ж г час Kurti, L .; Чако, Б. Стратегические применения названных реакций в органическом синтезе; Эльзевир: Берлингтон, 2005.
- ^ а б c d Кори, E.J .; Курти, Л. Энантиоселективный химический синтез; Прямое издание книги: Даллас, 2010 г.
- ^ Кори, E.J .; Бакши, Р.К .; Шибата, С. (1987). «Высокоэнантиоселективное борановое восстановление кетонов, катализируемое хиральными оксазаборолидинами. Механизм и синтетические последствия». JACS. 109 (18): 5551–5553. Дои:10.1021 / ja00252a056.
- ^ а б Кори; и другие. (1987). «Стабильный и легко приготовленный катализатор энантиоселективного восстановления кетонов. Применение в многостадийных синтезах». JACS. 109 (25): 7925–7926. Дои:10.1021 / ja00259a075.
- ^ Кори, Э. Дж .; Робертс, Б. Э. (1997). «Полный синтез дисидиолида». JACS. 119 (51): 12425–12431. Дои:10.1021 / ja973023v.
- ^ Кори, E.J .; Fuch, P.L. Tetrahedron Lett. 1972, 3769
- ^ Эймери и другие Синтез 2000, 185
- ^ Мишель; и другие. (1999). «Однореакторная процедура синтеза алкинов и бромалкинов из альдегидов». Tetrahedron Lett. 40 (49): 8575–8578. Дои:10.1016 / с0040-4039 (99) 01830-4.
- ^ Donkervoot; и другие. (1996). «Разработка модифицированных реакций Паусона-Ханда с этиленом и использование в полном синтезе (+) - тейлориона». Тетраэдр. 52 (21): 7391–7420. Дои:10.1016/0040-4020(96)00259-1.
- ^ Кори, E.J .; Ким, К. У. (1972). «Новый и высокоэффективный метод окисления первичных и вторичных спиртов до карбонильных соединений». JACS. 94 (21): 7586–7587. Дои:10.1021 / ja00776a056.
- ^ Куваджима; и другие. (2003). «Полный синтез ингенола». JACS. 125 (6): 1498–1500. Дои:10.1021 / ja029226n. PMID 12568608.
- ^ Кори, Э. Дж .; Уинтер, А. Э. (1963). «Новый стереоспецифический синтез олефинов из 1,2-диолов». JACS. 85 (17): 2677–2678. Дои:10.1021 / ja00900a043.
- ^ Блокировать; и другие. (1984). «Синтез олефинов дезоксигенацией вицинальных диолов». Органические реакции. Орг. Реагировать. 30. п. 457. Дои:10.1002 / 0471264180.or030.02. ISBN 978-0471264187.
- ^ Шинг; и другие. (1998). «Энантиоспецифический синтез (+) - Кротепоксида, (+) - Боэзеноксида, (+) - β-Сенепоксида, (+) - Ацетата пипоксида, (-) - изо-Кротепоксида, (-) - Сенепоксида и (-) - Тингтаноксид из (-) - хинной кислоты 1 ». J. Org. Chem. 63 (5): 1547–1554. Дои:10.1021 / jo970907o.
- ^ Наир; и другие. (2007). «Реакции внутримолекулярного 1,3-диполярного циклоприсоединения в целевых синтезах». Тетраэдр. 63 (50): 12247–12275. Дои:10.1016 / j.tet.2007.09.065.
- ^ Кори, Э. Дж .; и другие. (2004). "Энантиоселективные и структурно-селективные реакции Дильса-Альдера несимметричных хинонов, катализируемых хиральным оксазаборолидиниевым катионом. Правила предиктивного отбора". Варенье. Chem. Soc. 126 (15): 4800–4802. Дои:10.1021 / ja049323b. PMID 15080683.
- ^ Кори; и другие. (1994). «Демонстрация синтетической силы энантиоселективных реакций Дильса-Альдера, катализируемых оксазаборолидином, с помощью очень эффективных путей получения кассиола и гибберелловой кислоты». Варенье. Chem. Soc. 116 (8): 3611–3612. Дои:10.1021 / ja00087a062.
- ^ Кори; и другие. (1975). «Синтез новых макроциклических лактонов из ряда простагландиновых и полиэфирных антибиотиков». JACS. 97 (3): 653–654. Дои:10.1021 / ja00836a036. PMID 1133366.
- ^ Николау, К. С. (1977). «Синтез макролидов». Тетраэдр. 33 (7): 683–710. Дои:10.1016/0040-4020(77)80180-4.
- ^ Кори, Э. Дж .; Николау, К. С. (1974). «Эффективный и мягкий метод лактонизации для синтеза макролидов». JACS. 96 (17): 5614–5616. Дои:10.1021 / ja00824a073.
- ^ Кори, Э. Дж .; Чайковского (1962). «Метилид диметилсульфоксония». JACS. 84 (5): 867–868. Дои:10.1021 / ja00864a040.
- ^ Кори, Э. Дж .; Чайковского (1965). "Метилид диметилоксосульфония ((CH3)2СОЧ2) и метилид диметилсульфония ((CH3)2SCH2). Образование и применение в органическом синтезе ». JACS. 87 (6): 1353–1364. Дои:10.1021 / ja01084a034.
- ^ Данишефский; и другие. (1996). «Полный синтез баккатина III и таксола». JACS. 118 (12): 2843–2859. Дои:10.1021 / ja952692a.
- ^ См. Вкладку Syntheses"Собрание сочинений Элиаса Дж. Кори". ejcorey.org. 2008-07-12. Получено 2013-11-15.
- ^ Кори, Э. Дж .; Weinshenker, N.M .; Schaaf, T. K .; Хубер, В. (1969). «Стерео-контролируемый синтез dl-простагландинов F2.alpha. И E2». Варенье. Chem. Soc. 91 (20): 5675–5677. Дои:10.1021 / ja01048a062. PMID 5808505.
- ^ К. К. Николау, Э. Дж. Соренсен, Классика в полном синтезе, VCH, Нью-Йорк, 1996, ISBN 3-527-29231-4.
- ^ Кори, Э. Дж .; Schaaf, T. K .; Huber, W .; Koelliker, V .; Вайншенкер, Н. М. (1970). «Общий синтез простагландинов F2α и E2 как естественные формы ". Журнал Американского химического общества. 92 (2): 397–8. Дои:10.1021 / ja00705a609. PMID 5411057.
- ^ Для обзора см. Axen, U .; Pike, J. E .; и Schneider, W. P. (1973) стр. 81 дюйм Полный синтез натуральных продуктов, Vol. 1, ApSimon, J. W. (ed.) Wiley, New York.
- ^ Кори, Э. Дж .; Оно, М .; Ватакенчерри, П. А .; Митра, Р. Б. (1961). «ПОЛНЫЙ СИНТЕЗ d, l-ЛОНГИФОЛЕНА». Варенье. Chem. Soc. 83 (5): 1251–1253. Дои:10.1021 / ja01466a056.
- ^ Кори, Э. Дж .; Оно, М .; Mitra, R. B .; Ватакенчерри, П. А. (1964). «Полный синтез лонгифолена». Варенье. Chem. Soc. 86 (3): 478–485. Дои:10.1021 / ja01057a039.
- ^ Кори, Э. Дж .; Гош, А. К. (1988). «Полный синтез гинкголида А». Tetrahedron Lett. 29 (26): 3205–3206. Дои:10.1016/0040-4039(88)85122-0. ЧВК 6781876. PMID 31595095.
- ^ Кори, Э. Дж .; Канг, М .; Desai, M. C .; Ghosh, A.K .; Упис, И. Н. (1988). «Полный синтез (. + -.) - гинкголида B». Варенье. Chem. Soc. 110 (2): 649–651. Дои:10.1021 / ja00210a083. ЧВК 6746322. PMID 31527923.
- ^ Кори, Э. Дж. (1988). «Лекция Роберта Робинсона. Ретросинтетическое мышление: основы и примеры». Chem. Soc. Ред. 17: 111–133. Дои:10.1039 / cs9881700111.
- ^ Кори, Э. Дж .; Райхард, Г. А. (1992). «Полный синтез лактацистина». Варенье. Chem. Soc. 114 (26): 10677–10678. Дои:10.1021 / ja00052a096.
- ^ Кори, Э. Дж .; Ву, Л. И. (1993). «Энантиоселективный тотальный синтез мироэстрола». Варенье. Chem. Soc. 115 (20): 9327–9328. Дои:10.1021 / ja00073a074.
- ^ Кори, Э. Дж .; Gin, D. Y .; Кания, Р. С. (1996). «Энантиоселективный тотальный синтез эктеинасцидина 743». Варенье. Chem. Soc. 118 (38): 9202–9203. Дои:10.1021 / ja962480t.
- ^ Редди Лелети, Раджендер; Кори, Э. Дж. (2004). «Простой стереоконтролируемый синтез салиноспорамида А». Варенье. Chem. Soc. 126 (20): 6230–6232. CiteSeerX 10.1.1.472.2554. Дои:10.1021 / ja048613p. PMID 15149210.
- ^ См. Публикации в "Собрание сочинений Элиаса Дж. Кори". ejcorey.org. 2013-11-15. Получено 2013-11-15.
- ^ Баум, Руди (21 августа 2007). "Э.Дж. Кори: выдающийся химик". Интернет-журнал встречи C&EN, 234-е Национальное собрание и выставка ACS, 19–23 августа 2007 г., Бостон, Массачусетс. Получено 2010-09-08.
- ^ Ван Норден, Ричард (2007-04-23). «Индекс Хирша оценивает лучших химиков». RSC: Развитие химических наук, мира химии. Получено 2010-09-09.
- ^ а б Шнайдер, Элисон (1998). "Гарвард сталкивается с последствиями самоубийства аспиранта". Хроника высшего образования. Получено 2010-08-21.
- ^ а б Холл, Стивен С. (1998-11-29). «Смертельная химия в Гарварде». Нью-Йорк Таймс.
- ^ Холл, Стивен (29 декабря 1998 г.). «Смертельная химия в Гарварде». Газета "Нью-Йорк Таймс. Получено 26 сентября 2020.
- ^ а б Английский, Белла. «Самоубийства аспирантов вызывают большие изменения в химических лабораториях Гарварда». Архивировано 24 января 2001 года.. Получено 2010-11-24.CS1 maint: BOT: статус исходного URL-адреса неизвестен (ссылка на сайт), Бостонский глобус через Archive.org (02.01.2001).
- ^ «Для СМИ: примеры хороших и проблемных сообщений, козлы отпущения, журнал New York Times: смертельная химия в Гарварде». Американский фонд предотвращения самоубийств (AFSP). 2010. Архивировано с оригинал на 2006-09-25. Получено 2012-11-04.
- ^ AFSP неверно определяет автора и дату Нью-Йорк Таймс Статья представлена как Кейт Б. Ричбург и 28 ноября 1998 г. Автор - Стивен С. Холл, дата публикации - 29 ноября 1998 г.Н, Н; М.А. (2010). «Для СМИ: проблемное освещение, козлы отпущения». Американский фонд предотвращения самоубийств (AFSP). Архивировано из оригинал на 2006-09-25. Получено 2010-08-21.
- ^ Дисциплинированный разум Критический взгляд на наемных профессионалов и душевную систему, которая определяет их жизнь. Роуман и Литтлфилд Паблишерс, Инк. 2000.
- ^ См. Вкладку "Данные участников""Собрание сочинений Элиаса Дж. Кори". ). 2008-07-12. Получено 2013-11-15.
- ^ См. Вкладку Э. Дж. Кори, «Невозможные мечты».Кори, Э.Дж. (30 апреля 2004 г.). «Невозможные мечты». 69 (9). Перспектива JOC. стр. 2917–2919. Получено 2010-09-10.
- ^ Джонсон, Кэролайн Ю. (1 марта 2005 г.). "Чья это была идея?". Бостон Глобус. Архивировано из оригинал 11 января 2012 г.. Получено 2010-09-10.
- ^ Хоффман, Роальд (10 декабря 2004 г.). «Заявление о развитии электроциклических реакций на границе орбитального объяснения». Angewandte Chemie International Edition. 43 (48): 6586–6590. Дои:10.1002 / anie.200461440. PMID 15558636.
- ^ "Золотые медали Американской академии достижений". www.achievement.org. Американская академия достижений.
- ^ См. Статью E.J. Кори, Об Э.Дж. Кори, вкладка "Почетные ученые""Собрание сочинений Элиаса Дж. Кори". 2008-07-12. Получено 2013-11-15.
- ^ «Торжественная церемония открытия Института биомедицинских исследований имени Э.Дж. Кори (CIBR)». E.J. Кори Институт биомедицинских исследований. 2013-06-29. Архивировано из оригинал на 2015-06-20. Получено 2013-08-26.
внешняя ссылка
| Викискладе есть медиафайлы по теме E.J. Кори. |
| В Викицитатнике есть цитаты, связанные с: Элиас Джеймс Кори |

![[3,3] перегруппировка с PCC](http://upload.wikimedia.org/wikipedia/commons/thumb/8/87/PCC_rearrangement3.png/700px-PCC_rearrangement3.png)