WikiDer > Нейротрансмиссия - Википедия
Нейротрансмиссия (Латинский: трансмиссио "переход, переход" из передатчик "отправить, пропустить") - это процесс, с помощью которого сигнальные молекулы называются нейротрансмиттеры выпущены аксонный терминал из нейрон (пресинаптический нейрон), и связываются и реагируют с рецепторы на дендриты другого нейрона (постсинаптического нейрона) на небольшом расстоянии. Аналогичный процесс происходит в ретроградная нейротрансмиссия, где дендриты постсинаптического нейрона высвобождают ретроградные нейротрансмиттеры (например, эндоканнабиноиды; синтезируется в ответ на рост внутриклеточный кальций уровней), которые передают сигнал через рецепторы, расположенные на конце аксона пресинаптического нейрона, в основном на ГАМКергический и глутаматергический синапсы.[1][2][3][4]
Нейротрансмиссия регулируется несколькими различными факторами: доступностью и скоростью синтеза нейромедиатора, высвобождением этого нейротрансмиттера, базовой активностью постсинаптической клетки, количеством доступных постсинаптических рецепторов, с которыми нейротрансмиттер должен связываться, и последующими удаление или дезактивация нейротрансмиттера ферментами или пресинаптическим обратным захватом.[5][6]
В ответ на порог потенциал действия или же градуированный электрический потенциал, нейромедиатор высвобождается в пресинаптический Терминал. Освободившийся нейротрансмиттер затем может перемещаться по синапсу, чтобы быть обнаруженным и связываться с рецепторами в постсинаптическом нейроне. Связывание нейромедиаторов может влиять на постсинаптический нейрон в любом тормозящий или же возбуждающий путь. Связывание нейротрансмиттеров с рецепторами в постсинаптическом нейроне может запускать либо краткосрочные изменения, такие как изменения в мембранный потенциал называется постсинаптические потенциалы, или более долгосрочные изменения путем активации сигнальные каскады.
Нейроны образуют сложные биологические нейронные сети, через которые проходят нервные импульсы (потенциалы действия). Нейроны не касаются друг друга (кроме случая электрический синапс через щелевой переход); вместо этого нейроны взаимодействуют в точках тесного контакта, называемых синапсами. Нейрон передает свою информацию посредством потенциала действия. Когда нервный импульс достигает синапса, он может вызвать выброс нейротрансмиттеров, которые влияют на другой (постсинаптический) нейрон. Постсинаптический нейрон может получать сигналы от многих дополнительных нейронов, как возбуждающих, так и тормозных. Возбуждающие и тормозящие влияния суммируются, и если результирующий эффект является тормозящим, нейрон будет с меньшей вероятностью «срабатывать» (т. Е. Генерировать потенциал действия), а если результирующий эффект будет возбуждающим, нейрон будет с большей вероятностью Огонь. Насколько вероятно, что нейрон сработает, зависит от того, как далеко он мембранный потенциал из пороговый потенциал, напряжение, при котором срабатывает потенциал действия, поскольку достаточно зависимый от напряжения натриевые каналы активируются так, что чистый входящий натриевый ток превышает все выходящие токи.[7] Возбуждающие входы приближают нейрон к пороговому значению, в то время как тормозящие входные сигналы - дальше от порога. Потенциал действия - это событие «все или ничего»; нейроны, мембраны которых не достигли порога, не будут срабатывать, тогда как те, что достигли порога, должны срабатывать. Как только потенциал действия инициирован (традиционно в аксональный бугорок), он будет распространяться вдоль аксона, приводя к высвобождению нейромедиаторов в синаптический бутон чтобы передать информацию еще одному соседнему нейрону.
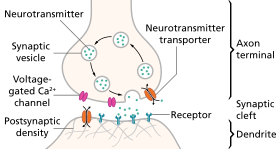
Этапы нейротрансмиссии в синапсе
- Синтез нейромедиатора. Это может происходить в Тело клетки, в аксоне или в аксонный терминал.
- Хранение нейротрансмиттера в гранулах или пузырьках в терминале аксона.
- Кальций входит в терминал аксона во время потенциала действия, вызывая релиз нейротрансмиттера в синаптическую щель.
- После своего высвобождения передатчик связывается и активирует рецептор в постсинаптической мембране.
- Деактивация нейротрансмиттера. Нейромедиатор либо разрушается ферментативно, либо попадает обратно в терминал, откуда он поступил, где он может быть повторно использован, либо разрушен и удален.[8]
Общее описание
Нейротрансмиттеры спонтанно упаковываются в везикулы и высвобождаются отдельными квантовыми пакетами независимо от пресинаптических потенциалов действия. Это медленное высвобождение поддается обнаружению и вызывает микроингибиторные или микровозбудительные эффекты на постсинаптический нейрон. Потенциал действия кратко усиливает этот процесс. Везикулы, содержащие нейротрансмиттер, группируются вокруг активных центров, и после того, как они высвобождаются, они могут быть повторно использованы с помощью одного из трех предложенных механизмов. Первый предложенный механизм включает частичное открытие, а затем повторное закрытие пузырька. Вторые два включают полное слияние везикулы с мембраной с последующей рециркуляцией или рециклингом в эндосому. Везикулярное слияние в значительной степени обусловлено концентрацией кальция в микродоменах, расположенных около кальциевых каналов, что позволяет высвобождать нейромедиатор всего за микросекунды, в то время как возвращение к нормальной концентрации кальция занимает пару сотен микросекунд. Считается, что экзоцитоз везикул управляется белковым комплексом, который называется SNARE, это цель для ботулинические токсины. После высвобождения нейротрансмиттер попадает в синапс и встречает рецепторы. Рецепторы нейротрансмиттеров могут быть ионотропными или связанными с g-белком. Ионотропные рецепторы позволяют ионам проходить через них при агонировании лигандом. Основная модель включает рецептор, состоящий из нескольких субъединиц, которые позволяют согласовывать предпочтение ионов. Связанные с G-белком рецепторы, также называемые метаботропными рецепторами, при связывании с лигандом претерпевают конформационные изменения, приводящие к внутриклеточному ответу. Прекращение активности нейротрансмиттера обычно осуществляется транспортером, однако ферментативная дезактивация также возможна.[9]
Суммирование
Каждый нейрон соединяется с множеством других нейронов, получая от них многочисленные импульсы. Суммирование представляет собой сложение этих импульсов на бугорке аксона. Если нейрон получает только возбуждающие импульсы, он генерирует потенциал действия. Если вместо этого нейрон получает столько же тормозных импульсов, сколько и возбуждающих, торможение нейтрализует возбуждение, и нервный импульс на этом останавливается.[10] Генерация потенциала действия пропорциональна вероятности и паттерну высвобождения нейромедиаторов, а также постсинаптической сенсибилизации рецепторов.[11][12][13]
Пространственное суммирование означает, что эффекты импульсов, полученных в разных местах нейрона, складываются, так что нейрон может активироваться, когда такие импульсы принимаются одновременно, даже если каждого импульса будет недостаточно, чтобы вызвать срабатывание.
Временное суммирование означает, что эффекты импульсов, полученных в одном и том же месте, могут складываться, если импульсы принимаются в близкой временной последовательности. Таким образом, нейрон может срабатывать при получении нескольких импульсов, даже если каждого импульса самого по себе недостаточно, чтобы вызвать срабатывание.[14]
Конвергенция и расхождение
Нейротрансмиссия подразумевает как конвергенцию, так и расхождение информации. Сначала на один нейрон влияют многие другие, что приводит к сходимости входных данных. Когда нейрон срабатывает, сигнал отправляется многим другим нейронам, что приводит к расхождению выходных сигналов. Этот нейрон влияет на многие другие нейроны.[нужна цитата]
Cotransmission
Cotransmission высвобождение нескольких типов нейротрансмиттеров из одного нервный терминал.
На нервном окончании нейротрансмиттеры присутствуют в покрытых мембраной пузырьках размером 35-50 нм, называемых синаптические везикулы. Для высвобождения нейротрансмиттеров синаптические везикулы временно стыкуются и сливаются в основании специализированных чашеобразных 10–15 нм. липопротеин структуры на пресинаптической мембране, называемые поросомы.[15] Нейрональная поросома протеом была решена, обеспечивая молекулярную архитектуру и полный состав оборудования.[16]
Недавние исследования множества систем показали, что большинство, если не все, нейроны испускают несколько различных химических посредников.[17] Котрансмиссия позволяет получить более сложные эффекты при постсинаптические рецепторы, и, таким образом, обеспечивает более сложную коммуникацию между нейронами.
В современной нейробиологии нейроны часто классифицируют по их котрансмиттеру. Например, "ГАМКергические нейроны" полосатого тела используют опиоидные пептиды или же вещество P как их первичный котрансмиттер.
Некоторые нейроны могут выделять по крайней мере два нейромедиатора одновременно, а другой является котрансмиттером, чтобы обеспечить стабилизирующую отрицательную обратную связь, необходимую для значимого кодирования, в отсутствие тормозящего интернейроны.[18] Примеры включают:
- ГАМК–глицин совместный выпуск.
- Дофамин–глутамат совместный выпуск.
- Ацетилхолин (Ach) - совместное высвобождение глутамата.
- АЧ–вазоактивный кишечный пептид (VIP) совместный выпуск.
- АЧ–пептид, связанный с геном кальцитонина (CGRP) совместный выпуск.
- Глутамат–динорфин совместный выпуск (в гиппокамп).
Норадреналин и АТФ находятся сочувствующий сопутствующие передатчики. Установлено, что эндоканнабиноид анадамид и каннабиноид, ВЫИГРАТЬ 55,212-, 2 может изменять общий ответ на стимуляцию симпатического нерва и указывать на то, что CB1 рецепторы посредничать симпато- тормозящее действие. Таким образом, каннабиноиды могут подавлять как норадренергические, так и пуринергический компоненты симпатической нейротрансмиссии.[19]
Одной из необычных пар ко-трансмиттеров является ГАМК и глутамат, которые высвобождаются из одних и тех же окончаний аксонов нейронов, происходящих из вентральная тегментальная область (VTA), внутренний бледный шар, и супраммиллярное ядро.[20] Первые два проекта в хабенула тогда как известно, что проекции супраммиллярного ядра нацелены на зубчатые извилины гиппокампа.[20]
Генетическая ассоциация
Нейротрансмиссия генетически связана с другими характеристиками или особенностями. Например, анализ обогащения различных сигнальных путей привели к открытию генетической ассоциации с внутричерепным объемом.[21]
Смотрите также
- Авторецептор
- Модель биологического нейрона § Синаптическая передача
- Электрофизиология
- Рецептор, связанный с G-белком
- Молекулярная нейрофармакология
- Нервно-мышечная передача
- Нейропсихофармакология
Рекомендации
- ^ Мелис М., Пистис М. (декабрь 2007 г.). "Эндоканнабиноидная передача сигналов в дофаминовых нейронах среднего мозга: больше, чем физиология?". Современная нейрофармакология. 5 (4): 268–77. Дои:10.2174/157015907782793612. ЧВК 2644494. PMID 19305743.
Таким образом, возможно, что низкие уровни рецепторов CB1 локализуются на глутаматергических и ГАМКергических окончаниях, воздействующих на DA нейроны [127, 214], где они могут точно настраивать высвобождение тормозного и возбуждающего нейромедиатора и регулировать активацию DA нейронов.
Соответственно, электрофизиологические эксперименты in vitro, проведенные независимыми лабораториями, предоставили доказательства локализации рецептора CB1 на глутаматергических и ГАМКергических окончаниях аксонов в VTA и SNc. - ^ Флорес А., Мальдонадо Р., Беррендеро Ф. (декабрь 2013 г.). «Перекрестный разговор между каннабиноидом и гипокретином в центральной нервной системе: что мы знаем до сих пор». Границы неврологии. 7: 256. Дои:10.3389 / fnins.2013.00256. ЧВК 3868890. PMID 24391536.
Прямое взаимодействие CB1-HcrtR1 было впервые предложено в 2003 г. (Hilairet et al., 2003). Действительно, 100-кратное увеличение активности гипокретина-1 для активации передачи сигналов ERK наблюдалось, когда CB1 и HcrtR1 были совместно экспрессированы ... В этом исследовании более высокая эффективность гипокретина-1 в регулировании гетеромера CB1-HcrtR1 по сравнению с с гомомером HcrtR1-HcrtR1 (Ward et al., 2011b). Эти данные позволяют однозначно идентифицировать гетеромеризацию CB1-HcrtR1, которая оказывает существенное функциональное влияние. ... Существование перекрестной связи между гипокретинергической и эндоканнабиноидной системами убедительно подтверждается их частично перекрывающимся анатомическим распределением и общей ролью в нескольких физиологических и патологических процессах. Однако мало что известно о механизмах, лежащих в основе этого взаимодействия. ... Действуя как ретроградный мессенджер, эндоканнабиноиды модулируют глутаматергические возбуждающие и ГАМКергические ингибирующие синаптические входы в дофаминергические нейроны VTA и передачу глутамата в NAc. Таким образом, активация рецепторов CB1, присутствующих на окончаниях аксонов ГАМКергических нейронов в VTA, ингибирует передачу ГАМК, устраняя этот ингибирующий вход на дофаминергические нейроны (Riegel and Lupica, 2004). Синаптическая передача глутамата в VTA и NAc, в основном от нейронов PFC, аналогичным образом модулируется активацией рецепторов CB1 (Melis et al., 2004).
• Рисунок 1: Схема экспрессии CB1 мозга и орексинергических нейронов, экспрессирующих OX1 (HcrtR1) или OX2 (HcrtR2)
• Рисунок 2: Синаптические сигнальные механизмы в каннабиноидных и орексиновых системах.
• Рисунок 3: Схема мозговых путей, участвующих в приеме пищи. - ^ Фройнд Т.Ф., Катона I, Пиомелли Д. (июль 2003 г.). «Роль эндогенных каннабиноидов в синаптической передаче сигналов». Физиологические обзоры. 83 (3): 1017–66. Дои:10.1152 / Physrev.00004.2003. PMID 12843414.
- ^ Аяканну, Тангесверан; Тейлор, Энтони Х .; Marczylo, Timothy H .; Виллетс, Джонатон М .; Конье, Джастин С. (2013). «Эндоканнабиноидная система и рак, зависимый от половых стероидных гормонов». Международный журнал эндокринологии. 2013: 259676. Дои:10.1155/2013/259676. ISSN 1687-8337. ЧВК 3863507. PMID 24369462.
- ^ Нагацу, Т. (декабрь 2000 г.). «[Молекулярные механизмы нейротрансмиссии]». Риншо Синкэйгаку = Клиническая неврология. 40 (12): 1185–1188. ISSN 0009-918X. PMID 11464453.
- ^ Andreae, Laura C .; Бурроне, Хуан (март 2018 г.). «Роль спонтанной нейротрансмиссии в развитии синапсов и цепей». Журнал неврологических исследований. 96 (3): 354–359. Дои:10.1002 / jnr.24154. ISSN 0360-4012. ЧВК 5813191. PMID 29034487.
- ^ Холден А., Уинлоу В. (1984). Нейробиология боли: симпозиум Северной группы нейробиологов, состоявшийся в Лидсе 18 апреля 1983 г. (1-е изд.). Manchester Univ Pr. п. 111. ISBN 978-0719010613.
- ^ Колб Б., Уишоу IQ (2003). Основы нейропсихологии человека (5-е изд.). Стоит. С. 102–104. ISBN 978-0-7167-5300-1. (ссылка для всех пяти этапов)
- ^ Сквайр Л., Берг Д., Блум Ф. Э., дю Лак С., Гош А., Спитцер, Северная Каролина (2013). Фундаментальная нейробиология (4-е изд.). Амстердам: Elsevier / Academic Press. С. 133–181. ISBN 978-0-12-385870-2.
- ^ Уильямс С.М., Макнамара Дж.О., Ламантия А., Кац Л.С., Фицпатрик Д., Августин Г.Дж., Первес Д. (2001). Purves D, Augustine GJ, Fitzpatrick D и др. (ред.). Суммирование синаптических потенциалов. Неврология (2-е изд.). Сандерленд (Массачусетс): Sinauer Associates.
- ^ Ван Дж. Х, Вэй Дж, Чен Х, Ю Дж, Чен Н, Ши Дж (сентябрь 2008 г.). «Усиление и точность моделей передачи в корковых возбуждающих унитарных синапсах улучшают кодирование спайков». Журнал клеточной науки. 121 (Pt 17): 2951–60. Дои:10.1242 / jcs.025684. PMID 18697836.
- ^ Ю Дж, Цянь Х, Чен Н, Ван ДжХ (2011). «Квантовое высвобождение глутамата необходимо для надежного кодирования нейронов в церебральных сетях». PLOS ONE. 6 (9): e25219. Bibcode:2011PLoSO ... 625219Y. Дои:10.1371 / journal.pone.0025219. ЧВК 3176814. PMID 21949885.
- ^ Ю Дж, Цянь Х, Ван Дж Х (август 2012 г.). «Повышение вероятности высвобождения передатчика улучшает преобразование синаптических аналоговых сигналов в нейронные цифровые импульсы». Молекулярный мозг. 5 (26): 26. Дои:10.1186/1756-6606-5-26. ЧВК 3497613. PMID 22852823.
- ^ Хеверн VW. "PSY 340: мозг и поведение". Архивировано из оригинал 19 февраля 2006 г.
- ^ Андерсон Л.Л. (2006). «Открытие« поросомы »- универсального секреторного механизма в клетках». Журнал клеточной и молекулярной медицины. 10 (1): 126–31. Дои:10.1111 / j.1582-4934.2006.tb00294.x. ЧВК 3933105. PMID 16563225.
- ^ Ли Дж.С., Джеремич А., Шин Л., Чо В.Дж., Чен Х, Джена Б.П. (июль 2012 г.). «Протеом нейрональных поросом: молекулярная динамика и архитектура». Журнал протеомики. 75 (13): 3952–62. Дои:10.1016 / j.jprot.2012.05.017. ЧВК 4580231. PMID 22659300.
- ^ Трюдо Л. Е., Гутьеррес Р. (июнь 2007 г.). «О котрансмиссии и пластичности фенотипа нейромедиаторов». Молекулярные вмешательства. 7 (3): 138–46. Дои:10.1124 / mi 7.3.5. PMID 17609520.
- ^ Томас Э.А., Борнштейн JC (2003). «Тормозящие потенциалы котрансмиссии или постгиперполяризации могут регулировать возбуждение в повторяющихся сетях с возбуждающей метаботропной передачей». Неврология. 120 (2): 333–51. Дои:10.1016 / S0306-4522 (03) 00039-3. PMID 12890506. S2CID 26851745.
- ^ Пакдихот П., Данн В. Р., Ралевич В. (ноябрь 2007 г.). «Каннабиноиды подавляют норадренергическую и пуринергическую симпатическую котрансмиссию в изолированном брыжеечном артериальном русле крыс». Британский журнал фармакологии. 152 (5): 725–33. Дои:10.1038 / sj.bjp.0707397. ЧВК 2190027. PMID 17641668.
- ^ а б Dh, корень; S, Чжан; Dj, Баркер; Джей, Миранда-Барриентос; Б, Лю; Hl, Wang; М, Моралес (19.06.2018). «Избирательное распределение мозга и отличительная синаптическая архитектура двойных глутаматергических-ГАМКергических нейронов». Отчеты по ячейкам. 23 (12): 3465–3479. Дои:10.1016 / j.celrep.2018.05.063. ЧВК 7534802. PMID 29924991.
- ^ Adams HH, Hibar DP, Chouraki V, Stein JL, Nyquist PA, Rentería ME, et al. (Декабрь 2016 г.). «Новые генетические локусы, лежащие в основе внутричерепного объема человека, идентифицированные через общегеномную ассоциацию». Природа Неврология. 19 (12): 1569–1582. Дои:10.1038 / №4398. ЧВК 5227112. PMID 27694991.