WikiDer > Правило Оддо – Харкинса
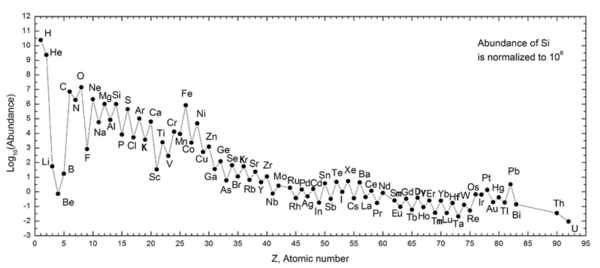
В Правило Оддо – Харкинса считает, что элемент с четным атомным номером (например, углерод: элемент 6) более распространен, чем оба элемента с соседними большими и меньшими нечетными атомными номерами (например, бор: элемент 5 и азот: элемент 7 соответственно для углерод). Об этой тенденции обилия химических элементов впервые сообщил Джузеппе Оддо[1] в 1914 г. и Уильям Дрейпер Харкинс[2] в 1917 г.[3]
Определение
Все атомы больше чем водород образуются в звездах или сверхновых через нуклеосинтез, когда сила тяжести, температура и давление достигнуть уровней достаточно высоких протоны и нейтроны все вместе. Протоны и нейтроны образуют атомное ядро, который накапливает электроны образовывать атомы. Число протонов в ядре, называемое атомным номером, однозначно определяет химический элемент.
Правило Оддо-Харкинса утверждает, что элементы с нечетными атомными номерами имеют один неспаренный протон и с большей вероятностью захватят другой, таким образом увеличивая их атомный номер. Возможно, что в элементах с четными атомными номерами протоны являются парными, причем каждый член пары уравновешивает вращение другого; четный паритет таким образом увеличивает стабильность нуклонов.
Исключения из правила
Однако этот постулат не распространяется на вселенная самый распространенный и самый простой элемент периодической таблицы элементов: водородс атомным номером 1. Это может быть связано с тем, что в своей ионизированной форме атом водорода превращается в отдельный протон, который, согласно теории, был одним из первых крупных конгломератов кварки в течение первой секунды Период инфляции Вселенной, следуя Большой взрыв. В этот период, когда инфляция Вселенной довела ее от бесконечно малой точки до размеров современной галактики, температура в супе из частиц упала с более чем триллиона градусов до нескольких миллионов градусов.
Этот период позволил слияние одиночных протонов и дейтерий ядра образовывать гелий и литий ядер, но было слишком коротким для каждого H+ ион для восстановления в более тяжелые элементы. В этом случае гелий с атомным номером 2 остается четным аналогом водорода. Таким образом, нейтральный водород или водород в паре с электрон, единственная стабильная лептон- составляли подавляющее большинство оставшихся неаннигилированный порции вещества после завершения инфляции.
Еще одно исключение из правила - бериллий, который даже с четным атомным номером (4) встречается реже, чем элементы с нечетным числом по обе стороны от него (литий и бор). Это потому, что большая часть лития, бериллия и бора во Вселенной производится расщепление космических лучей, не обычный звездный нуклеосинтез, а бериллий имеет только один стабильный изотоп, что приводит к его значительному отставанию от своих соседей, которые оба имеют два стабильных изотопа.
Связь с фьюжн
Такая картина возникает после того, как происходит неконтролируемый синтез в умирающей массивной звезде, в которой заданная масса различных элементов с четными и нечетными номерами образована немного большей массой элементов водорода и гелия. Вновь сформированные элементы выбрасываются в результате взрыва и в конечном итоге присоединяются к остальной части галактики. межзвездная среда.
Когда слияние происходит с все более и более крупными ядрами, подвод энергии становится все больше, а выход энергии становится все меньше; точка, в которой эти два потенциала встречаются в периодической таблице элементов, находится где-то около элементов утюг, атомный номер 26 и никель, атомный номер 28. При синтезе более тяжелых элементов энергия не выделяется, поэтому вероятность обнаружения расхождений в правиле Оддо – Харкинса становится ниже.
Смотрите также
- Атомный номер
- Водород
- Космическая инфляция
- Список элементов по стабильности изотопов
- Термоядерная реакция
- Ядерная химия
использованная литература
- ^ Оддо, Джузеппе (1914). "Die Molekularstruktur der radioaktiven Atome". Zeitschrift für Anorganische Chemie. 87: 253–268. Дои:10.1002 / zaac.19140870118.
- ^ Харкинс, Уильям Д. (1917). «Эволюция элементов и устойчивость сложных атомов». Журнал Американского химического общества. 39 (5): 856–879. Дои:10.1021 / ja02250a002.
- ^ Север, Джон (2008). Космос иллюстрированная история астрономии и космологии (Перем. И обновл. Ред.). Univ. Чикаго Пресс. п. 602. ISBN 978-0-226-59441-5.