WikiDer > RAD52
Гомолог RAD52 (S. cerevisiae), также известен как RAD52, это белок который у человека кодируется RAD52 ген.[5][6]
Функция
Белок, кодируемый этим геном, имеет сходство с Saccharomyces cerevisiae Rad52, а белок важно для ДНК восстановление двухниточного разрыва и гомологичная рекомбинация. Было показано, что этот генный продукт связывает концы одноцепочечной ДНК и опосредует взаимодействие ДНК-ДНК, необходимое для отжига дополнительный Нити ДНК. Также было обнаружено, что он взаимодействует с белком рекомбинации ДНК. RAD51, что предполагает его роль в рекомбинации и репарации ДНК, связанной с RAD51.[6]
Роль в репарации рекомбинации ДНК
RAD52 выступает посредником RAD51 функционировать в гомологичный рекомбинационный ремонт (HRR) в обоих дрожжах Saccharomyces cerevisiae и в клетках млекопитающих мышей и людей. Однако белок RAD52 выполняет совершенно разные функции в HRR дрожжей и человека. В S. cerevisae, Белок Rad52, действуя сам по себе, облегчает загрузку белка Rad51 на одноцепочечную ДНК, предварительно покрытую репликационный белок А в пресинаптический фаза рекомбинации.[7][8]
Однако у мышей и людей BRCA2 в первую очередь опосредует упорядоченную сборку RAD51 на оцДНК, форме, которая активна для гомологичного спаривания и инвазии цепи.[9] BRCA2 также перенаправляет RAD51 от дцДНК и предотвращает диссоциацию от оцДНК.[9] Кроме того, четыре паралоги из RAD51, состоящий из РАД51Б (RAD51L1), RAD51C (RAD51L2), RAD51D (RAD51L3), XRCC2 образуют комплекс, называемый комплексом BCDX2. Этот комплекс участвует в наборе или стабилизации RAD51 в местах повреждения.[10] Комплекс BCDX2, по-видимому, действует, облегчая сборку или стабильность Нуклеопротеиновая нить RAD51. Однако в присутствии мутации BRCA2 человеческий RAD52 может опосредовать сборку RAD51 на оцДНК и заменять BRCA2 в гомологичный рекомбинационный Ремонт ДНК,[11] хотя и с меньшей эффективностью, чем BRCA2.
Кроме того, человеческий RAD52 в сочетании с ERCC1, способствует подверженному ошибкам пути гомологичной репарации ДНК одноцепочечного отжига.[12] Хотя этот способ восстановления подвержен ошибкам, он может быть необходим для выживания клеток с повреждением ДНК, которое иначе не исправить.
RAD52 человека также играет важную роль в репарации двухцепочечных разрывов ДНК в активных сайтах транскрипции во время фазы G0 / G1 клеточного цикла. Восстановление этих двухцепочечных разрывов, по-видимому, использует механизм рекомбинации на основе матрицы РНК, зависящий от RAD52.[13] Белок синдрома Кокейна B (CSB) (кодируется ERCC6) локализуется на двухцепочечных разрывах в сайтах активной транскрипции, за которыми следует RAD51, RAD51C и RAD52 для выполнения гомологичный рекомбинационный ремонт с использованием вновь синтезированной РНК в качестве матрицы.[13]
микроРНК и риск рака
Три основных непереведенных региона (3'UTRs) из информационные РНК (мРНК) часто содержат регуляторные последовательности, которые могут вызывать посттранскрипционные Подавление РНК. Такие 3'-UTR часто содержат сайты связывания для микроРНК (миРНК). Связываясь со специфическими сайтами в 3'-UTR, miRNA могут снижать экспрессию генов различных мРНК путем ингибирования перевод или непосредственно вызывая ухудшение транскрипции.
МикроРНК (miRNA), по-видимому, регулируют экспрессию более 60% гены, кодирующие белок генома человека.[14] Одна микроРНК, miR-210, подавляет RAD52.[15] Как отмечено Devlin et al., MiR-210 активируется в большинстве солидных опухолей и отрицательно влияет на клинический результат.[16]
3'-UTR RAD52 также имеет сайт связывания для микроРНК. let-7. Женщины с однонуклеотидный полиморфизм (SNP) в сайте связывания let-7 (rs7963551), который вызывает снижение связывания let-7, вероятно, имеет повышенную экспрессию RAD52 (как было показано для этого SNP в печени[17]). Женщины с этим SNP в 3'UTR RAD52 показали снижение риска рака груди с отношением шансов 0,84, 95% доверительным интервалом 0,75–0,95.[18]
В популяции ханьских китайцев тот же SNP, что и выше, в 3'-UTR сайта связывания RAD52 для let-7 (rs7963551) снижает риск глиомы. Риск глиомы, связанный с генотипом RAD52 rs7963551, имел отношение шансов (по сравнению с теми, у кого нет SNP) 0,44 для людей старше 41 года и отношение шансов 0,58 для тех, кто 41 год или моложе.[19]
Ли и др.[17] обнаружили значительно сниженный риск клеточной карциномы печени среди людей с генотипом RAD52 rs7963551 CC (тот же SNP, что и выше) по сравнению с людьми с генотипом AA в китайской популяции. Они также обнаружили, что в 44 образцах нормальной ткани печени человека присутствие SNP rs7963551 было связано со значительным увеличением экспрессии мРНК RAD52.
Таким образом, повышенная экспрессия RAD52 защищает от различных видов рака.
Другое исследование измененных сайтов связывания микроРНК в RAD52 и их влияния на предрасположенность к раку было проведено Naccarati et al.[20] Они обнаружили два сайта связывания микроРНК RAD52, которые часто менялись и влияли на риск рака толстой кишки. Лица с гомозиготным или гетерозиготным SNP в rs1051669 имели повышенный риск рака толстой кишки (OR 1,78, 95% CI 1,13–2,80, p = 0,01 для гомозигот и OR 1,72, 95% CI 1,10–2,692, p = 0,02 для гетерозигот). Гетерозиготные носители другого SNP RAD52 (rs11571475) имели пониженный риск рака толстой кишки (OR 0,76, 95% ДИ 0,58–1,00, p = 0,05). Из 21 гена в гомологичный рекомбинационный путь репарации и 7 генов в негомологичное соединение концов Изученного пути, единственными SNP, обнаруженными в областях связывания микроРНК, которые имеют достаточно высокую частоту для оценки и которые влияют на риск рака толстой кишки, были два в RAD52 и один в MRE11A.
Повреждение ДНК, по-видимому, является основной причиной рака,[21] а недостаточность репарации ДНК, по-видимому, лежит в основе многих форм рака.[22] Если репарация ДНК недостаточна, повреждения ДНК имеют тенденцию к накоплению. Такое избыточное повреждение ДНК может увеличить мутационный ошибки во время Репликация ДНК из-за подверженности ошибкам транслезионный синтез. Избыточное повреждение ДНК также может увеличиваться эпигенетический изменения из-за ошибок во время ремонта ДНК.[23][24] Такие мутации и эпигенетические изменения могут вызывать рак. Частое индуцированное микроРНК увеличение или дефицит RAD52Опосредованная репарация ДНК из-за изменений связывания микроРНК, вероятно, способствует предотвращению или прогрессированию рака груди, мозга, печени или толстой кишки.
Взаимодействия
RAD52 был показан взаимодействовать с RAD51.[25] Rad52 облегчит загрузку Rad51 на оцДНК, вмешиваясь в RPA белок.
Внутригенное дополнение
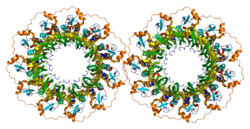
Когда несколько копий полипептида, кодируемого ген образуют агрегат, эта белковая структура называется мультимером. Когда мультимер образуется из полипептидов, продуцируемых двумя разными мутант аллели конкретного гена смешанный мультимер может проявлять большую функциональную активность, чем несмешанные мультимеры, образованные каждым из мутантов по отдельности. В таком случае явление упоминается как внутригенная комплементация. А Saccharomyces cerevisiae RAD52 Было обнаружено, что мутантный аллель, экспрессирующий усеченный на С-конце белок, дополняет другие RAD52 мутант промах аллели.[26] Это открытие внутригенная комплементация предполагает, что белок RAD52 имеет мультимерную структуру, которая допускает кооперативные взаимодействия между составляющими мономерами.
использованная литература
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000002016 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000030166 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Шен З, Денисон К., Лобб Р., Гейтвуд Дж. М., Чен Д. Д. (январь 1995 г.). «Человеческие и мышиные гомологи дрожжевого гена RAD52: клонирование кДНК, анализ последовательности, отнесение к хромосоме человека 12p12.2-p13 и экспрессия мРНК в тканях мыши». Геномика. 25 (1): 199–206. Дои:10.1016/0888-7543(95)80126-7. PMID 7774919.
- ^ а б «Ген Entrez: RAD52 гомолог RAD52 (S. cerevisiae)».
- ^ Синохара А., Огава Т. (1998). «Стимуляция Rad52 дрожжевой Rad51-опосредованной рекомбинации». Природа. 391 (6665): 404–7. Дои:10.1038/34943. PMID 9450759. S2CID 4304549.
- ^ Новый JH, Сугияма Т., Зайцева Э., Ковальчиковски С.К. (1998). «Белок Rad52 стимулирует обмен цепи ДНК с помощью Rad51 и репликационного белка A». Природа. 391 (6665): 407–10. Дои:10.1038/34950. PMID 9450760. S2CID 4408959.
- ^ а б Холломан В.К. (2011). «Раскрытие механизма BRCA2 в гомологичной рекомбинации». Nat. Struct. Мол. Биол. 18 (7): 748–54. Дои:10.1038 / nsmb.2096. ЧВК 3647347. PMID 21731065.
- ^ Чун Дж, Бюхельмайер Э.С., Пауэлл С.Н. (2013). «Комплексы Rad51 паралогов BCDX2 и CX3 действуют на разных стадиях пути BRCA1-BRCA2-зависимой гомологичной рекомбинации». Мол. Cell. Биол. 33 (2): 387–95. Дои:10.1128 / MCB.00465-12. ЧВК 3554112. PMID 23149936.
- ^ Фэн З., Скотт С.П., Буссен В., Шарма Г.Г., Го Дж., Пандита Т.К., Пауэлл С.Н. (2011). «Инактивация Rad52 является синтетически смертельной из-за дефицита BRCA2». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 108 (2): 686–91. Дои:10.1073 / pnas.1010959107. ЧВК 3021033. PMID 21148102.
- ^ Старк Дж. М., Пирс А. Дж., О Дж, Пастинк А., Джасин М. (2004). «Генетические этапы гомологичной репарации млекопитающих с определенными мутагенными последствиями». Мол. Cell. Биол. 24 (21): 9305–16. Дои:10.1128 / MCB.24.21.9305-9316.2004. ЧВК 522275. PMID 15485900.
- ^ а б Вэй Л., Накадзима С., Бем С., Бернштейн К.А., Шен З., Цанг М., Левин А.С., Лан Л. (2015). «Повреждение ДНК во время фазы G0 / G1 запускает РНК-шаблонную B-зависимую гомологичную рекомбинацию с синдромом Кокейна». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 112 (27): E3495–504. Дои:10.1073 / pnas.1507105112. ЧВК 4500203. PMID 26100862.
- ^ Фридман Р.К., Фарх К.К., Бурдж CB, Бартель Д.П. (2009). «Большинство мРНК млекопитающих являются консервативными мишенями для микроРНК». Genome Res. 19 (1): 92–105. Дои:10.1101 / гр.082701.108. ЧВК 2612969. PMID 18955434.
- ^ Кросби М.Э., Кульшрешта Р., Иван М., Глейзер П.М. (2009). «Регуляция микроРНК экспрессии генов репарации ДНК при гипоксическом стрессе». Рак Res. 69 (3): 1221–9. Дои:10.1158 / 0008-5472.CAN-08-2516. ЧВК 2997438. PMID 19141645.
- ^ Девлин С, Греко С, Мартелли Ф, Иван М (2011). «miR-210: больше, чем молчаливый игрок в условиях гипоксии». IUBMB Life. 63 (2): 94–100. Дои:10.1002 / iub.427. ЧВК 4497508. PMID 21360638.
- ^ а б Ли З, Го И, Чжоу Л., Гэ И, Вэй Л., Ли Л., Чжоу Ц, Вэй Дж, Юань Ц., Ли Дж, Ян М. (2015). «Ассоциация функционального генетического варианта RAD52, локализующегося в сайте связывания miRNA, с риском гепатоцеллюлярной карциномы, связанной с HBV». Мол. Канцероген. 54 (9): 853–8. Дои:10.1002 / mc.22156. PMID 24729511. S2CID 25174260.
- ^ Цзян И, Цинь З, Ху З, Гуань Икс, Ван И, Хе И, Сюэ Дж, Лю Х, Чен Дж, Дай Дж, Джин Дж, Ма Х, Ван С., Шен Х (2013). «Генетическая изменчивость сайта связывания hsa-let-7 в RAD52 связана с предрасположенностью к раку груди». Канцерогенез. 34 (3): 689–93. Дои:10.1093 / carcin / bgs373. PMID 23188672.
- ^ Лю Ц., Чен Ю.Д., Хань С., Вей Дж., Гэ И, Пан В., Цзян Т., Цю XG, Ян М. (2014). «Генетический вариант RAD52, расположенный в сайте связывания miRNA, связан с риском глиомы у китайцев хань». J. Neurooncol. 120 (1): 11–7. Дои:10.1007 / s11060-014-1527-х. PMID 25012956. S2CID 1082923.
- ^ Naccarati A, Rosa F, Выметалкова V, Barone E, Jiraskova K, Di Gaetano C, Novotny J, Levy M, Vodickova L, Gemignani F, Buchler T, Landi S, Vodicka P, Pardini B (2015). «Восстановление двухцепочечных разрывов и колоректальный рак: варианты генов в пределах 3 'UTR и связывание микроРНК как модуляторы риска рака и клинического исхода». Oncotarget. 7 (17): 23156–69. Дои:10.18632 / oncotarget.6804. ЧВК 5029617. PMID 26735576.
- ^ Кастан МБ (2008). «Реакция на повреждение ДНК: механизмы и роль в человеческих заболеваниях: лекция 2007 г. на присуждении премии имени Г.А. Клоуса». Мол. Рак Res. 6 (4): 517–24. Дои:10.1158 / 1541-7786.MCR-08-0020. PMID 18403632.
- ^ Харпер Дж. У., Элледж С. Дж. (2007). «Реакция на повреждение ДНК: десять лет спустя». Мол. Ячейка. 28 (5): 739–45. Дои:10.1016 / j.molcel.2007.11.015. PMID 18082599.
- ^ О'Хаган Х.М., Мохаммад Х.П., Бейлин С.Б. (2008). «Двухцепочечные разрывы могут инициировать сайленсинг генов и SIRT1-зависимое начало метилирования ДНК в экзогенном промоторном острове CpG». PLOS Genetics. 4 (8): e1000155. Дои:10.1371 / journal.pgen.1000155. ЧВК 2491723. PMID 18704159.
- ^ Cuozzo C, Porcellini A, Angrisano T, Morano A, Lee B, Di Pardo A, Messina S, Iuliano R, Fusco A, Santillo MR, Muller MT, Chiariotti L, Gottesman ME, Avvedimento EV (июль 2007 г.). «Повреждение ДНК, гомологически направленная репарация и метилирование ДНК». PLOS Genetics. 3 (7): e110. Дои:10.1371 / journal.pgen.0030110. ЧВК 1913100. PMID 17616978.
- ^ Чен Г., Юань С.С., Лю В., Сюй И, Трухильо К., Сонг Б., Конг Ф, Гофф С.П., Ву И., Арлингхаус Р., Балтимор Д., Гассер П.Дж., Пак М.С., Сун П., Ли Е.Ю. (апрель 1999 г.). «Радиационно-индуцированная сборка рекомбинационного комплекса Rad51 и Rad52 требует ATM и c-Abl» (PDF). Журнал биологической химии. 274 (18): 12748–52. Дои:10.1074 / jbc.274.18.12748. PMID 10212258. S2CID 2587580.
- ^ Boundy-Mills KL, Ливингстон DM. Аллель RAD52 Saccharomyces cerevisiae, экспрессирующий C-концевой усеченный белок: активность и внутригенная комплементация миссенс-мутаций. Генетика. 1993; 133 (1): 39-49.
дальнейшее чтение
- Мурис Д.Ф., Беззубова О., Бюрстедде Дж. М., Врекен К., Баладжи А.С., Осгуд С.Дж., Трэлстра С., Хоймейкерс Дж. Х., Остерманн К., Шмидт Х. (ноябрь 1994 г.). «Клонирование генов человека и мыши, гомологичных RAD52, дрожжевому гену, участвующему в репарации и рекомбинации ДНК». Мутационные исследования. 315 (3): 295–305. Дои:10.1016 / 0921-8777 (94) 90040-х. HDL:1765/3072. PMID 7526206.
- Шен З, Денисон К., Лобб Р., Гейтвуд Дж. М., Чен Д. Д. (январь 1995 г.). «Человеческие и мышиные гомологи дрожжевого гена RAD52: клонирование кДНК, анализ последовательности, отнесение к хромосоме 12p12.2-p13 человека и экспрессия мРНК в тканях мыши». Геномика. 25 (1): 199–206. Дои:10.1016/0888-7543(95)80126-7. PMID 7774919.
- Park MS (июнь 1995 г.). «Экспрессия человеческого RAD52 придает устойчивость к ионизирующему излучению в клетках млекопитающих». Журнал биологической химии. 270 (26): 15467–70. Дои:10.1074 / jbc.270.26.15467. PMID 7797537.
- Shen Z, Pardington-Purtymun PE, Comeaux JC, Moyzis RK, Chen DJ (сентябрь 1996 г.). «UBL1, убиквитиноподобный белок человека, связанный с белками RAD51 / RAD52 человека». Геномика. 36 (2): 271–9. Дои:10.1006 / geno.1996.0462. PMID 8812453.
- Шен З, Pardington-Purtymun PE, Comeaux JC, Moyzis RK, Chen DJ (октябрь 1996 г.). «Ассоциации UBE2I с белками RAD52, UBL1, p53 и RAD51 в дрожжевой двугибридной системе». Геномика. 37 (2): 183–6. Дои:10.1006 / geno.1996.0540. PMID 8921390.
- Чен Г., Юань С.С., Лю В., Сюй И, Трухильо К., Сонг Б., Конг Ф, Гофф С.П., Ву И., Арлингхаус Р., Балтимор Д., Гассер П.Дж., Пак М.С., Сун П., Ли Е.Ю. (апрель 1999 г.). «Радиационно-индуцированная сборка рекомбинационного комплекса Rad51 и Rad52 требует ATM и c-Abl» (PDF). Журнал биологической химии. 274 (18): 12748–52. Дои:10.1074 / jbc.274.18.12748. PMID 10212258. S2CID 2587580.
- Кито К., Вада Х., Йе Э. Т., Камитани Т. (декабрь 1999 г.). «Идентификация новых изоформ RAD52 человека». Biochimica et Biophysica Acta (BBA) - Структура и экспрессия гена. 1489 (2–3): 303–14. Дои:10.1016 / s0167-4781 (99) 00214-6. PMID 10673031.
- Стасиак А.З., Ларке Э., Стасиак А., Мюллер С., Энгель А., Ван Дайк Э., West SC, Egelman EH (март 2000 г.). «Человеческий белок Rad52 существует в виде гептамерного кольца». Текущая биология. 10 (6): 337–40. Дои:10.1016 / S0960-9822 (00) 00385-7. PMID 10744977. S2CID 16087838.
- Парсонс, Калифорния, Бауманн П., Ван Дайк Э., Западный Южная Каролина (август 2000 г.). «Точное связывание концов одноцепочечной ДНК с человеческим белком RAD52». Журнал EMBO. 19 (15): 4175–81. Дои:10.1093 / emboj / 19.15.4175. ЧВК 306603. PMID 10921897.
- Мер Г., Бочкарев А., Гупта Р., Бочкарева Е., Фраппье Л., Инглес С.Дж., Эдвардс А.М., Чазин В.Дж. (октябрь 2000 г.). «Структурная основа распознавания белков репарации ДНК UNG2, XPA и RAD52 фактором репликации RPA». Ячейка. 103 (3): 449–56. Дои:10.1016 / S0092-8674 (00) 00136-7. PMID 11081631. S2CID 16640087.
- Ранатунга В., Джексон Д., Флауэрс II РА, Borgstahl GE (июль 2001 г.). «Человеческий белок RAD52 обладает исключительной термостойкостью». Биохимия. 40 (29): 8557–62. Дои:10.1021 / bi0155089. PMID 11456495.
- Ван Дайк Э., Стасиак А.З., Стасиак А., Западный СК (октябрь 2001 г.). «Визуализация промежуточных продуктов рекомбинации, полученных с помощью RAD52-опосредованного отжига одной нити». Отчеты EMBO. 2 (10): 905–9. Дои:10.1093 / embo-reports / kve201. ЧВК 1084079. PMID 11571269.
- Ким П.М., Аллен С., Вагенер Б.М., Шен З., Николофф Дж. А. (ноябрь 2001 г.). «Сверхэкспрессия RAD51 и RAD52 человека снижает гомологичную рекомбинацию, вызванную двухцепочечным разрывом, в клетках млекопитающих». Исследования нуклеиновых кислот. 29 (21): 4352–60. Дои:10.1093 / nar / 29.21.4352. ЧВК 60192. PMID 11691922.
- Яньес Р.Дж., Портер А.К. (февраль 2002 г.). «Дифференциальные эффекты сверхэкспрессии Rad52p на нацеливание на гены и внехромосомную гомологичную рекомбинацию в линии клеток человека». Исследования нуклеиновых кислот. 30 (3): 740–8. Дои:10.1093 / nar / 30.3.740. ЧВК 100286. PMID 11809887.
- Джексон Д., Дхар К., Уол Дж. К., Уолд М.С., Borgstahl GE (август 2002 г.). «Анализ человеческого комплекса репликации белка A: Rad52: свидетельство перекрестного взаимодействия между RPA32, RPA70, Rad52 и ДНК». Журнал молекулярной биологии. 321 (1): 133–48. Дои:10.1016 / S0022-2836 (02) 00541-7. PMID 12139939.
- Кагава В., Курумидзака Х., Иситани Р., Фукаи С., Нуреки О., Сибата Т., Йокояма С. (август 2002 г.). «Кристаллическая структура домена гомологичного спаривания из рекомбиназы Rad52 человека в ундекамерной форме». Молекулярная клетка. 10 (2): 359–71. Дои:10.1016 / S1097-2765 (02) 00587-7. PMID 12191481.
- Синглтон М.Р., Вентцелл Л.М., Лю Й., Западный округ Колумбия, Вигли ДБ (октябрь 2002 г.). «Структура одноцепочечного домена отжига человеческого белка RAD52». Труды Национальной академии наук Соединенных Штатов Америки. 99 (21): 13492–7. Дои:10.1073 / pnas.212449899. ЧВК 129701. PMID 12370410.
- Лю Дж, Мэн Х, Шэнь З. (октябрь 2002 г.). «Ассоциация человеческого белка RAD52 с факторами транскрипции». Сообщения о биохимических и биофизических исследованиях. 297 (5): 1191–6. Дои:10.1016 / S0006-291X (02) 02353-7. PMID 12372413.
- Хан Дж., Ханкинсон С.Е., De Vivo I, Колдиц Г.А., Хантер Д.Д. (октябрь 2002 г.). «Нет связи между полиморфизмом стоп-кодонов в RAD52 и риском рака груди». Эпидемиология, биомаркеры и профилактика рака. 11 (10, п. 1): 1138–9. PMID 12376524.
- Китао Х., Юань З.М. (декабрь 2002 г.). «Регулирование индуцированного ионизирующим излучением образования ядерных фокусов Rad52 с помощью c-Abl-опосредованного фосфорилирования». Журнал биологической химии. 277 (50): 48944–8. Дои:10.1074 / jbc.M208151200. PMID 12379650.