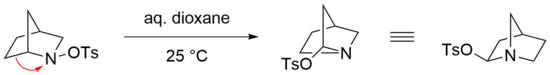WikiDer > Перестановка Штиглица
| Перестановка Штиглица | |
|---|---|
| Названный в честь | Юлиус Штиглиц |
| Тип реакции | Реакция перестановки |
| Примеры и связанные реакции | |
| Подобные реакции | Перестановка Бекмана |
В Перестановка Штиглица это реакция перегруппировки в органическая химия названный в честь американского химика Юлиус Штиглиц (1867-1937) и был впервые исследован им и Полом Николасом Личем в 1913 году.[1] Он описывает 1,2-перегруппировка из тритил амин производные триарила имины.[1][2] Это сравнимо с Перестановка Бекмана который также включает замещение у атома азота через сдвиг углерода на азот.[3] Например, триарилгидроксиламины могут претерпевать перегруппировку Стиглица путем дегидратации и сдвига фенильная группа после активации с пентахлорид фосфора дать соответствующие триарил я добываю, а База Шиффа.[4][5]
В общем, термин «перегруппировка Штиглица» используется для описания широкого спектра реакций перегруппировки амины к имины.[4] Хотя обычно это связано с перестройкой триарил гидроксиламины, о которых хорошо известно в академической литературе, перестановки Штиглица могут происходить и на алкилированный амин производные,[6] галоамины[7][8] и азиды[9][10] а также другие активированные амин производные.[4]
Механизм реакции перегруппировки Штиглица, а также вовлеченные продукты и исходные материалы делают его тесно связанным с Перестановка Бекмана, который может быть использован для синтеза карбоксамиды.[11] Обе реакции перегруппировки включают сдвиг углерода в азот, обычно после электрофильной активации уходящей группы на атоме азота.[4][12][13] Однако основное отличие исходных материалов заключается в степени их насыщения. В то время как перестановка Штиглица происходит на насыщенных амин производные с одинарной σ-связью, типичным исходным материалом для перегруппировки Бекмана является оксим (гидроксилимин) с C = N-двойной связью.[4][14] В перегруппировке Бекмана катализируемая кислотой миграция углерода в азот происходит на оксим дать нитрилиевый ион средний.[15] В принципе, аналогично происходит и первый шаг перегруппировки Штиглица.[4] Однако после образования положительно заряженных иминиевый ион через π-взаимодействие между неподеленной парой азота и электронодефицитным углеродом в перегруппировке Стиглица пути расходятся. В перегруппировке Штиглица нейтральное состояние молекулы может быть достигнуто путем диссоциации протона. В качестве альтернативы, если исходный материал не содержал аминопротонов, нейтральное состояние может быть достигнуто с помощью внешнего восстанавливающего агента, такого как борогидрид натрия. Это снижает иминиевый ион промежуточный к соответствующему насыщенному амин.[4][16] В перегруппировке Бекмана такой протон также отсутствует, и стабилизация промежуточного продукта происходит посредством нуклеофильного присоединения молекулы воды, диссоциации протона и таутомерии от молекулы воды. имидовая кислота к карбоксамид.[17]
Вариации
Хотя исходная реакция Штиглица наиболее известна перегруппировкой тритилгидроксиламинов, существует несколько вариантов, которые включают хорошие уходящие группы, такие как N-заместители (такие как галогены и сульфонаты). Обычно применяются разные реагенты, в зависимости от конкретной природы субстрата.[4]
Штиглицева перестановка N-гидроксилированные амины, N-алкоксилированные амины и N-сульфированные амины
Штиглицева перестановка N-гидроксилированные амины
Для перегруппировки тритилгидроксиламинов кислоты Льюиса, такие как пентахлорид фосфора (PCl5) , пятиокись фосфора (P2О5) или же трифторид бора (BF3) может быть использован.[4] Они действуют как электрофильные активаторы для гидроксильная группа за счет повышения качества уходящей группы. Например, при использовании PCl5 в качестве реагента тритилгидроксиламин сначала превращается в активированный промежуточный продукт посредством нуклеофильного замещения.[18] Образовавшееся промежуточное соединение может затем подвергнуться перегруппировке за счет миграции фенильная группа и диссоциация форм фосфора (V) с образованием N-фенилбензофенонимин.[18]
Штиглицева перестановка N-алкоксилированные амины
Дополнительно к N-гидрокситритиламины, перегруппировки в N-алкокситритиламины также возможны. Однако эти реакции известны своим низким выходом.[19] Например, N-бензилоксизамещенный тритиламин может подвергаться перегруппировке Стиглица в присутствии пентахлорида фосфора (160 ° C, выход 40%) или с BF3 в качестве реагента (60 ° C, выход 29%).[20] В последнем случае, BF3 действует как кислота Льюиса при электрофильной активации бензильного кислорода, обеспечивая нуклеофильную атаку на соседний атом азота.[20]
Штиглицева перестановка N-сульфированные амины
Перегруппировки Штиглица также легко протекают с активными сульфонатами в качестве уходящей группы.[21] N-сульфированные амины могут быть получены из соответствующих гидроксиламинов и подходящих реагентов сульфирования. Например, Гердерин и другие. синтезировали их вторичный гидроксиламин (исходный материал в перегруппировке, показанной ниже), подвергая соответствующий гидроксиламин воздействию тозилхлорид и едкий натр в ацетонитрил.[22]
Перегруппировка Штиглица особенно реактивна в случае мостиковой бициклической N-сульфированные амины в качестве исходных материалов, в которых мягкие условия достаточны для проведения эффективной реакции.[23] Например, перестановка бициклического N-тозилированный амин легко протекает в водном диоксане при комнатной температуре.[24] Однако соответствующий имин в этом случае не образуется, предположительно из-за напряжения, которое термодинамически не благоприятствовало бы такой структуре, несущей двойную связь у атома-мостика (Правило Бредта).[25] Вместо этого тозилат добавляется нуклеофильно в геминальном положении азота через атаку иминиевый ион.[22]
Стиглицева перегруппировка азидов
Перегруппировки Штиглица могут идти и по органическим азиды с молекулярным азотом в качестве хорошей уходящей группы.[4] Эти реакции протекают аналогично этапам Реакция Шмидта, с помощью которых карбоновые кислоты могут быть превращены в амины путем добавления гидразойная кислота в кислых водных условиях.[26]Перегруппировка азидов Штиглица обычно выигрывает от протонной[16] или тепловой[4] активация, которую также можно комбинировать.[10] В обоих случаях молекулярный азот высвобождается в виде газа на необратимой стадии. Было высказано предположение, что перегруппировка после диссоциации N2 молекула, протекает по реактивному нитрен средний.[10] Эти промежуточные продукты были бы очень похожи на те, которые были предложены в качестве ключевых промежуточных продуктов в реакциях перегруппировки, названных в честь Hofmann и Курций,[27] но с тех пор считались маловероятными.[28]При воздействии на азид кислоты Бренстеда протонирование азида активирует основной азот и снижает прочность связи соседнего, так что диссоциация и вытеснение молекулярного азота облегчаются.[16] После перегруппировки протон может затем диссоциировать от иона иминия с образованием имина.
Альтернативным способом получения протонированных органических азидов является нуклеофильное присоединение гидразойной кислоты к карбокатионам, которые затем также могут подвергаться перегруппировке Стиглица.[16]
Штиглицева перестановка N-галогенированные амины
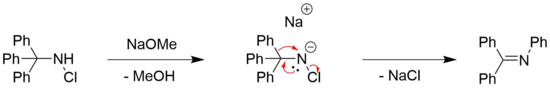
Перестановка Штиглица N-галогенированные амины могут наблюдаться для хлора[7] и бром[8] замещенные амины, часто в сочетании с органическим основанием, например метоксид натрия.[4] Потребность в основании обычно связана с необходимостью депротонирования амина.[4]
Однако также сообщалось о примерах безосновных перегруппировок Штиглица N-галогенированные амины. Пример этому можно найти в полном синтезе (±) -ликоподина путем Поль Грико и другие.[6][29] Здесь образование кольца происходит путем перегруппировки вторичного галогенамина, подвергая его тетрафторборату серебра.[6] AgBF4 как известно, действует как источник Ag+-ионы, которые могут способствовать диссоциации галогенидов от органических молекул с образованием соответствующего галогенида серебра в качестве движущей силы.[30] Желаемый продукт затем получают восстановлением цианоборгидрид натрия, мягкий восстанавливающий агент, который обычно используется при восстановлении иминов до аминов.[31]
Перегруппировка Штиглица аминов, активированных тетраацетатом свинца
Также было замечено, что добавление тетраацетат свинца может способствовать перегруппировке Стиглица аминопроизводных.[32] После образования промежуточного соединения активированного производного амина путем координации со свинцовым центром следующая перегруппировка снова протекает через миграцию ароматической группы с образованием связи C-N, диссоциацию свинца и депротонирование образующегося иона иминия.[33]
Смотрите также
Рекомендации
- ^ а б Юлиус Штиглиц, Пол Николас Лич (1914). «Молекулярная перегруппировка триарилметилгидроксиламинов и перегруппировка Бекмана кетоксимов». Журнал Американского химического общества. 36 (2): 272–301. Дои:10.1021 / ja02179a008.
- ^ Берт Аллен Стагнер (1914). «Молекулярная перегруппировка триарилметилгидроксиламинов». Журнал Американского химического общества. 36 (2): 2069–2081. Дои:10.1021 / ja02267a018.
- ^ Ван, Зеронг (2010). Исчерпывающие органические названия реакций и реагентов. John Wiley & Sons, Inc., стр. 288–295. ISBN 9780471704508.
- ^ а б c d е ж грамм час я j k л м Ван, Зеронг (сентябрь 2010 г.). Исчерпывающие органические названия реакций и реагентов. Джон Вили. С. 2673–2676. ISBN 9780471704508.
- ^ ИЮПАК, Сборник химической терминологии, 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "База Шиффа". Дои:10.1351 / goldbook.S05498
- ^ а б c Grieco, Paul A .; Дай, Юцзя (май 1998 г.). «Конструирование карбоциклического кольца посредством внутримолекулярной реакции Дильса-Альдера in-situ генерируемого, стабилизированного гетероатомом аллильного катиона: полный синтез (±) -ликоподина». Журнал Американского химического общества. 120 (20): 5128–5129. Дои:10.1021 / ja980117b.
- ^ а б Восбург, Изабелла (октябрь 1916 г.). «Молекулярная перегруппировка трифенил-метилгалогенаминов». Журнал Американского химического общества. 38 (10): 2081–2095. Дои:10.1021 / ja02267a019.
- ^ а б DeTar, DeLos F .; Бродерик, Эдвард; Фостер, Джордж; Хилтон, Бенджамин Д. (май 1950 г.). «Попытка перегруппировки 9-бромметиленфлуорена в 9-бромфенантрен». Журнал Американского химического общества. 72 (5): 2183–2184. Дои:10.1021 / ja01161a086.
- ^ Морган, Агнес Фэй (октябрь 1916 г.). «Молекулярные перегруппировки некоторых триарил-метилхлораминов». Журнал Американского химического общества. 38 (10): 2095–2101. Дои:10.1021 / ja02267a020.
- ^ а б c Кун, Джеймс (декабрь 1916 г.). «Молекулярная перегруппировка триарилметилазидов». Журнал Американского химического общества. 38 (12): 2718–2726. Дои:10.1021 / ja02269a014.
- ^ Блатт, А. Х. (апрель 1933 г.). «Перестановка Бекмана». Химические обзоры. 12 (2): 215–260. Дои:10.1021 / cr60042a002.
- ^ Табер, Дуглас Ф .; Стрейни, Патрик Дж. (Декабрь 2010 г.). «Синтез лауролактама из циклододеканона с помощью перегруппировки Бекмана». Журнал химического образования. 87 (12): 1392. Дои:10.1021 / ed100599q.
- ^ Фуруя, Йоширо; Исихара, Кадзуаки; Ямамото, Хисаши (август 2005 г.). «Хлорид циануровой кислоты как мягкий и активный катализатор перегруппировки Бекмана». Журнал Американского химического общества. 127 (32): 11240–11241. Дои:10.1021 / ja053441x. PMID 16089442.
- ^ Гай Донарума, л .; Хельдт, Уолтер З. (2011). «Органические реакции: перестановка Бекмана»: 1–59. Дои:10.1002 / 0471264180.or011.01. Цитировать журнал требует
| журнал =(помощь) - ^ ван Дейк, Том; Крис Slootweg, J .; Ламмерцма, Куп (2017). «Ионы нитрила - синтез и применение». Органическая и биомолекулярная химия. 15 (48): 10134–10144. Дои:10.1039 / C7OB02533E. PMID 29188244.
- ^ а б c d Пирсон, Уильям Х. (сентябрь 1996 г.). «Алифатические азиды как основания Льюиса. Применение к синтезу гетероциклических соединений». Журнал гетероциклической химии. 33 (5): 1489–1496. Дои:10.1002 / jhet.5570330506. HDL:2027.42/96395.
- ^ Клейден, Джонатан; Гривс, Ник; Уоррен, Стюарт (2012). Органическая химия (2-е изд.). Издательство Оксфордского университета. п. 958. ISBN 978-0-19-927029-3.
- ^ а б Ли, Джи Джек (2003). Назовите реакции: Сборник подробных механизмов реакции. (2-е изд.). Springer. п. 361. ISBN 978-3-662-05338-6.
- ^ Мецгер, Карл Хорст; Мюллер, Питер; Мюллер-Долезаль, Хайди; Швалл, Хорст; Зёлль, Ханна (2014). Houben-Weyl Methods of Organic Chemistry Vol. X / 1, 4-е издание: соединения нитро, нитрозо и гидроксиламина (4-е изд.). Георг Тиме Верлаг. п. 1266. ISBN 9783131805546.
- ^ а б Ayres, Erle B .; Хаузер, Чарльз Р. (январь 1948 г.). "Перестановка N-Трифенилметил-О-бензилгидроксиламин с помощью амида калия и трифторида бора ». Журнал органической химии. 13 (1): 116–119. Дои:10.1021 / jo01159a015. PMID 18917716.
- ^ Пирсон, Уильям Х .; Шкерянц, Джеффри М. (сентябрь 1992 г.). «Внутримолекулярная реакция Шмидта алкилазида с карбокатионом. Генерация и перегруппировка конформационно ограниченного вторичного иона аминодиазония». Буквы Тетраэдра. 33 (37): 5291–5294. Дои:10.1016 / s0040-4039 (00) 79075-7. HDL:2027.42/29850.
- ^ а б Heesing, A .; Хердеринг, В. (январь 1981 г.). «Зауэрстофф-вставка из 2-аза-бицикло [2.2.1] гепт-2-эндериватен». Буквы Тетраэдра. 22 (47): 4675–4678. Дои:10.1016 / с0040-4039 (01) 83010-0.
- ^ Renslo, Adam R .; Данхайзер, Рик Л. (октябрь 1998 г.). "Синтез замещенных пиридинов посредством региоконтролируемых [4 + 2] циклоприсоединений оксиминосульфонатов". Журнал органической химии. 63 (22): 7840–7850. Дои:10.1021 / jo981014e.
- ^ Gassman, Paul G .; Хартман, Джордж Д. (январь 1973). «Химия ионов нитрения. XXVII. Эффективность уходящей группы в генерации ионов нитрения из производных гидроксиламина». Журнал Американского химического общества. 95 (2): 449–454. Дои:10.1021 / ja00783a023.
- ^ Фосетт, Фрэнк С. (октябрь 1950 г.). "Правило Бредта двойных связей в атомно-мостиковых кольцевых структурах". Химические обзоры. 47 (2): 219–274. Дои:10.1021 / cr60147a003. PMID 24538877.
- ^ Вольф, Ганс (2011). Органические реакции. Джон Вили и сыновья, Inc., стр. 307–336. Дои:10.1002 / 0471264180.or003.08.
- ^ Ghosh, Arun K .; Саркар, Аниндья; Бриндизи, Маргарита (2018). «Перестройка Курциуса: понимание механизма и недавнее применение в синтезе натуральных продуктов». Органическая и биомолекулярная химия. 16 (12): 2006–2027. Дои:10.1039 / c8ob00138c. ЧВК 5864567. PMID 29479624.
- ^ Раук, Арви; Алевуд, Пол Ф. (1 мая 1977 г.). «Теоретическое исследование перегруппировки Курциуса. Электронные структуры и взаимопревращения разновидностей CHNO». Канадский химический журнал. 55 (9): 1498–1510. Дои:10.1139 / v77-209.
- ^ Хагер, Анастасия; Вриелинк, Нина; Хагер, Доминик; Лефранк, Жюльен; Траунер, Дирк (2016). «Синтетические подходы к алкалоидам, несущим α-третичные амины». Отчеты о натуральных продуктах. 33 (3): 491–522. Дои:10.1039 / c5np00096c. PMID 26621771.
- ^ Ахилону, Мэтью Чилака; Умесиоби, Деннис О. (ноябрь 2016 г.). «Образование связей углерод-углерод и углерод-гетероатом с использованием тетрафторбората серебра в качестве промотора». Арабский химический журнал. 9: 1984–2003. Дои:10.1016 / j.arabjc.2015.06.038.
- ^ Кристен, Ганс; Мейер, Герд (1997). Grundlagen der allgemeinen und anorganischen Chemie (1-е изд.). Salle + Sauerländer. п. 824. ISBN 978-3-7935-5493-6.
- ^ Систи, Энтони Джозеф (1968). «Реакция тетраацетата свинца с фенилметиламинами». Химические коммуникации (Лондон) (21): 1272. Дои:10.1039 / C19680001272.
- ^ Систи, Энтони Дж .; Мильштейн, Стэнли Р. (декабрь 1974 г.). «Перегруппировка Штиглица с тетраацетатом свинца и триарилметиламинами». Журнал органической химии. 39 (26): 3932–3936. Дои:10.1021 / jo00940a030.