WikiDer > Тионил тетрафторид
 | |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Тионил тетрафторид | |||
| Идентификаторы | |||
3D модель (JSmol) | |||
| ChemSpider | |||
PubChem CID | |||
| |||
| |||
| Свойства | |||
| SOF4 | |||
| Внешность | бесцветный газ | ||
| Плотность | 1,653−0,0036T (° C) жидкость[1] | ||
| Температура плавления | -99,6 ° С (-147,3 ° F, 173,6 К) | ||
| Точка кипения | -49 ° C (-56 ° F, 224 K) 5090 кал / моль теплота парообразования[1] | ||
| реакция в воде | |||
| журнал п | 7,2349-859,58 / Т-26275 / Т²[1] | ||
| Структура | |||
| искаженная тригональная бипирамида | |||
| Опасности | |||
| R-фразы (устарело) | R36 / 37/38[2] | ||
| Родственные соединения | |||
Родственные оксогалогениды | Тионил фторид Селенил тетрафторид | ||
Родственные соединения | Фосфорилтрифторид пентафторсера гипофторит сульфурилфторид | ||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
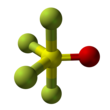
Тионил тетрафторид является неорганическое соединение газ с формула SОF4. Он также известен как оксид тетрафторида серы. Форма молекулы - искаженная тригональная бипирамида с кислородом, находящимся на экваторе. Атомы на экваторе имеют более короткие связи, чем атомы фтора на оси. Сера-кислородная связь составляет 1,409 Å. Связь S-F на оси имеет длину 1,596Å, а связь S-F на экваторе имеет длину 1,539Å. Угол между экваториальными атомами фтора составляет 112,8 °. Угол между осевым фтором и кислородом составляет 97,7 °. Угол между кислородом и экваториальным фтором составляет 123,6 °, а между аксиальным и экваториальным фтором - 85,7 °.[3] Атомы фтора производят только один ЯМР линия, вероятно, потому что они обменять позиции.[1]
Формирование
Тионил фторид реагируя с фтор газ может производить тионилтетрафторид.[1] Так газ был впервые открыт Муассаном и Лебо в 1902 году. Они определили формулу по изменениям давления в результате реакции. Фторид серебра и платина способны катализировать реакцию.
Он также может быть образован нагреванием гексафторид серы воздухом до 400 °.[4] Это может произойти при затяжке зажженной сигареты. Или реакция дифторид серебра с фторидом тионила при 200 градусах.[5] Другой способ его образования - электролиз. фтороводород с решением диоксид серы, который также сделал дифторид кислорода и сульфурилфторид.[6] Также тионилхлорид или тионил фторид электролиз с фтористым водородом дает еще больше газа.
Реакции
Тионилтетрафторид реагирует с водой с образованием плавиковая кислота, серно-фтористая кислота, и сульфурил дифторид. Ртуть может отделять фторид с образованием тионилфторида и фторид ртути. Сильные основания приводят к образованию фторидов и фторсульфат ионы.[1]
Щелкните по химии
Тионилтетрафторид можно использовать в щелкните по химии через реакции с первичными аминами, известные как фторид-обмен серы (VI) (SuFEx).[7] Такая реакция была первой реакцией «щелчок» для создания трехмерного ядра.
использованная литература
- ^ а б c d е ж Гарри Юлий Эмелеус и А.Г. Шарп Успехи неорганической химии Том 2 Academic Press 1960, стр.117 [1]
- ^ «Данные безопасности (MSDS) для тетрафторида тионила». Оксфордский университет. 2005-09-02. Получено 2008-07-29.
- ^ Лиз Хедберг и Кеннет Хедберг "Тионилтетрафторид. Повторный анализ молекулярной структуры и решение проблемы множественных моделей" Журнал физической химии Март 1982 г., том 86, стр. 598 doi 10.1021 / j100394a004 [2]
- ^ «Свойства газа SF6».
- ^ Дадли, Ф. Б. (1956). "Пентафторосера гипофторит и тионилтетрафторид". Журнал Американского химического общества. 78 (8): 1553–1557. Дои:10.1021 / ja01589a013.
- ^ Фторирование неорганических соединений серы Шунджи Нагасэ Бюллетень химического общества Японии том 42, стр.2062, 1968 г.
- ^ Ли, Сухуа; Ву, Пэн; Моисей, Джон Э .; Шарплесс, К. Барри (01.02.2017). "Многомерная химия SuFEx Click: последовательные соединения фтористого обмена серы (VI) в различных модулях, запускаемых из концентратора SOF4". Angewandte Chemie International Edition. 56 (11): 2903–2908. Дои:10.1002 / anie.201611048. ISSN 1521-3773. ЧВК 5434761. PMID 28165188.