WikiDer > Органокатализ тиомочевины
В районе органокатализ, Органокатализ (тио) мочевины описывает использование мочевина и тиомочевины для ускорения и стереохимического изменения органических преобразований. Эффекты возникают через водородная связь взаимодействия между субстратом и (тио) мочевиной. В отличие от классических катализаторов, эти органокатализаторы взаимодействуют посредством нековалентных взаимодействий, особенно водородная связь ("частичный протонирование"). Объем этих низкомолекулярных доноров Н-связи, называемых (тио) мочевиной органокатализ охватывает как нестереоселективные, так и стереоселективные приложения.[1]
История
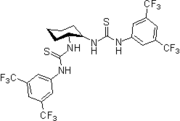
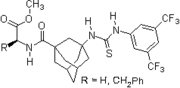
Новаторский вклад был сделан Келли, Эттером, Йоргенсеном, Хайном, Карраном, Гебелем и Де Мендоса (см. Цитируемые ниже обзорные статьи) по водородная связь взаимодействия небольших безметалловых соединений с богатыми электронами сайтами связывания. Питер Р. Шрайнер и соавторы идентифицировали и представили бедные электронами производные тиомочевины в качестве органокатализаторов, связывающих водородные связи. Тиомочевина Шрейнера, N, N '-бис [[3,5-бис (трифторметил) фенилтиомочевина, объединяет все структурные особенности для органокатализа, опосредованного двойными Н-связями:
- бедный электронами
- жесткая конструкция
- некоординирующий, электроноакцепторные заместители в 3,4 и / или 5 позиции фенил звенеть
- 3,5-бис (трифторметил) фенильная группа является предпочтительной заместитель
Катализатор-субстрат взаимодействия
Водородная связь между тиомочевина производные и карбонильные субстраты включают две водородные связи, обеспечиваемые копланарными амино-заместителями в (тио) мочевине.[2][3][4]
[5] Скварамиды участвуют во взаимодействиях двойных водородных связей и часто превосходят тиомочевины.[6]
Преимущества тиомочевинных органокатализаторов
Тио) мочевины являются зеленый и устойчивый катализаторы. Когда они эффективны, они могут предложить следующие преимущества:
- отсутствие ингибирования продукта из-за слабого энтальпийный связывание, но специфическое связывание - «узнавание»
- низкая загрузка катализатора (до 0,001 мол.%)[3]
- высоко TOF (Частота переключения) значения (до 5700 ч−1)[3]
- простой и недорогой синтез из функционализированных первичным амином (хиральный пул) исходных материалов и изотиоцианатов
- простота регулирования и эксплуатации (стабильная работа), не требуется атмосферы инертного газа
- иммобилизация на твердой фазе (связанные с полимером органокатализаторы), извлечение катализатора и возможность повторного использования [3]
- катализ в почти нейтральных условиях (pkа тиомочевина 21,0) и в мягких условиях допустимы кислоточувствительные субстраты
- не содержит металлов, нетоксичен (сравните с традиционными металлсодержащими катализаторами на основе кислоты Льюиса)
- водостойкий, даже каталитически эффективный в воде или водной среде.[8]
Субстраты
Субстраты, принимающие водородные связи, включают: карбонил соединения, имины, нитроалкены. В Реакция Дильса-Альдера - это один из процессов, в котором могут использоваться катализаторы (тио) мочевина.
Катализаторы
Широкий спектр монофункциональных и бифункциональных (концепция бифункциональности) хиральных двойных водородно-связывающих (тио) мочевинных органокатализаторов был разработан для ускорения различных синтетически полезных органических превращений.
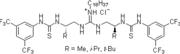
2003: Бифункциональная хиральная система Такемото тиомочевина производная, катализ асимметричных Майкл- и Аза-Генри реакции.[11]
2004: Хиральный бис-тиомочевинный органокатализатор Нагасавы, катализ асимметричных Реакции Бейлиса-Хиллмана.[12]
2005: Бифункциональный тиомочевина, функционализированный гуанидином Нагасавы, асимметричный катализ Реакции Генри (нитроальдол).[13]
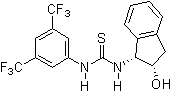
2005: Хиральное производное тиомочевины Риччи с дополнительной гидроксигруппой, энантиоселективное Алкилирование Фриделя-Крафтса из индолы с нитроалкенами.[14]
2005: Бифункциональное производное бинафтилтиомочевины Вэй Ванга, асимметричный катализ Реакции Морита-Бейлиса-Хиллмана.[15]
2005: Бифункциональная тиомочевина Суса, Коннона и Добсона функционализирована. Хинный алкалоид, асимметричные добавки нитроалканов к халконам [16] а также малонаты к нитроалкенам [17]
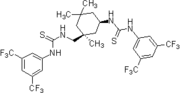
2006: Хиральный бифункциональный пирролидин-тиомочевина Yong Tang, энантиоселективный Майкл дополнения из циклогексанон к нитроолефинам.[18]
2006': Хиральное производное бистиомочевины на основе изофорондиамина Беркесселя, катализ асимметричных реакций Морита-Бейлиса-Хиллмана.[19]
2006: Хиральная тиомочевина, связанная с ПЭГ, такемото, асимметричный катализ (тандем-) реакций Михаэля транс-β-нитростирол, аза-Генри реакции.[20]
2007: Kotke / Schreiner, связанное с полистиролом, восстанавливаемое и многоразовое производное тиомочевины для органокаталитического тетрагидропиранилирования спиртов.[3]
2007: Хелатирующая бифункциональная гидрокси-тиомочевина Takemoto для энантиоселективного Реакция типа петазиса из хинолины.[22]
дальнейшее чтение
- Кристиан М. Кляйнер, Питер Р. Шрайнер (2006). «Гидрофобная амплификация нековалентного органокатализа». Chem. Commun.: 4315–4017.
- З. Чжан и П. Р. Шрайнер (2007). "Трансферное гидрирование альдиминов, катализируемое тиомочевиной". Synlett. 2007 (9): 1455–1457. Дои:10.1055 / с-2007-980349.
- Ванка, Лукас; Кьяра Кабреле; Максимс Ванеевс; Питер Р. Шрайнер (2007). «γ-Аминоадамантанкарбоновые кислоты посредством прямого амидирования связи C – H». Европейский журнал органической химии. 2007 (9): 1474–1490. Дои:10.1002 / ejoc.200600975. ISSN 1434–193X.
Рекомендации
- ^ Котке, Майк; Шрайнер, Питер Р. (октябрь 2009 г.). «Органокатализаторы (тио) мочевины». В Петри М. Пихко (ред.). Водородная связь в органическом синтезе. С. 141–251. ISBN 978-3-527-31895-7.
- ^ Александр Витткопп, Питер Р. Шрайнер, «Реакции Дильса-Альдера в воде и в средах с водородными связями», глава книги «Химия диенов и полиенов» Цви Раппопорт (ред.), том 2, John Wiley & Sons Inc .; Чичестер, 2000, 1029-1088. ISBN 0-471-72054-2.
Александр Витткопп, «Органокатализ реакций Дильса-Альдера нейтральными донорами водородных связей в органических и водных растворителях», диссертация на немецком языке, Universität Göttingen, 2001. Аннотация на английском языке / скачать: [1]
Питер Р. Шрайнер, обзор: «Безметалловый органокатализ посредством явных взаимодействий водородных связей», Chem. Soc. Ред. 2003, 32, 289-296. аннотация / скачать:[2]
М. Котке и П. Р. Шрайнер (2006). «Бескислотная, органокаталитическая ацетализация». Тетраэдр. 62 (2–3): 434–439. Дои:10.1016 / j.tet.2005.09.079.М. П. Петри (2004). «Активация карбонильных соединений двойной водородной связью: новый инструмент в асимметричном катализе». Angewandte Chemie International Edition. 43 (16): 2062–2064. Дои:10.1002 / anie.200301732. PMID 15083451.
Йошидзи Такемото, обзор: «Распознавание и активация мочевиной и тиомочевиной: стереоселективные реакции с использованием мочевины и тиомочевины в качестве доноров водородных связей», Орг. Biomol. Chem. 2005, 3, 4299-4306. аннотация / скачать: [3]Марк С. Тейлор, Эрик Н. Якобсен (2006). «Асимметричный катализ хиральными донорами водородной связи». Angewandte Chemie International Edition. 45 (10): 1520–1543. Дои:10.1002 / anie.200503132. PMID 16491487.Дж. С. Стивен (2006). «Органокатализ, опосредованный производными (тио) мочевины». Химия: европейский журнал. 12 (21): 5418–5427. Дои:10.1002 / chem.200501076. PMID 16514689. - ^ а б c d е Котке, Майк; Питер Шрайнер (2007). «Обычно применяемое органокаталитическое тетрагидропиранилирование гидроксильных функций с очень низкой загрузкой катализатора». Синтез. 2007 (5): 779–790. Дои:10.1055 / с-2007-965917. ISSN 0039-7881.
- ^ а б Шрайнер, Питер Р .; Александр Витткопп (2002). «Добавки, связывающие водородные связи, действуют подобно кислотным катализаторам Льюиса». Органические буквы. 4 (2): 217–220. Дои:10.1021 / ol017117s. ISSN 1523-7060. PMID 11796054.
- ^ Котке, Майк (2009). Водородно-связывающие (тио) мочевинные органокатализаторы в органическом синтезе: современное состояние и практические методы ацетализации, тетрагидропиранилирования и кооперативного эпоксидного алкоголиза (Кандидат наук.). Университет Гиссена / Германия. Получено 2010-11-12.
- ^ Chauhan, P .; Mahajan, S .; Kaya, U .; Hack, D .; Эндерс, Д. (2015). «Бифункциональные амино-скварамиды: мощные водородно-связывающие органокатализаторы для асимметричных домино / каскадных реакций». Adv. Synth. Катал. 357 (2–3): 253–281. Дои:10.1002 / adsc.201401003.CS1 maint: использует параметр авторов (связь)
- ^ Витткопп, Александр; Питер Р. Шрайнер (2003). «Безметалловый, нековалентный катализ реакций Дильса – Альдера нейтральными донорами водородных связей в органических растворителях и в воде». Химия: европейский журнал. 9 (2): 407–414. Дои:10.1002 / chem.200390042. ISSN 0947-6539. PMID 12532289.
- ^ А. Витткопп и П. Р. Шрайнер (2003). «Безметалловый, нековалентный катализ реакций Дильса-Альдера с помощью Нейтральный Доноры водородных связей в органических растворителях и воде ». Химия: европейский журнал. 9 (2): 407–414. Дои:10.1002 / chem.200390042. PMID 12532289.
- ^ Сигман, Мэтью С .; Эрик Н. Якобсен (1998). «Катализаторы на основе Шиффа для асимметричной реакции Стрекера, идентифицированные и оптимизированные из параллельных синтетических библиотек». Журнал Американского химического общества. 120 (19): 4901–4902. Дои:10.1021 / ja980139y. ISSN 0002-7863.
- ^ Сигман, Мэтью С .; Петр Вачаль; Эрик Н. Якобсен (2000). «Общий катализатор асимметричной реакции Штрекера». Angewandte Chemie International Edition. 39 (7): 1279–1281. Дои:10.1002 / (SICI) 1521-3773 (20000403) 39: 7 <1279 :: AID-ANIE1279> 3.0.CO; 2-U. ISSN 1433-7851. PMID 10767031.
- ^ Окино, Томотака; Ясутака Хоаши; Ёсидзи Такемото (2003). «Энантиоселективная реакция Михаэля малонатов на нитроолефины, катализируемые бифункциональными органокатализаторами». Журнал Американского химического общества. 125 (42): 12672–12673. Дои:10.1021 / ja036972z. ISSN 0002-7863. PMID 14558791.
- ^ Сохтоме, Йошихиро; Ая Танатани; Юичи Хашимото; Кадзуо Нагасава (2004). «Разработка органокатализатора типа бис-тиомочевины для асимметричной реакции Бейлиса – Хиллмана ☆». Буквы Тетраэдра. 45 (29): 5589–5592. Дои:10.1016 / j.tetlet.2004.05.137. ISSN 0040-4039.
- ^ Сохтоме, Йошихиро; Юичи Хашимото; Казуо Нагасава (2005). «Бифункциональный органокатализатор гуанидин-тиомочевина для асимметричной реакции Генри (нитроальдол)». Расширенный синтез и катализ. 347 (11–13): 1643–1648. Дои:10.1002 / adsc.200505148. ISSN 1615-4150.
- ^ Herrera, Raquel P .; Валентина Сгарзани; Лука Бернарди; Альфредо Риччи (2005). "Каталитическое энантиоселективное алкилирование индолов нитроалкенами по Фриделю-Крафтсу с использованием простого тиомочевинного органокатализатора". Angewandte Chemie International Edition. 44 (40): 6576–6579. Дои:10.1002 / anie.200500227. ISSN 1433-7851. PMID 16172992.
- ^ Ван, Цзянь; Хао Ли; Синьхун Юй; Лянсуо Цзу; Вэй Ван (2005). "Асимметричная реакция Морита-Бейлиса-Хиллмана, промотируемая хиральным бинафтил-производным амин-тиомочевина, органокатализатором". Органические буквы. 7 (19): 4293–4296. Дои:10.1021 / ol051822 +. ISSN 1523-7060. PMID 16146410.
- ^ Вакуля, Бенедек; Сцилард Варга; Антал Чампай; Тибор Соос (2005). «Высокоэнантиоселективное конъюгатное добавление нитрометана к халконам с использованием бифункциональных хинных органокатализаторов». Органические буквы. 7 (10): 1967–1969. Дои:10.1021 / ol050431s. ISSN 1523-7060. PMID 15876031.
- ^ McCooey, Séamus H .; Стивен Дж. Коннон (2005). «Замещенные мочевиной и тиомочевиной производные хинного алкалоида как высокоэффективные бифункциональные органокатализаторы для асимметричного добавления малоната к нитроалкенам: инверсия конфигурации на C9 значительно улучшает характеристики катализатора». Angewandte Chemie International Edition. 44 (39): 6367–6370. Дои:10.1002 / anie.200501721. ISSN 1433-7851. PMID 16136619.
- ^ Цао, Чун-Ли; Мэн-Чун Е; Сю-Ли Сунь; Юн Тан (2006). «Пирролидин-тиомочевина как бифункциональный органокатализатор: высокоэнантиоселективное добавление Майкла циклогексанона к нитроолефинам». Органические буквы. 8 (14): 2901–2904. Дои:10.1021 / ol060481c. ISSN 1523-7060. PMID 16805512.
- ^ Беркессель, Альбрехт; Катрин Роланд; Йорг М. Нойдёрфль (2006). "Асимметричная реакция Морита-Бейлиса-Хиллмана, катализируемая изофорондиамином-производными бис (тио) мочевинными органокатализаторами". Органические буквы. 8 (19): 4195–4198. Дои:10.1021 / ol061298m. ISSN 1523-7060. PMID 16956185.
- ^ Миябе, Хидэто; Сайо Тучида; Масасигэ Ямаути; Ёсидзи Такемото (2006). «Реакция нитроорганических соединений с использованием тиомочевинных катализаторов, закрепленных на полимерной основе». Синтез. 2006 (19): 3295–3300. Дои:10.1055 / с-2006-950196. ISSN 0039-7881.
- ^ Ванка, Лукас; Кьяра Кабреле; Максимс Ванеевс; Питер Р. Шрайнер (2007). «γ-Аминоадамантанкарбоновые кислоты посредством прямого амидирования связи C – H». Европейский журнал органической химии. 2007 (9): 1474–1490. Дои:10.1002 / ejoc.200600975. ISSN 1434–193X.
- ^ Ямаока, Юске; Хидето Миябе; Ёсидзи Такемото (2007). «Каталитическая энантиоселективная реакция петазисного типа хинолинов, катализируемая новым разработанным тиомочевинным катализатором». Журнал Американского химического общества. 129 (21): 6686–6687. Дои:10.1021 / ja071470x. ISSN 0002-7863. PMID 17488015.
- ^ Лю, Кун; Хан-Фэн Цуй; Цзин Не; Ке-Ян Донг; Сяо-Хуан Ли; Джун-Ань Ма (2007). «Высокоэнантиоселективное добавление по Майклу ароматических кетонов к нитроолефинам, стимулированное хиральными бифункциональными первичными амино-тиомочевинными катализаторами на основе сахаридов». Органические буквы. 9 (5): 923–925. Дои:10.1021 / ol0701666. ISSN 1523-7060. PMID 17288432.
- ^ Ли, Сяо-Цзюань; Кун Лю; Хай Ма; Цзин Не; Джун-Ань Ма (2008). «Высокоэнантиоселективное присоединение по Майклу малонатов к нитроолефинам, катализируемое хиральными бифункциональными третичными амино-тиомочевинами на основе сахаридов». Synlett. 2008 (20): 3242–3246. Дои:10.1055 / с-0028-1087370. ISSN 0936-5214.