WikiDer > Триметиленметан
 Триметиленметан, среднее из трех конфигураций. Формально радиальные связи имеют валентность 4/3. Каждый концевой углерод имеет 2/3 незаполненной валентной связи. | |
| Имена | |
|---|---|
| Другие имена Бирадикал триметиленметан; Триметиленметан бирадикал | |
| Идентификаторы | |
PubChem CID | |
| Свойства | |
| C4ЧАС6 | |
| Молярная масса | 54.092 г · моль−1 |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Триметиленметан (часто сокращенно TMM) это химическое соединение с участием формула C
4ЧАС
6. Это нейтральный свободная молекула с двумя неудовлетворенными валентные связи, и поэтому является очень реактивным свободный радикал. Формально это можно рассматривать как изобутилен молекула C
4ЧАС
8 с двумя водород атомы удалены из терминала метильные группы.
Структура
Электронная структура триметиленметана обсуждалась в 1948 году.[1][2] Это нейтральная четырехуглеродная молекула, содержащая четыре молекулярных пи-орбитали. При попадании в твердую матрицу при температуре около 90 K, шесть атомов водорода молекулы эквивалентны. Таким образом, его можно описать либо как цвиттерион, или как простейший сопряженный углеводород это нельзя дать структуру Кекуле. Его можно описать как суперпозицию трех состояний:
 |  | 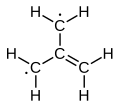 |
Оно имеет триплет основное состояние (3
А
2'/3
B
2) и, следовательно, является бирадикал в более строгом смысле этого слова.[3] Расчеты предсказывают плоскую молекулу с трехкратной вращательной симметрией с приблизительной длиной связи 1,40 Å (C – C) и 1,08 Å (C – H). Угол H – C – H в каждом метилене составляет около 121 градуса.[1]
Из трех синглетные возбужденные состояния, первый, 11
А
1 (1.17 эВ над землей), представляет собой бирадикал с замкнутой оболочкой с плоской геометрией и полностью вырожденным трехмерным (D3ч) симметрия. Второй, 11
B
2 (также при 1,17 эВ), является радикалом с открытой оболочкой с D3ч-симметричное равновесие между тремя равными геометриями; каждая имеет более длинную связь C – C (1,48 Å) и две более короткие (1,38 Å), плоская и двусторонне-симметричная, за исключением того, что более длинный метилен вывернут на 79 градусов из плоскости (C2 симметрия). Третье синглетное состояние, 21
А
1/1
А
1'(3.88 эВ), также является D3ч-симметричное равновесие трех геометрий; каждый плоский с одной более короткой связью C – C и двумя более длинными (C2ν симметрия).[1]
Следующие более высокие энергетические состояния представляют собой вырожденные триплеты, 13
А
1 и 23
B
2 (4,61 эВ) с одним возбужденным электроном; и состояние квинтета, 5
B
2 (7,17 эВ), причем p-орбитали заняты одиночными электронами, а D3ч симметрия.[1]
Подготовка
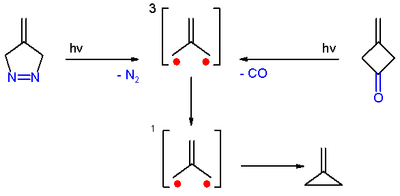
Триметиленметан впервые был получен из фотолиз из диазо соединение 4-метилен-Δ1-пиразолин с вытеснением азота в замороженном разбавленном стекловидном растворе при −196 C.[3]
Также был получен фотолизом 3-метиленциклобутанон, как в холодном растворе, так и в виде монокристалла с выбросом окиси углерода. В обоих случаях триметиленметан был обнаружен спектроскопия электронного парамагнитного резонанса.[3]
Триметиленметан был получен также путем обработки калий с 2-иодметил-3-иодпропеном | дииодид изобутилена (IH
2C)2C =CH
2 в газовой фазе. Однако продукт быстро димеризуется с образованием 1,4-диметиленциклогексана, а также 2-метилпропен путем отделения двух атомов водорода от других молекул (углеводорода или гидрид калия).[4]
Металлоорганическая химия
Количество металлоорганические комплексы были приготовлены, начиная с Fe (C
4ЧАС
6) (CO)3, который был получен раскрытием цикла метиленциклопропана с диирон нонакарбонил (Fe
2(CO)9).[3] Такой же комплекс подготовил реакция метатезиса солей из динатрия тетракарбонилферрат (Na
2Fe(CO)4) с участием 1,1-бис (хлорметил) этилен (ЧАС2C = C (CH2Cl)2).[5] Родственные реакции дают M (TMM) (CO)4 (M = Cr, Mo). Реакция, приводящая к (TMM) Mo (CO)4 также дает Мо (C
8ЧАС
12) (CO)3 содержащий димеризованный лиганд TMM.[5]
Комплексы TMM были изучены на предмет их потенциала в органический синтез, особенно в циклоприсоединение триметиленметана реакция с небольшим успехом. Одним из примеров является катализируемый палладием [3 + 2] циклоприсоединение триметиленметана.[6]
Структура Ru (триметиленметан) (CO)3, смотреть вниз C3 ось.[7]
использованная литература
- ^ а б c d Слипченко Людмила Валерьевна, Крылова Анна Ивановна (2003). «Электронная структура бирадикала триметиленметана в его основном и электронно-возбужденном состояниях: связь, равновесная геометрия и частоты колебаний». Журнал химической физики. 118 (15): 6874–6883. Bibcode:2003ЖЧФ.118.6874С. Дои:10.1063/1.1561052.
- ^ К. А. Коулсон (1948), Journal de Chimie Physique et de Physico-Chimie Biologique, том 45, стр. 243. Цитируется Слипченко и Крылов (2003)
- ^ а б c d Пол Дауд (1972). «Триметиленметан». Отчеты о химических исследованиях. 5 (7): 242–248doi = 10,1021 / ar50055a003. Дои:10.1021 / ar50055a003.
- ^ Скелл Филип С., Доерр Роберт Г. (1967). «Триметиленметан». Журнал Американского химического общества. 89 (18): 4688–4692. Дои:10.1021 / ja00994a020.
- ^ а б Дж. С. Уорд и Р. Петтит (1970). «Триметиленметановые комплексы железа, молибдена и хрома». Журнал химического общества D (21): 1419–1420. Дои:10.1039 / C29700001419.
- ^ Трост Барри М. (1979). «Новые соединительные реагенты. 2-Ацетоксиметил-3-аллилтриметилсилан для аннулирования метиленциклопентана, катализируемого палладием (0)». Журнал Американского химического общества. 101 (21): 6429–6432. Дои:10.1021 / ja00515a046.
- ^ Herberich, G.E .; Spaniol, T. P. (1993). «Триметиленметановые комплексы рутения, осмия и родия через соединение CH2= C (CH2SnMe3)2". Журнал химического общества, Dalton Transactions (16): 2471–2476. Дои:10.1039 / DT9930002471.CS1 maint: использует параметр авторов (ссылка на сайт)