WikiDer > Триметилсилил
- Относительно тетраметилсилана, который также сокращенно называют ТМС, см. тетраметилсилан.
А триметилсилильная группа (сокращенно TMS) - это функциональная группа в органическая химия. Эта группа состоит из трех метил группы, связанные с кремний атом [-Si (CH3)3], который, в свою очередь, связан с остальной частью молекулы. Для этой структурной группы характерны: химическая инертность и большой молекулярный объем, что делает его полезным в ряде приложений.
Триметилсилильная группа, связанная с метильной группой, образует тетраметилсилан, который также сокращается как TMS.
Соединения с триметилсилильными группами обычно не встречаются в природе. Химики иногда используют триметилсилилирующий реагент дериватизировать довольно нелетучие соединения, такие как некоторые спирты, фенолы, или же карбоновые кислоты путем замены водорода на триметилсилильную группу в гидроксильные группы на соединениях. Сюда триметилсилокси группы [-O-Si (CH3)3] образуются на молекуле. Несколько примеров триметилсилилирующих агентов включают: триметилсилилхлорид и бис (триметилсилил) ацетамид. Триметилсилильные группы в молекуле имеют тенденцию делать ее более летучей, часто делая соединения более пригодными для анализа с помощью газовая хроматография или же масс-спектрометрии. Пример такого триметилсилилирования упоминается в Брассикастерин статья. Такие дериватизации часто выполняются в небольших масштабах в специальных флаконы.
При присоединении к определенным функциональным группам в реагент молекулы, триметилсилильные группы также могут использоваться как временные защитные группы в течение химический синтез или какой-то другой химические реакции.
В хроматография, дериватизация доступных силанол группы в связанных стационарная фаза с триметилсилильными группами называется заглушка.
В Спектр ЯМР, сигналы от атомов в триметилсилильных группах в соединениях обычно будут иметь химические сдвиги, близкие к тетраметилсилан эталонный пик при 0 ppm. Также соединения, такие как высокотемпературный силикон »кран" смазывать, который имеет полисилоксаны (часто называемые силиконами) в них обычно проявляются пики от их метильных групп (прикрепленных к атомам кремния), имеющие химические сдвиги ЯМР, близкие к стандартному пику тетраметилсилана, например, 0,07 ppm в CDCl.3.[1]
В противном случае могут быть изолированы очень реакционноспособные молекулы, когда они окружены объемными триметилсилильными группами. Этот эффект можно наблюдать в тетраэдры.
Супер силильные группы
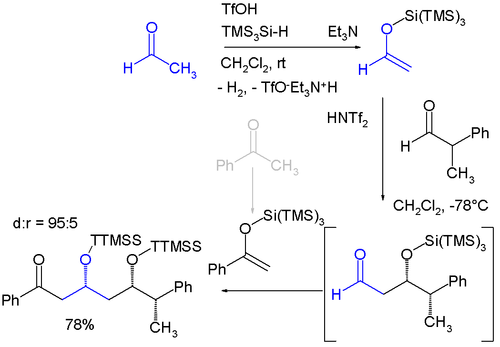
К триметилсилильным группам относятся «супер» силильные группы, из которых существует две разновидности: группа кремния, соединенная с тремя триметилсилильными группами, образует три (триметилсилил) силильную группу (TTMSS или TMS3Si) и кремниевую группу, соединенную с тремя трет-бутил группы. Группа TTMSS была предложена в 1993 г. Ганс Бок. С объем Ван-дер-Ваальса объемом до 7 куб. ангстрем это превосходит родственные ЧАЕВЫЕ группа (около 2)[2][3] и одно из возможных применений - его использование в качестве временного заместителя, способствующего асимметричная индукция например в этом диастереоселективный одноразовая реакция с участием двух последовательных Альдольные реакции Мукаямы:[4]
TTMSS может также обозначать трис (триметилсилил) силан,[5][6] который сравним как химический реагент с гидрид трибутилолова без связанной с этим проблемы токсичности оловоорганическое вещество и трибутилолово соединения.[7][8] Реагент используется в радикальные сокращения, гидросилилирование и последовательный радикальные реакции.[9]
Защита от алкоголя
В органическом синтезе группа ТМС используется как защитная группа за спирты.
Наиболее распространенные методы защиты
- Триметилсилил хлорид (TMSCl) или триметилсилил трифторметансульфонат (TMSOTf) и основание (т.е. пиридин, триэтиламин, или же 2,6-лутидин) в дихлорметан[10][11][12][13][14]
- TMSCl и сульфид лития (Ли2S) в ацетонитриле
Наиболее распространенные методы снятия защиты
- Группы ТМС подвержены расщеплению при обработке реагентами на основе HF.
- Фторид тетрабутиламмония (Bu4NF) в THF
- Кремнефтористоводородная кислота (H2SiF6)
- Обработка HCl в растворе THF / вода
Смотрите также
- Триметилсиланол
- Триметилсилил хлорид
- Тетраметилсилан
- Триметилсили фторид является побочным продуктом при приготовлении трифторид диэтиламиносеры (ДАСТ) из тетрафторида серы:[15]
- Et2NSiMe3 + SF4 → Et2NSF3 + Я3SiF
Рекомендации
- ^ Gottlieb, H.E .; Котляр, В .; Нудельман, А. Химические сдвиги ЯМР обычных лабораторных растворителей как следовых примесей. J. Org. Chem. 1997, 62(21), стр 7512-7515. Дои:10.1021 / jo971176v
- ^ Группа "Super Silyl" для диастереоселективных последовательных реакций: доступ к сложной хиральной архитектуре в одном сосуде Мэтью Б. Боксер и Хисаши Ямамото Варенье. Chem. Soc.; 2007; 129 (10), стр. 2762–2763; (Коммуникация) Дои:10.1021 / ja0693542
- ^ Трис (триметилсилил) силил-управляемая альдегидная кросс-альдольная каскадная реакция Боксер, М.Б .; Ямамото, Х. Дж. Ам. Chem. Soc .; (Коммуникация); 2006; 128(1); 48-49. Дои:10.1021 / ja054725k
- ^ Исходные материалы ацетальдегид и бензофенон которые оба преобразованы в силиловый эфир енола по реакции с трис (триметилсилил) силаном и трифликовая кислота с выделением водорода. Альдольная реакция катализируется бис (трифторметан) сульфонимид
- ^ «Трис (триметилсилил) силан 97%». ООО «Сигма-Олдрич». Получено 2014-05-05.
- ^ Чатгилиалоглу, Хрисостомос; Феррери, Карла; Ландаис, Янник; Тимохин, Виталий И. (25 июня 2018 г.). «Тридцать лет (TMS) 3SiH: веха в радикальной синтетической химии». Химические обзоры. 118 (14): 6516–6572. Дои:10.1021 / acs.chemrev.8b00109. PMID 29938502.
- ^ Брук, Майкл А. (2000). Кремний в органической, металлоорганической и полимерной химии. Нью-Йорк: John Wiley & Sons, Inc., стр. 172–173.
- ^ «Трис (триметилсилил) силан, ТТМСС». https://www.organic-chemistry.org. Получено 2014-05-05. Внешняя ссылка в
| publisher =(помощь) - ^ Недавнее применение (TMS) 3SiH радикального реагенаt Chryssostomos Chatgilialoglu, Jacques Lalevée Molecules 2012, 17, 527-555; Дои:10.3390 / молекулы17010527
- ^ Nicolaou, K. C .; Liu, J. J .; Hwang, C.-K .; Dai, W.-M .; Гай, Р. К. (1992-01-01). «Синтез полнофункциональной кольцевой системы CD таксола». Журнал химического общества, химические коммуникации (16): 1118. Дои:10.1039 / c39920001118. ISSN 0022-4936.
- ^ Nicolaou, K. C .; Ян, Чжэнь; Соренсен, Эрик Дж .; Накада, Масахиса (1 января 1993 г.). «Синтез ABCтаксоидных кольцевых систем с помощью конвергентной стратегии». Журнал химического общества, химические коммуникации (12): 1024. Дои:10.1039 / c39930001024. ISSN 0022-4936.
- ^ Nicolaou, K. C .; Hwang, C.-K .; Soresen, E. J .; Клэрборн, К. Ф. (1992-01-01). «Конвергентная стратегия в отношении таксола. Легкое энантиоселективное вступление в полностью функционализированную кольцевую систему А». Журнал химического общества, химические коммуникации (16): 1117. Дои:10.1039 / c39920001117. ISSN 0022-4936.
- ^ Nicolaou, K. C .; Ян, З .; Liu, J. J .; Ueno, H .; Nantermet, P. G .; Guy, R.K .; Claiborne, C.F .; Renaud, J .; Куладурос, Э. А. (17 февраля 1994 г.). «Полный синтез таксола». Природа. 367 (6464): 630–634. Bibcode:1994Натура.367..630Н. Дои:10.1038 / 367630a0. PMID 7906395.
- ^ Nicolaou, K. C .; Claiborne, Christopher F .; Nantermet, Philippe G .; Куладурос, Элиас А .; Соренсен, Эрик Дж. (1 февраля 1994 г.). «Синтез новых таксоидов». Журнал Американского химического общества. 116 (4): 1591–1592. Дои:10.1021 / ja00083a063. ISSN 0002-7863.
- ^ У. Дж. Миддлтон, Э. М. Бингхэм "Трифторид диэтиламиносеры" Organic Syntheses, Coll. Vol. 6, с.440; Vol. 57, с.50. Онлайн-версия