WikiDer > Функциональная группа винилиодида
Эта статья слишком много внимания уделяется конкретным примерам без объясняя их важность к своей основной теме. (Декабрь 2013) |
В органическая химия, а винилйодид (также известный как йодалкен) функциональная группа является алкен с одним или несколькими йодид заместители. Винилиодиды - это универсальные молекулы, которые служат важными строительными блоками и прекурсорами в органическом синтезе. Они обычно используются в реакциях образования углерод-углерод в перекрестных реакциях, катализируемых переходными металлами.реакции сочетания, Такие как Стилле реакция, Чертовски реакция, Муфта Соногашира, и Муфта Suzuki.[1] Синтез винилиодида четко определенной геометрии или сложности важен в стереоселективный синтез натуральные продукты и наркотики.
Характеристики
Винилиодиды обычно стабильны при нуклеофильный условия. В SN2 реакции, обратная атака затруднена из-за стерического столкновения групп R на углероде, прилегающем к электрофильный центр (см. рисунок 1а).[2] Кроме того, неподеленная пара на иодиде отдает * алкена, что снижает электрофильный характер углерода в результате уменьшения положительного заряда. Кроме того, это стереоэлектронный эффект укрепляет связь C-I, что затрудняет удаление йодида (см. рисунок 1b).[3] В SN1 случай, диссоциация затруднена из-за усиленной связи C-I, и потеря йодида приведет к нестабильному карбокатион(см. рисунок 1c)[2]
В кросс-реакции сочетанияобычно винилиодиды реагируют быстрее и в более мягких условиях, чем винилхлорид и винилбромид. Порядок реакционной способности основан на прочности связи углерод-галоген. Связь C-I - самая слабая из галогенов, энергии диссоциации связи C-I составляет 57,6 ккал / моль, а фторид, хлорид и бромид - 115, 83,7, 72,1 ккал / моль соответственно.[4] В результате более слабой связи винилйодид не полимеризуется так легко, как его винилгалогенид аналоги, а лучше разложить и выпустить йодид.[5]Принято считать, что йодистый винил не может выжить при обычном снижение условия, которые восстанавливают винилйодид до олефин или ненасыщенный алкан.[6] Однако в литературе есть сведения, в которых пропаргиловый спиртс алкин восстанавливается в присутствии иодистого винила с использованием водорода над Pd / CaCO3 или же Катализатор Крэбтри.[7]
Другие приложения
Помимо использования винилиодидов в качестве полезных субстратов в кросс-реакция сочетания, они также могут пройти устранение с прочной базой, чтобы дать соответствующие алкин, и их можно преобразовать в подходящий винил Реактивы Гриньяра. Винилиодиды превращаются в Реактивы Гриньяра обменом магний-галоген (см. схему 1а).[8] Объем этого синтетического метода ограничен, поскольку он требует более высоких температур и более длительного времени реакции, что влияет на толерантность функциональных групп. Однако иодид винила с электроноакцепторная группа может повысить обменный курс (см. схему 1b).[8] Также добавление хлорид лития помогает улучшить обмен магния и галогена (см. схему 1c). Предполагается, что хлорид лития разрушает агрегаты в магнийорганических реагентах.[9]
Методы синтеза
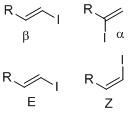
Винилиодиды синтезируются такими методами, как йодирование и реакция замещения. Винилиодиды с четко определенной геометрией (региохимия и стереохимия) важны в синтезе, поскольку многие натуральные продукты и наркотики которые имеют определенную структуру и размер. Пример региохимия является ли йодид в альфа- или бета-положении на олефине. Стереохимия Такие как Обозначение E-Z или же цис-транс Геометрия алкена важна, поскольку некоторые переходные металлы перекрестнореакции сочетания, такой как Муфта Suzuki, может сохранять олефиновую геометрию. При синтезе полезно вводить винилиодид в различные положения, которые должны быть установлены для реакции сочетания на следующей стадии синтеза. Ниже приведены различные средства и методы введения и синтеза винилиодидов.
Синтез из алкинов
Самый простой и распространенный способ получения йодистого винила - это добавление одного эквивалента ЗДРАВСТВУЙ к алкин. Обычно это делает 2-иод-1-алкены или α-винилиодид путем Правило марковникова. Однако эта реакция не происходит с хорошей скоростью или очень высокой стереоселективно.[10] В результате большинство синтетических методов часто включают гидрометалляция шаг перед добавлением источника I +.
α-винилйодиды
Введение α-винилиодида из концевого положения алкина является трудным шагом. кроме того, винилметаллический промежуточный продукт может быть умеренно нуклеофильный, например винилалюминий, может образовывать связи C-C в каталитических условиях. Однако группа Ховейда продемонстрировала, что использование катализатора на основе никеля (Ni (dppp) Cl2), ДИБАЛ-Н с N-иодосукцинимид (NIS), селективно отдают предпочтение α-винилйодиду практически без побочных продуктов.[11] Также они наблюдали обратную селективность по β с Ni (PPh3)2Cl2 в их гидроалюминирование реакции в тех же условиях с небольшим количеством побочных продуктов или без них. Преимущество этого метода заключается в том, что это недорогая (и коммерчески доступная), масштабируемая и проточная реакция.
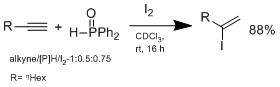
Другой метод не предполагает гидрометалляция но гидройодация с я2Бинарная система / гидрофосфин, разработанная группой Огавы.[12]
Гидроиодирование протекает по аддукту марковниковского типа, без добавления гидрофошина реакции не наблюдается. В правдоподобном механизме, предложенном группой Огавы, гидрофосфин реагирует с HI с образованием промежуточного комплекса, который координирует HI для проведения марковниковского гидроиодирования алкена. Преимущество этой системы в том, что условия мягкие, могут переносить широкий спектр функциональных групп.
β-винилйодиды
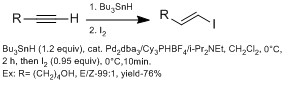
Как правило, это больше методов получения β-винилиодидов по сравнению с α-винилиодидов с использованием гидрометалляция (с алюминием с ДИБАЛ-Н (гидроалюминирование), с бором (гидроборирование), с HZrCp2Cl (гидроцирконирование)).[13] Тем не мение, гидрометалляция с алкином с различными функциональными группами часто плохо реагируют с побочными продуктами. Группы Чонг продемонстрировали использование гидростанция, используя Bu3SnH с палладиевым катализатором с высокой стереоселективностью по E.[13] Они наблюдали, что использование стерически объемных лигандов дает более высокую региоселективность для β-винилйодида. Преимущество этого метода в том, что этот метод может переносить широкий спектр функциональных групп.
Z-селективные β-винилиодиды немного сложнее ввести, чем E-β-винилиодиды, часто требуя более одной стадии. Гидроалюминирование и гидроборирование обычно действуют синхронно, поэтому выборочно отдает предпочтение геометрии E. Группа Осима продемонстрировала использование гидроизоляция с HInCl избирательно поддерживает Z-геометрию.[14] Они предположили, что реакция протекает по радикальному механизму. Они предсказывают, что HInCl присоединяется к алкину за счет радикального присоединения в Z-геометрии. Не изомеризуется в геометрию E из-за низкой реакционной способности радикала InCl2 с промежуточным комплексом (без второго добавления). Если происходит второе добавление, то изомеризация будет происходить через дииндиум средний. Они подтверждают радикальный механизм в механистическом исследовании циклизации алкинов и алкенов.
Замена
Замена это, пожалуй, самый полезный метод введения винилиодида в молекулу. Галогеновый обмен может быть полезен, поскольку винилиодиды обладают большей реакционной способностью, чем другие винилгалогениды. Группа Бухвальда демонстрирует галогенобмен с винилбромида на винилйодид с медным катализатором в мягких условиях.[15] Не исключено, что этот метод переносит различные функциональные группы поскольку эти условия были проверены арилгалогениды первоначально. Объем этого обмена на региохимия и стереохимия в настоящее время не исследован.
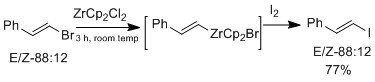
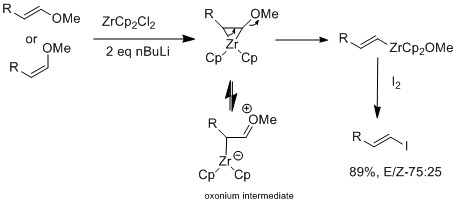
Галогеновый обмен можно также проводить с производными циркония, которые сохраняют олефинГеометрия[16]
Группа Marek дополнительно исследовала использование циркониевого катализатора на E или Z виниловые эфиры, который селективен для E-виниловых эфиров.[16] Циркониевый оксофильный природа допускает устранение алкокси группа в положении β с образованием промежуточного винилциркониевого комплекса. Избирательность геометрии E не вызвана стерическими факторами, скорее, сама реакция не согласована. В механистическом исследовании они наблюдали изомеризация, которые предполагают, что продукт с геометрией E более предпочтителен, чем с геометрией Z. Разница в результатах между галогенобменом и реакцией E-винилового эфира состоит в том, что только при наличии оксоний промежуточный, является изомеризация наблюдаемый.
Интересной реакцией замещения винилбороновой кислоты на винилиодид является группа Брауна.[17] В зависимости от порядка добавления йодида или основания, винил борат может дать разные стереоизомеры винилйодида (см. схему 2а). Группа Уайтинга, однако, заметила, что метод Брауна неприменим к более стерически затрудненным бороновые эфиры (без реакции).[18] Они предположили, что источник йодида был недостаточно электроположительным. Поэтому они решили использовать ICl который полярнее, чем я2, в котором они наблюдали аналогичные результаты (см. схему 2b).
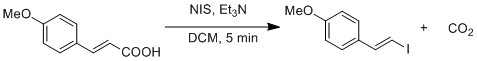
Радикальное замещение карбоновой кислоты на иодид демонстрируется модифицированным Реакция Хунсдикера.[19] Гомолитический разрыв связи O-I генерирует CO2 и виниловый радикал. Виниловый радикал рекомбинирует с йодидным радикалом с образованием винилиодида.
Йододесилилирование
Йододесилилирование реакция замещения силил группа для йодида. Преимущества йододесилилирования заключаются в том, что он позволяет избежать использования токсичного оловянного реагента, а промежуточный винилсилил является стабильным, нетоксичным и легко обрабатывается и хранится. Винилсилил можно получить из концевого алкина или другими способами.
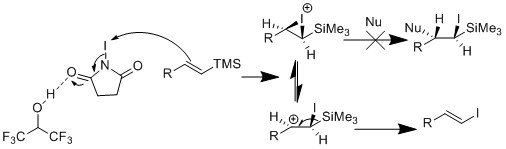
Группа Киши сообщила о мягком получении винилйодида из винилсилила с использованием NIS в смеси ацетонитрил и хлорацетонитрил.[20] Они наблюдали сохранение геометрической формы олефина в некоторых винилсилильных субстратах и инверсию в других. Они пришли к выводу, что размер группы R влияет на геометрию олефина. Если группа R мала, растворитель ацетонитрил может участвовать в реакции, приводящей к изменению геометрии олефина. Если группа R большая, растворитель не может участвовать, что приводит к сохранению геометрии олефина.
Затем группа Закаряна решила провести реакцию в HFIP, что дало высокое сохранение геометрической формы олефина.[21] Они рассудили, что HFIP - это низкий нуклеофильность растворитель, в отличие от ацетонитрил. Кроме того, они наблюдали ускоренную скорость реакции, поскольку HFIP активирует NIS посредством водородная связь.
К сожалению, йододесилилирование в этих условиях (см. Выше) потенциально может приводить к множественным побочным продуктам в высоко функционализированных молекулах с кислородом. функциональные группы. Группа Виларрасы и Косты выдвинула гипотезу, что радикальные реакции производство ЗДРАВСТВУЙ и я2 помогают облегчить расщепление алкоголя защитная группа и может присоединяться к другим алкеновым связям.[22] Они экспериментировали с использованием серебро вызывает привыкание, например ацетат серебра и карбонат серебра в котором серебро может реагировать с избытком йодида с образованием йодид серебра. Они не наблюдали никаких побочных продуктов, 100% конверсия в продукты и повышение урожайности.
Назовите реакции
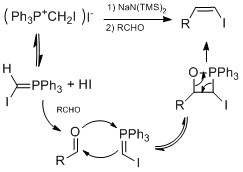
Некоторые известные методы синтеза винилйодида включают превращение альдегид или же кетон до винилйодида. Бартона йодирование гидразона метод предполагает добавление гидразины к альдегид или же кетон формировать гидразон. Тогда гидразон превращается в винилиодид путем добавления йодида и DBU.[23][24] Этот метод был использован в синтезе натуральных продуктов Таксол по Данишефскому[25] и Кортистатин А пользователя Shair.[26]Другой метод - это Такай олефинирование который использует йодоформ и хлорид хрома (II) сделать винилйодид из альдегида с высоким стереоселективность для геометрии E.[27] Для высоких стереоселективность для геометрии Z, Олефинирование аиста-Чжао выручка от Виттиг-подобная реакция. Высокая урожайность и Z стереоселективность происходило при низкой температуре и при наличии HMPA.[28]
Ниже приведен пример использования олефинирования Такаи и олефинирования Аист-Чжао в полном синтезе (+) - 3- (E) - и (+) - 3- (Z) -пиннатифиденина.[29]
Метод устранения
Винилиодиды редко образуются в результате реакции отщепления вицинальный дииодид потому что он имеет тенденцию разлагаться на алкен и йодид.[30] Группа Бейкера показала, что с помощью декарбоксилирования может происходить отщепление.[31]
Рекомендации
- ^ Се, Мейхуа и др. «Регио- и стереоспецифический синтез винилгалогенидов путем карбоцинкования ацетиленовых сульфонов с последующим галогенированием». Журнал металлоорганической химии 694.14 (2009): 2258-2262.
- ^ а б Кляйн, Дэвид. Органическая химия. John Wiley & Sons, 15 июня 2011 г. Google book. Чт. 28 ноября 2013 г. https://books.google.com/books?id=SsX9pbarkQkC&source=gbs_navlinks_s
- ^ Бхупиндер, Мехта; Манджу, Мехта. Органическая химия. PHI Learning Pvt. Ltd., 1 января 2005 г. Google book. Чт. 28 ноября 2013 г. https://books.google.com/books?id=QV6cwXA9XkEC&source=gbs_navlinks_s
- ^ Бланксби, Стивен Дж. И Дж. Барни Эллисон. «Связанные энергии диссоциации органических молекул». Счета химических исследований 36,4 (2003): 255-263
- ^ Герман, Ян А. и Пьер Роберж. «Рентгеновская полимеризация винилиодида в растворе». Журнал науки о полимерах 62,174 (1962): S116-S118.
- ^ Чжан, Син и др. «Эффективное цис-восстановление алкина до алкена в присутствии винилиодида: стереоселективный синтез фрагмента C22-C31 лейодолида A.» Тетраэдр (2012).
- ^ Дентон, Ричард В. и Кэтлин А. Паркер. «Совместимость функциональных групп. Уменьшение пропаргилового спирта в присутствии винилйодида». Органические письма 11.13 (2009): 2722-2723.
- ^ а б Rottlander, M .; Boymond, L .; Cahiez, G .; Knochel, P. J. Org. Chem. 1999. 64, 1080.
- ^ Ren, H .; Красовский, А .; Knochel, P. Org. Lett. 2004, 6, 4215
- ^ Kropp, P.J .; Crawford, S. D. J. Org. Chem. 1994, 59, 3102.
- ^ Гао, Фанг и Амир Х. Ховейда. «α-Селективное катализируемое никелем гидроалюминирование арил- и алкилзамещенных концевых алкинов: практический синтез внутренних винилалюминий, галогенидов или боронатов». Журнал Американского химического общества 132.32 (2010): 10961-10963.
- ^ Кавагути, Син-ичи и Акия Огава. "Высокоселективное гидроиодирование алкинов с использованием бинарной системы йод-гидрофосфин". Органические письма 12.9 (2010): 1893-1895.
- ^ а б Chong, J .; Дарвиш, Алла. Тетраэдр, том 68, выпуск 2, 14 января 2012 г., страницы 654-658
- ^ Таками, Кадзуаки и др. «Триэтилборан-опосредованное гидрогаллирование и гидроиндирование: новый доступ к органо-галлиям и органоиндиям». Журнал органической химии 68.17 (2003): 6627-6631.
- ^ Клапарс, Артис и Стивен Л. Бухвальд. «Катализируемый медью галогенный обмен в арилгалогенидах: ароматическая реакция Финкельштейна». Журнал Американского химического общества 124.50 (2002): 14844-14845.
- ^ а б Лиард, Энни и Илан Марек. «Стереоселективное получение производных E винилциркония из эфиров енола E или Z». Журнал органической химии 65.21 (2000): 7218-7220.
- ^ Браун, H.C; Hamaoka, T .; и Ravindran, N .; Варенье. Chem. Soc., 1973, 95, 5786
- ^ Стюарт, Сара К. и Эндрю Уайтинг. «Стереоселективный синтез винилйодидов из сложных эфиров пинакола винилбороната с использованием ICI». Буквы тетраэдра 36.22 (1995): 3929-3932.
- ^ Дас, Джая Пракаш и Суджит Рой. «Каталитическая реакция Хунсдикера α, β-ненасыщенных карбоновых кислот: насколько эффективен катализатор?». Журнал органической химии 67.22 (2002): 7861-7864.
- ^ Стамос, Д. П .; Тейлор, А.Г .; Киши, Ю. Tetrahedron Lett. 1996, 37 (48), 8647-8650
- ^ Иларди, Э. А .; Stivala, C.E .; Закарян А. Органические буквы. 2008, 10 (9), 1727-1730
- ^ Виларраса, Дж; Сидера М; Органические письма, 2012 г., 13, 4934-4937
- ^ Бартон, Д. Х. Р., Р. Э. О'Брайен и С. Стернхелл, Журнал химического общества, 1962, 470 - 476
- ^ Barton, D.H.R .; Bashiardes, G .; Фурри, Ж.-Л. Тетраэдр 1988, 44, 147
- ^ Данишефский, Самуэль Дж. И др. «Полный синтез баккатина III и таксола». Журнал Американского химического общества 118.12 (1996): 2843-2859.
- ^ Ли, Хон Мён, Кристина Ньето-Оберхубер и Мэтью Д. Шаир. «Энантиоселективный синтез (+) - кортистатина А, мощного и селективного ингибитора пролиферации эндотелиальных клеток». Журнал Американского химического общества 130.50 (2008): 16864-16866.
- ^ Простой и селективный метод превращения альдегидов (RCHO) -> (E) -галогеналкенов (RCH: CHX) с помощью системы галоформ-хром хлорид К. Такай, К. Нитта, К. Утимото J. Am. Chem. Soc .; 1986; 108 (23); 7408–7410
- ^ Аист, Гилберт и Кан Чжао. «Стереоселективный синтез (Z) -1-йод-1-алкенов». Tetrahedron Letters 30.17 (1989): 2173-2174.
- ^ Ким, Хёнсу и др. «Построение восьмичленных эфирных колец с помощью внутреннего алкилирования олефинов, зависящего от геометрии: первый асимметричный полный синтез (+) - 3- (E) -и (+) - 3- (Z) -пиннатифиденина». Журнал Американского химического общества 125.34 (2003): 10238-10240.
- ^ Лей, Стивен. Синтез: углерод с одним гетероатомом, прикрепленным единой связью, том 2. Elsevier, 1995. Книга Google. Чт. 28 ноября 2013 г. https://books.google.com/books?id=BPcxrmIgLKMC
- ^ 30. Бейкер, Раймонд и Хосе Л. Кастро. «Полный синтез (+) - макбецина I.» J. Chem. Soc., Perkin Trans. 1 1 (1990): 47-65.