WikiDer > Стилле реакция
| Стилле реакция | |
|---|---|
| Названный в честь | Джон Кеннет Стилл |
| Тип реакции | Реакция сцепления |
| Идентификаторы | |
| Портал органической химии | ходовая часть |
| RSC ID онтологии | RXNO: 0000035 |
В Стилле реакция это химическая реакция широко используется в органический синтез. Реакция включает связывание двух органических групп, одна из которых переносится как оловоорганическое соединение (также известный как органостаннаны). Разнообразные органические электрофилы обеспечивают другое партнер по связке. Реакция Стилла - одна из многих реакции сочетания, катализируемые палладием.[1][2][3]
- : Аллил, алкенил, арил, бензил, ацил.
- : галогениды (Cl, Br, I), псевдогалогениды (OTf, ), OAc
R1 группа, присоединенная к триалкилолову, обычно sp2-гибридизированные, в том числе винил, и арил группы.
Эти органостаннаны также устойчивы как к воздуху, так и к влаге, и многие из этих реагентов либо коммерчески доступны, либо могут быть синтезированы на основании прецедентов в литературе. Однако эти реагенты с оловом очень токсичны. X обычно галогенид, Такие как Cl, Br, или же я, но псевдогалогениды, такие как трифлаты и сульфонаты и фосфаты также можно использовать.[4][5] Опубликовано несколько обзоров.[6][2][7][8][9][10][11][12][13][14][15]
История
Первый пример катализируемое палладием сочетание арилгалогенидов с оловоорганические реагенты сообщил Колин Иборн в 1976 г.[16] Эта реакция дает от 7% до 53% диарильного продукта. Этот процесс был расширен до объединения ацилхлориды с реагентами алкил-олова в 1977 г. компанией Toshihiko Migita, выход от 53% до 87% кетон товар.[17]
В 1977 году Migita опубликовала дальнейшую работу по объединению аллил-оловянные реагенты с обоими арил (C) и ацил (D) галогениды. Большая способность аллильных групп мигрировать в палладиевый катализатор позволял проводить реакции при более низких температурах. Выходы арилгалогенидов составляют от 4% до 100%, а ацилгалогенидов - от 27% до 86%.[18][19] Отражая ранний вклад Мигиты и Косуги, реакцию Стилле иногда называют Муфта Мигита – Косуги – Стилле.
Stille впоследствии сообщили о сочетании различных реагентов на основе алкилолова в 1978 году с многочисленными арил- и ацилгалогенидами в мягких условиях реакции с гораздо лучшими выходами (76% -99%).[18][20] В 1980-х годах Стилле продолжил свою работу по синтезу множества кетонов, используя этот широкий и мягкий процесс, и выяснил механизм этого превращения.[21][22]
К середине 1980-х было опубликовано более 65 статей на тему реакций сочетания с участием олова, в которых продолжалось изучение субстратных возможностей этой реакции. В то время как первоначальные исследования в этой области были сосредоточены на связывании алкильных групп, большая часть будущих работ включала гораздо более синтетически полезное соединение винил, алкенил, арил и аллил органостаннаны к галогенидам. Из-за устойчивости этих оловоорганических реагентов к воздуху и легкости их синтеза реакция Стилле стала обычным явлением в органическом синтезе.[8]
Механизм
Механизм реакции Стилле широко изучен.[11][23] В каталитический цикл включает в себя окислительная добавка из галогенид или псевдогалогенид (2) к палладиевый катализатор (1), трансметалляция из 3 с оловоорганический реагент (4), и восстановительное устранение из 5 чтобы получить связанный продукт (7) и регенерированный палладиевый катализатор (1).[24]
Однако детальный механизм связывания Стилле чрезвычайно сложен и может происходить через многочисленные реакционные пути. Как и другие реакции сочетания, катализируемые палладиемактивный палладиевый катализатор считается 14-электронным комплексом Pd (0), который может быть образован различными способами. Использование 18- или 16-электронного источника Pd (0) Pd (PPh3)4, Pd (дБа)2 может пройти лиганд диссоциация с образованием активных разновидностей. Второй, фосфины может быть добавлен к безлигандному палладию (0). Наконец, как на фото, снижение источника Pd (II) (8) (Pd (OAc)2, PdCl2(MeCN)2, PdCl2(PPh3)2, BnPdCl (PPh3)2и т. д.) путем добавления фосфиновых лигандов или оловоорганических реагентов. [6]
Окислительное добавление
Предложено окислительное присоединение к 14-электронному комплексу Pd (0). Этот процесс дает 16-электронное соединение Pd (II). Было высказано предположение, что анионные лиганды, Такие как OAc, ускорить этот шаг за счет образования [Pd (OAc) (PR3)п]−, что делает частицы палладия более нуклеофильными.[11][25]В некоторых случаях, особенно когда зр3-гибридизированный органо-галогенид используется, SN2-х типовой механизм имеет тенденцию преобладать, но это не так часто встречается в литературе.[11][25]Однако, несмотря на нормальное формирование СНГ-сразу после согласованное окислительное добавление, этот товар быстро равновесие с этими транс-изомер.[26][27]
Трансметалляция
В трансметалляция из транс промежуточный от окислительная добавка Считается, что стадия протекает посредством множества механизмов в зависимости от субстратов и условий. Наиболее распространенный тип трансметалляции муфты Стилле включает ассоциативный механизм. Этот путь подразумевает, что органостаннан, обычно банка атом, связанный с аллильной, алкенильной или арильной группой, может координировать к палладию через одну из этих двойных связей. Это дает мимолетный пятивалент, 18-электронные разновидности, который затем может подвергнуться отщеплению лиганда с образованием квадратный плоский снова комплекс. Несмотря на то, что органостаннан координируется с палладием через R2 группа, R2 должны быть официально переданы палладий (R2-Sn связь должна быть разорвана), и группа X должна уйти вместе с оловом, завершая трансметалляцию. Считается, что это происходит за счет двух механизмов.[28]
Во-первых, когда органостаннан первоначально присоединяется к транс-металлическому комплексу, группа X может координировать к банка, помимо палладия, образуя циклический переходное состояние. Разрушение этого аддукта приводит к потере R3Sn-X и трехвалентный палладий комплекс с R1 и R2 присутствует в СНГ отношение. Другой часто встречающийся механизм включает такое же первоначальное добавление станнана к транс комплекс палладия, как показано выше; однако в этом случае группа X не координируется с оловом, создавая открытый переходное состояние. После α-углерод по сравнению с оловом, атакующим палладий, комплекс олова уйдет с чистым положительным зарядом. На схеме ниже обратите внимание, что двойная связь, координирующая олово, обозначает R2так что любой алкенил, аллил, или же арил группа. Кроме того, группа X может диссоциировать в любое время в течение механизма и связываться с Sn+ сложный в конце. Функциональная теория плотности расчеты предсказывают, что открытый механизм будет преобладать, если 2 лиганды остаются прикрепленными к палладию, и группа X уходит, в то время как циклический механизм более вероятен, если лиганд диссоциирует до трансметалляция. Следовательно, хорошие уходящие группы, такие как трифлаты в полярных растворителях, благоприятствуют первым, в то время как объемные фосфиновые лиганды будет отдавать предпочтение последнему.[28]
Менее распространенный путь для трансметалляция проходит через диссоциативный или с помощью растворителя механизм. Здесь лиганд четырехвалентного палладия диссоциирует, и координирующий растворитель может добавляться к палладию. Когда растворитель отделяется с образованием трехвалентного интермедиата с 14 электронами, органостаннан можно добавить к палладий, подвергаясь процессу открытого или циклического типа, как указано выше.[28]
Восстановительный этап устранения
Для того, чтобы R1-Р2 к редуктивно устранить, эти группы должны занимать взаимно СНГ координационные сайты. Любой транс-аддукты должны поэтому изомеризоваться в СНГ промежуточный, иначе муфта будет нарушена. Существует множество механизмов восстановительного устранения, и они обычно считаются согласованными.[11][29][30]
Во-первых, 16-электронная четырехвалентный промежуточный от трансметалляция шаг может подвергнуться восстановительному исключению без посторонней помощи из квадратный плоский сложный. Эта реакция происходит в два этапа: во-первых, за восстановительным элиминированием следует координация вновь образованной сигма-связи между R1 и R2 к металлу, с окончательной диссоциацией с образованием связанного продукта.[11][29][30]
Однако предыдущий процесс иногда бывает медленным и может быть значительно ускорен диссоциацией лиганда с образованием 14-электронного Т-образный промежуточный. Этот промежуточный продукт может затем перегруппироваться с образованием Y-образного аддукта, который может подвергаться более быстрому восстановительному отщеплению.[11][29][30]
Наконец, дополнительный лиганд может ассоциироваться с палладием с образованием 18-электронной тригональной бипирамидальной структуры с R1 и R2 цис друг к другу в экваториальных положениях. Геометрия этого промежуточного звена делает его похожим на Y-образную форму выше.[11][29][30]
Наличие объемные лиганды также может увеличить скорость выведения. Лиганды, такие как фосфины с большим углы прикуса причина стерическое отталкивание между L и R1 и R2, в результате чего угол между L и R группами увеличивается, а угол между R1 и R2 чтобы, следовательно, уменьшить, что позволяет быстрее восстановительное устранение.[11][24]
Кинетика
Скорость, с которой органостаннаны трансметаллировать с палладиевыми катализаторами показано ниже. Sp2-гибридизированные углеродные группы, присоединенные к олову, являются наиболее часто используемыми партнерами связывания, а sp3-гибридизированные атомы углерода требуют более жестких условий, и концевые алкины могут быть связаны через связь C-H через Соногашира реакция.
В качестве органического соединения олова обычно используют триметилстаннильное или трибутилстаннильное соединение. Хотя триметилстаннильные соединения демонстрируют более высокую реакционную способность по сравнению с трибутилстаннильными соединениями и имеют гораздо более простые 1Спектры H-ЯМР, токсичность первого намного выше.[31]
Оптимизация того, какие лиганды лучше всего подходят для проведения реакции с высоким выходом и скоростью оборота, может быть трудной. Это потому, что окислительная добавка требуется металл, богатый электронами, следовательно, предпочтение отдается электронодонорным лигандам. Однако металл с дефицитом электронов более благоприятен для трансметалляция и восстановительное устранение шаги, делая электроноакцепторные лиганды здесь лучшими. Таким образом, оптимальный набор лигандов сильно зависит от индивидуальных используемых субстратов и условий. Они могут изменить шаг определения скорости, а также механизм трансметалляция шаг.[32]
Обычно используются лиганды с промежуточной донностью, такие как фосфины. Повышение скорости можно увидеть при использовании лигандов с умеренным содержанием электронов, таких как три-2-фурилфосфин или трифениларсенин. Точно так же лиганды с большим числом доноров могут замедлять или ингибировать реакции связывания.[32][33]
Эти наблюдения предполагают, что обычно этап определения скорости реакции Стилле трансметалляция.[33]
Добавки
Самая распространенная добавка к реакции Стилле - это стехиометрический или же сокаталитический медь (I), конкретно йодид меди, что может улучшить тарифы больше на> 103 складывать. Было высказано предположение, что в полярных растворители медь трансметаллировать с органостаннан. Результирующий органокупрат реагент может затем трансметаллировать с палладиевым катализатором. Кроме того, в эфирных растворителях медь также может способствовать удалению фосфиновый лиганд, активируя центр Pd.[9][34][35][36][37]
Лития хлорид было обнаружено, что он является мощным ускорителем скорости в случаях, когда группа X диссоциирует от палладия (т. е. открытый механизм). В хлористый ион, как полагают, либо замещает группу X на палладии, делая катализатор более активным для трансметалляция или путем координации с аддуктом Pd (0) для ускорения окислительная добавка. Кроме того, соль LiCl усиливает полярность растворителя, облегчая этот обычно анионный лиганд (–Cl, –Br, –OTfи т. д.) оставить. Эта добавка необходима, когда такие растворители, как THF используется; однако использование более полярного растворителя, такого как NMP, может заменить потребность в этой солевой добавке. Однако, когда стадия трансметаллирования муфты протекает по циклическому механизму, добавление хлорида лития может фактически снизить скорость. Как и в циклическом механизме, нейтральный лиганд, такой как фосфин, должен диссоциировать вместо анионной группы X.[10][38]
Наконец, источники ионы фтора, Такие как фторид цезия, также влияют на каталитический цикл. Во-первых, фторид может увеличивать скорость реакции органотрифлаты, возможно, тем же эффектом, что и хлорид лития. Кроме того, ионы фтора могут действовать как мусорщики за банка побочные продукты, что упрощает их удаление через фильтрация.[36]
Конкурирующие побочные реакции
Наиболее распространенная побочная реакционная способность, связанная с реакцией Стилле, - это гомосочетание реагентов станнана с образованием R2-Р2 димер. Считается, что это происходит с помощью двух возможных механизмов. Во-первых, реакция двух эквивалентов органостаннан с предкатализатором Pd (II) будет давать гомо-связанный продукт после восстановительное устранение. Во-вторых, катализатор Pd (0) может подвергаться радикальный процесс чтобы получить димер. Используемый органостаннановый реагент традиционно четырехвалентен по олову, обычно состоящий из пр.2-гибридизованная группа для переноса и три «непередаваемых» алкил группы. Как видно выше, алкильные группы обычно наиболее медленно мигрируют на палладиевый катализатор.[10]
Также было обнаружено, что при температуре до 50 ° C, арил группы на обоих палладий и скоординированный фосфин можно обменять. Хотя обычно они не обнаруживаются, во многих случаях они могут быть второстепенным продуктом.[10]
Наконец, довольно редкая и экзотическая побочная реакция известна как подмена кино. Здесь после начального окислительная добавка из арилгалогенид, эта разновидность Pd-Ar может вставляться через двойную связь винил-олова. После устранение β-гидрида, миграционная вставка, и протодестаннилирование, можно синтезировать 1,2-дизамещенный олефин.[10]
Могут возникнуть многочисленные другие побочные реакции, в том числе: E / Z изомеризация, что потенциально может быть проблемой при использовании алкенилстаннана. Механизм этого превращения в настоящее время неизвестен. Обычно, органостаннаны довольно устойчивы к гидролиз, тем не менее, когда используются арилстаннаны с очень высоким содержанием электронов, это может стать значительной побочной реакцией.[10]
Объем
Электрофил
Галогениды винила являются общими партнерами в реакции Стилле, и реакции этого типа встречаются во многих натуральный продукт общий синтез. Обычно используются винилйодиды и бромиды. Винилхлориды недостаточно реактивны по отношению к окислительная добавка в Pd (0). Йодиды обычно предпочтительны: они обычно реагируют быстрее и в более мягких условиях, чем бромиды. Это различие демонстрируется ниже выборочным связь винилйодида в присутствии винилбромида.[10]
Обычно стереохимия из алкен сохраняется на протяжении всей реакции, за исключением жестких условий реакции. Могут использоваться различные алкены, и они включают как α-, так и β-галоген-α, β-ненасыщенные кетоны, сложные эфиры, и сульфоксиды (для чего обычно требуется добавка меди (I)) и многое другое (см. пример ниже).[39] Иногда используются также винилтрифлаты. Некоторые реакции требуют добавления LiCl а другие замедляются, что подразумевает наличие двух механистических путей.[10]
Другой класс обычных электрофилы арил и гетероциклический галогениды. Что касается виниловых подложек, бромиды и йодиды встречаются чаще, несмотря на их большую стоимость. Можно выбрать множество арильных групп, включая кольца, замещенные электронодонорными заместителями, биарил кольца и многое другое. Галогензамещенный гетероциклы также использовались в качестве партнеров по сцеплению, в том числе пиридины, фураны, тиофены, тиазолы, индолы, имидазолы, пурины, урацил, цитозины, пиримидиныи многое другое (см. ниже таблицу гетероциклов; галогены могут быть замещены во множестве положений на каждом).[10]
Ниже приведен пример использования сцепления Stille для создания сложности на гетероциклы из нуклеозиды, Такие как пурины.[40]
Арил трифлаты и сульфонаты также сочетаются с широким спектром станнановых реагентов. Трифлаты имеют тенденцию реагировать сравнимо с бромидами в реакции Стилле.[10]
Ацилхлориды также используются в качестве партнеров для связывания и могут использоваться с широким спектром станнана, даже с реагентами алкил-олова, для получения кетоны (см. пример ниже).[41] Однако иногда бывает трудно ввести ацилхлорид. функциональные группы на большие молекулы с чувствительными функциональными группами. Альтернативой, разработанной для этого процесса, является реакция перекрестного связывания с карбонилированием Стилле, которая вводит карбонил группа через введение окиси углерода.[10]
Аллильный, бензиловый, и пропаргиловый галогениды также могут быть связаны. Обычно используемые аллильные галогениды протекают через η3 переходное состояние, позволяющее связываться с органостаннаном в α- или γ-положении, преимущественно по наименее замещенному углероду (см. пример ниже).[42] Алкениловые эпоксиды (смежные эпоксиды и алкены) также может претерпевать такую же связь через η3 переходное состояние as, открывая эпоксид алкоголь. В то время как аллильный и бензиловый ацетаты Обычно используются пропаргиловые ацетаты, которые не реагируют с органостаннанами.[10]
Станнан
Органостаннановые реагенты общие. Некоторые из них имеются в продаже.[43] Станнановые реагенты могут быть синтезированы по реакции Гриньяр или же литийорганический реагент с хлоридами триалкилолова. Например, винилтрибутилолово получают реакцией бромида винилмагния с хлоридом трибутилолова.[44] Гидростаннилирование из алкины или же алкены предоставляет множество производных. Оловоорганические реагенты устойчивы к воздуху и влаге. Некоторые реакции могут происходить даже в воде.[45] Их можно очистить хроматография. Они толерантны к большинству функциональных групп. Некоторые оловоорганические соединения сильно токсичный, особенно производные триметилстаннила.[10]
Широко распространено использование реагентов на основе винилстаннана или алкенилстаннана.[10] Что касается ограничений, как очень объемные реагенты станнана, так и станнаны с заменой на α-углерод как правило, вяло реагируют или требуют оптимизации. Например, в приведенном ниже случае α-замещенный винилстаннан реагирует только с концевым иодидом из-за стерическое препятствие.[46]
Реагенты арилстаннана также широко распространены, и оба пожертвование электронов и вывод электронов группы фактически увеличивают скорость трансметалляции. Это снова означает, что два механизма трансметалляция может случиться. Единственным ограничением для этих реагентов являются заместители в орто-положении, настолько малые, что метильные группы могут снизить скорость реакции. Большое разнообразие гетероциклы (см. раздел «Электрофилы») также могут использоваться в качестве партнеров по связи (см. пример с тиазол кольцо внизу).[10][47]
Алкинилстаннаны, наиболее реактивные из станнанов, также использовались в муфтах Стилле. Обычно они не нужны, поскольку концевые алкины могут напрямую связываться с палладиевыми катализаторами через их связь C-H через Муфта Соногашира. Сообщалось, что аллилстаннаны работают, однако возникают трудности, как и с аллильными галогенидами, с трудностью контроля региоселективность для сложения α и γ. Реагенты дистаннан и ацилстаннан также использовались в муфтах Стилле.[10]
Приложения
Реакция Стилле использовалась в синтезе множества полимеров.[48][49][50] Однако наиболее распространенным использованием реакции Стилле является ее использование в органический синтез, а именно в синтезе натуральные продукты.
Полный синтез натурального продукта
Овермана 19 ступеней энантиоселективный полный синтез квадригема С включает двойной стиль перекрестный метатезис реакция.[6][51] Комплексный станнан присоединен к двум арилиодидным группам. После двойного Черт циклизация, продукт достигается.
32 ступень Панека энантиоселективный полный синтез из ансамицин антибиотик (+) - микотриенол использует тандемное соединение макроцикла типа Стилле на поздней стадии. Здесь органостаннан имеет две концевые группы трибутилолова, атакованные до алкена. Этот органостаннан «сшивает» два конца линейного исходного материала в макроцикл, добавляя в процесс два недостающих метиленовых звена. После окисления ароматической сердцевины аммиачная селитра церия (CAN) и снятие защиты с плавиковая кислота дает натуральный продукт с выходом 54% за 3 стадии.[6][52]
Стивен Ф. Мартин а в 21-ступенчатом энантиоселективном полном синтезе манзамина противоопухолевого алкалоида Ircinal A коллег используется тандемная реакция Стилла / Дильса-Альдера в одном сосуде. К винилбромиду добавляется алкеновая группа, за которой следует на месте Дильс-Альдер циклоприсоединение между добавленным алкеном и алкеном в пирролидин звенеть.[6][53]
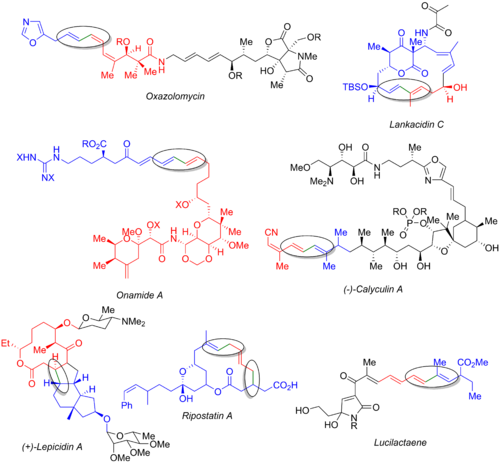
Во многих других полных синтезах используется реакция Стилле, включая оксазоломицин,[54] ланкацидин С,[55] онамид А,[56] каликулин А,[57] лепицидин А,[58] рипостатин А,[59] и люцилактаен.[6][60] На изображении ниже показан последний натуральный продукт, галогенид (синий), станнанорганический (красный) и образующаяся связь (зеленый и обведен). Из этих примеров ясно, что реакция Стилле может использоваться как на ранних стадиях синтеза (оксазоломицин и каликулин A), так и в конце конвергентного пути (онамид A, ланкацидин C, рипостатин A) или в средний (лепицидин А и люцилактаен). Синтез рипостатина А включает два одновременных связывания Стилле, за которыми следует метатезис замыкающего кольца. Синтез луцилактаена включает среднюю субъединицу, имеющую боран с одной стороны и станнан с другой, что позволяет проводить реакцию Стилле с последующим сочетанием Сузуки.
Вариации
Помимо проведения реакции в различных органических растворителях, были разработаны условия, которые позволяют использовать широкий диапазон сочетаний Стилле в водном растворителе.[14]
В присутствии солей Cu (I) палладий на угле было показано, что это эффективный катализатор.[61][62]
В сфере зеленая химия Сообщается, что реакция Стилле происходит в легкоплавкой и высокополярной смеси сахара, такой как маннитол, а мочевина такие как диметилмочевина и соль, такая как хлорид аммония[63].[64] Каталитическая система трис (дибензилиденацетон) дипалладий (0) с трифениларсин:
Стилле-карбонилированное кросс-сочетание
Распространенным изменением муфты Stille является включение карбонил группа между R1 и R2, служащий эффективным методом для формирования кетоны. Этот процесс очень похож на первоначальное исследование Migita и Stille (см. Историю) сочетания станнана с ацилхлориды. Однако эти фрагменты не всегда легко доступны, и их может быть трудно сформировать, особенно в присутствии чувствительных функциональные группы. Кроме того, может быть сложно контролировать их высокую реактивность. Соединение Стилле-карбонилирование происходит в тех же условиях, что и соединение Стилле, за исключением того, что в атмосфере монооксид углерода (CO) используется. CO может координироваться с палладиевым катализатором (9) после первоначального окислительного добавления с последующим Вставка CO в Pd-R1 связь (10), в результате чего восстановительное устранение к кетону (12). В трансметалляция шаг обычно этап определения ставки.[6]
Ларри Оверман и коллеги используют перекрестное связывание Стилле-карбонилирование в своих 20-этапных энантиоселективный полный синтез из стрихнин. Добавленный карбонил позже превращается в концевой алкен через Реакция Виттига, что позволяет формировать ключевой третичный азот и пентациклическое ядро через аза-Справиться-Реакция Манниха.[6][65]
Джорджио Ортар и др. исследовали, как перекрестное связывание с карбонилированием Стилле может быть использовано для синтеза бензофенон фосфоры. Они были включены в 4-бензоил-L-фенилаланин. пептиды и использовались из-за их фотоаффинных свойств мечения для изучения различных пептидно-белковых взаимодействий.[6][66]
16 шагов Луи Хегедуса рацемический полный синтез джатрафона включает в себя перекрестное связывание с карбонилированием Стилла в качестве заключительной стадии образования 11-членного макроцикл. Вместо града в качестве связующего звена используется винилтрифлат.[6][67]
Муфта Стилла – Келли
Используя основополагающую публикацию Eaborn в 1976 г., который образует арилстаннаны из арилгалогенидов и дистаннанов, Т. Росс Келли применил этот процесс к внутримолекулярный сочетание арилгалогенидов. Это тандемное сочетание станнилирование / арилгалогенид использовали для синтеза различных дигидрофенантренов. Большинство образующихся внутренних колец ограничено 5 или 6 членами, однако сообщалось о некоторых случаях макроциклизации. В отличие от обычного соединения Стилле, хлор не работает как галоген, возможно, из-за его более низкой реакционной способности в галоген последовательность (более короткая длина связи и более сильная энергия диссоциации связи затрудняют разрыв через окислительная добавка). Начиная с середины схемы ниже и двигаясь по часовой стрелке, палладиевый катализатор (1) окислительно добавляет к наиболее реактивной связи C-X (13) сформировать 14, с последующим трансметалляция с дистананнане (15) уступить 16 и восстановительное устранение чтобы получить арилстаннан (18). Регенерированный палладиевый катализатор (1) может окислительная добавка ко второй связи C-X 18 формировать 19с последующим внутримолекулярным трансметалляция уступить 20, с последующим восстановительное устранение чтобы получить связанный продукт (22).[6]
Джи Джек Ли и др. использовали сочетание Стилла-Келли в своем синтезе различных кольцевых систем бензо [4,5] фуропиридинов. Они вызывают трехэтапный процесс, включающий Аминирование Бухвальда-Хартвига, еще один реакция сочетания, катализируемая палладиемс последующим внутримолекулярным взаимодействием Стилла-Келли. Обратите внимание, что арил-йодидная связь будет окислительно добавить к палладий быстрее, чем любая из арилбромидных связей.[6][68]
Смотрите также
- Оловоорганическая химия
- Добавка органостаннана
- Катализируемые палладием реакции сочетания
- Сузуки реакция
- Муфта Негиши
- Чертовски реакция
- Муфта Хияма
Рекомендации
- ^ Хартвиг, Дж. Ф. Химия органических переходных металлов, от связывания до катализа; Научные книги университета: Нью-Йорк, 2010. ISBN 189138953X
- ^ а б Стилле, Дж. К. Энгью. Chem. Int. Эд. Англ. 1986, 25, 508–524. (Рассмотрение)
- ^ Фарина, В .; Кришнамурти, V .; Скотт, В. Дж. Орг. Реагировать. 1998, 50, 1–652. (Рассмотрение)
- ^ Scott, W. J .; Crisp, G.T .; Стилле, Дж. К. Органический синтез, Сб. Vol. 8, стр. 97 (1993); Vol. 68, стр. 116 (1990). (Статья)
- ^ Stille, J. K .; Эчаваррен, А. М .; Williams, R.M .; Хендрикс, Дж. А. Органический синтез, Сб. Vol. 9, с. 553 (1998); Vol. 71, стр.97 (1993). (Статья)
- ^ а б c d е ж грамм час я j k л Kurti, L .; Чако, Б. Стратегические применения названных реакций в органическом синтезе; Эльзевир: Берлингтон, 2005.
- ^ Митчелл, Т. J. Organomet. Chem., 1986, 304, 1-16.
- ^ а б Митчелл, Т. Синтез, 1992, 803-815. (Дои:10.1055 / с-1992-26230)
- ^ а б Фарина, В. Pure Appl. Chem., 1996, 68, 73–78. (Дои:10.1351 / pac199668010073).
- ^ а б c d е ж грамм час я j k л м п о п Фарина, В .; Кришнамурти, V .; Скотт, В. Дж. Реакция Стиля; Wiley: Online, 2004. (Дои:10.1002 / 0471264180.or050.01).
- ^ а б c d е ж грамм час я Espinet, P .; Эчаваррен, А.М. Энгью. Chem. Int. Эд., 2004, 43, 4704–4734.(Дои:10.1002 / anie.200300638)
- ^ Pattenden, G .; Синклер, Д. Дж. J.Organomet. Chem., 2002, 653, 261-268.
- ^ Kosugi, M .; Фугами, К. J. Organomet. Chem., 2002, 19, 10-16.
- ^ а б Pierre Genet, J .; Савиньяк, М. J. Organomet. Chem., 1999, 576, 305-317.
- ^ Кордова, С .; Bartolomé, C .; Martínez-Ilarduya, J.M ..; Эспине, П. ACS Catal., 2015, 5, 3040–3053.(Дои:10.1021 / acscatal.5b00448).
- ^ Азарян, Д .; Dua, S. S .; Eaborn, C .; Уолтон, Д. Р. М. J. Organomet. Chem., 1976, 117, C55-C57. (Дои:10.1016 / S0022-328X (00) 91902-8)
- ^ Kosugi, M .; Shimizu, Y .; Мигита, Т. Chem. Lett., 1977, 6, 1423-1424. (Дои:10.1246 / cl.1977.1423)
- ^ а б Kosugi, M .; Sasazawa, K .; Shikizu, Y .; Мигита, Т. Chem. Lett., 1977, 6, 301-302. (Дои:10.1246 / класс.1977.301)
- ^ Kosugi, M .; Shimizu, Y .; Мигита, Т. J. Organomet. Chem., 1977, 129, C36-C38. (Дои:10.1016 / S0022-328X (00) 92505-1)
- ^ Milstein, D .; Стилле, Дж. К. Варенье. Chem. Soc., 1978, 100, 3636-3638. (Дои:10.1021 / ja00479a077)
- ^ Milstein, D .; Стилле, Дж. К. Варенье. Chem. Soc., 1979, 101, 4992-4998. (Дои:10.1021 / ja00511a032)
- ^ Milstein, D .; Стилле, Дж. К. J. Org. Chem., 1979, 44, 1613-1618. (Дои:10.1021 / jo01324a006)
- ^ Casado, A. L .; Espinet, P .; Гальего, А.М. J. Am, Chem. Soc., 2000, 122, 11771-11782. (Дои:10.1021 / ja001511o)
- ^ а б Крэбтри, Р. Х. Металлоорганическая химия переходных металлов., 5 изд .; Wiley: Нью-Йорк, 2009.
- ^ а б Perez-Temprano, M. H .; Гальего, А. М .; Casares, J. A .; Эспине, П. Металлоорганические соединения, 2011, 30, 611-617. (Дои:10.1021 / om100978w).
- ^ Миннити, Д. Неорг. Chem, 1994, 33, 2631-2634.(Дои:10.1021 / ic00090a025).
- ^ Casado, A. L .; Эспине, П. Металлоорганические соединения, 1998, 17, 954-959. (Дои:10.1021 / om9709502).
- ^ а б c Гарсия-Мельчор, М .; Braga, A.A.C .; Lledos, A .; Ujaque, G .; Мазерас, Ф. Соотв. Chem. Res., 2013, 46, 2626-2634. (Дои:10.1021 / ar400080r)
- ^ а б c d Гилли, А .; Стилле, Дж. К. Варенье. Chem. Soc., 1980, 102, 4933-4941. (Дои:10.1021 / ja00535a018).
- ^ а б c d Brown, J.M .; Кули, Н.А. Chem. Ред., 1988, 88, 1031-1046. (Дои:10.1021 / cr00089a003).
- ^ McKillop, A .; Abel, E.W .; Stone, F.G.A .; Уилкинсон, Г. Комплексная металлоорганическая химия II, Elsevier Scientific: Оксфорд, 1995.
- ^ а б Фарина, В .; Варенье. Chem. Soc., 1991, 113, 9585-9595. (Дои:10.1021 / ja00025a025).
- ^ а б http://hwpi.harvard.edu/files/myers/files/11-the_stille_reaction.pdf
- ^ Либескинд, Л. С .; Фенгл, Р.В. J. Org. Chem., 1990, 55, 5359-5364. (Дои:10.1021 / jo00306a012).
- ^ Фарина, В .; Kapadia, S .; Brishnan, B .; Wang, C .; Либескинд, Л.С. J, Org. Chem, 1994, 59, 5905-5911. (Дои:10.1021 / jo00099a018).
- ^ а б Mee, S.P.H .; Ли, В .; Болдуин, Дж. Э. Энгью. Chem. Int. Эд., 2004, 43, 1132-1136.
- ^ Либескинд, Л. С .; Пенья-Кабрера, Э. Органический синтез, Сб. Vol. 10, стр.9 (2004); Vol. 77, с. 135 (2000). (Статья)
- ^ Scott, W. J .; Стилле, Дж. К. Варенье. Chem. Soc., 1986, 108, 3033-3040. (Дои:10.1021 / ja00271a037).
- ^ Johnson, C. R .; Adams, J. P .; Braun, M.P .; Сенанаяке, К. Б. У. Tetrahedron Lett., 1992, 33, 919-922. (Дои:10.1016 / S0040-4039 (00) 91576-4)
- ^ Наир, В .; Тернер, Г. А .; Чемберлен, С. Варенье. Chem. Soc., 1987, 109, 7223-7224. (Дои:10.1021 / ja00257a071).
- ^ Jousseaume, B .; Kwon, W .; Verlhac, J. B .; Denat, F .; Дубац, Дж. Synlett, 1993, 117-118. (Дои:10.1055 / с-1993-22368)
- ^ Шеффи, Ф. К .; Godschalx, J. P .; Стилле, Дж. К. Варенье. Chem. Soc., 1984, 106, 4833-4840. (Дои:10.1021 / ja00329a032)
- ^ http://www.sigmaaldrich.com/chemistry/chemistry-products.html?TablePage=16246425
- ^ Дитмар Сейферт (1959). "Ди-п-бутилдивинилолово ". Орг. Синтезатор. 39: 10. Дои:10.15227 / orgsyn.039.0010.
- ^ Wolf, C .; Леребур, Р. J. Org. Chem., 2003,68 7551-7554. (Дои:10.1021 / jo0347056).
- ^ Crisp, G.T .; Глинк, П.Т. Тетраэдр, 1994, 50, 2623. (Дои:10.1016 / S0040-4020 (01) 86978-7)
- ^ Бейли, Т. Tetrahedron Lett., 1986, 27, 4407. (Дои:10.1016 / S0040-4039 (00) 84964-3).
- ^ Bao, Z .; Чан, Вт .; Ю, Л. Chem. Матер., 1993, 5, 2-3. (Дои:10.1021 / см 00025a001).
- ^ Bao, Z .; Chan, W. K .; Ю., Л. Варенье. Chem. Soc., 1995, 117, 12426-12435. (Дои:10.1021 / ja00155a007).
- ^ Sun, S. S .; Lewis, J. E .; Zhang, J .; Цзян, X .; Zhang, C .; Matos, T .; Li, R .; Polym. Chem., 2010, 1, 663-669. (Дои:10.1039 / B9PY00324J)
- ^ Lebsack, A.D .; Link, J. T .; Overman, L.E .; Стернс, Б.А. Варенье. Chem. Soc., 2002, 124, 9008-9009. (Дои:10.1021 / ja0267425)
- ^ Masse, C.E .; Ян, М .; Соломон, Дж .; Панек, Дж. С. Варенье. Chem. Soc., 1998, 120, 4123-4134. (Дои:10.1021 / ja9743194)
- ^ Мартин, С. Ф .; Хамфри, Дж. М .; Али, А .; Хиллер, М.С. Варенье. Chem. Soc., 1999, 121, 866-867. (Дои:10.1021 / ja9829259)
- ^ Kende, A. S .; Kawamura, K .; ДеВита, Р. Дж. Варенье. Chem. Soc., 1990, 112 4070-4072. (Дои:10.1021 / ja00166a072).
- ^ Kende, A. S., Koch, K .; Дори, G .; Kaldor, I .; Лю, К. Варенье. Chem. Soc., 1993, 115, 9842-9843. (Дои:10.1021 / ja00074a078).
- ^ Хонг, К. И, Киши, Ю. Варенье. Chem. Soc., 1991, 113, 9693-9694. (Дои:10.1021 / ja00025a056).
- ^ Tanimoto, N .; Герриц, С. У .; Sawabe, A .; Нода, Т .; Filla, S.A .; Масамунэ, С. Энгью. Chem. Int. Эд., 2003, 33, 673-675. (Дои:10.1002 / anie.199406731).
- ^ Эванс, Д. А .; Блэк, У.С. Варенье. Chem. Soc., 1993, 115, 4497-4513. (Дои:10.1021 / ja00064a011).
- ^ Tang, W .; Прусов, Э.В. Орг. Lett., 2012, 14 4690-4693. (Дои:10.1021 / ol302219x).
- ^ Coleman, R. S .; Walczak, M.C .; Кэмпбелл, Э. Варенье. Chem. Soc., 2005, 127, 16036-16039. (Дои:10.1021 / ja056217g).
- ^ Roth, G.P .; Фарина, В .; Либескинд, Л. С .; Пенья-Кабрера, Э. Tetrahedron Lett. 1995, 36, 2191.
- ^ Renaldo, A. F .; Labadie, J. W .; Стилле, Дж. К. Органический синтез, Сб. Vol. 8, стр. 268 (1993); Vol. 67, стр.86 (1989). (Статья)
- ^ Стилле-реакции с тетраалкилстаннанами и фенилтриалкилстаннанами в легкоплавких смесях сахар-мочевина-сольДжованни Императо, Рудольф Васольд, Буркхард Кениг Расширенный синтез и катализ Том 348, выпуск 15, страницы 2243–47 2006 Дои:10.1002 / adsc.2006
- ^ П. Эспине, А. М. Эчаваррен (2004). «Механизмы реакции стилля». Angewandte Chemie International Edition. 43 (36): 4704–4734. Дои:10.1002 / anie.200300638. PMID 15366073.
- ^ Knight, S.D .; Overman, L.E .; Пайродо, Г. Варенье. Chem. Soc., 1993, 115, 9293-9294. (Дои:10.1021 / ja00073a057)
- ^ Monera, E .; Ортар, Г. Биорг. Med. Chem. Lett., 2000, 10, 1815-1818. (Дои:10.1016 / S0960-894X (00) 00344-9).
- ^ Gyorkos, A.C .; Stille, J. K .; Хегедус, Л.С. Варенье. Chem. Soc., 1990, 112, 8465-8472. (Дои:10.1021 / ja00179a035).
- ^ Yue, W. S .; Ли, Дж. Дж. Орг. Lett., 2002, 4, 2201-2203. (Дои:10.1021 / ol0260425)
внешняя ссылка
- Раздаточный материал реакции Стилла из группы Майерс.
- Стилле реакция на organic-chemistry.org
- Реакция Стилле - Синтетические протоколы из organic-reaction.com
![Общая схема реакции Стилле { displaystyle { color {Blue} { ce {R ^ {1} -Sn (Alkyl) 3}}} + { color {Red} { ce {R ^ {2} -X}}} { ce {-> [{ color {Green} { ce {Pd ^ {0}}}} { text {(каталитический)}}] [{ text {набор лигандов}}]}} overbrace { { color {Blue} { ce {R ^ {1}}}} ! - ! { color {Red} { ce {R ^ {2}}}}} ^ {connected product} + { color {Red} { ce {X}}} ! - ! { color {Blue} { ce {Sn (алкил) 3}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5baabb66db61c2d31fa2a5ca2b4e8156ee7c4133)































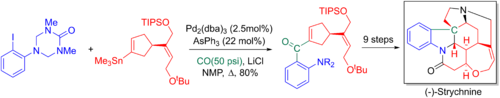



![Синтез бензо [4,5] фуропиридинов.](http://upload.wikimedia.org/wikipedia/commons/thumb/2/25/Benzofuropyridines.png/500px-Benzofuropyridines.png)