WikiDer > Аммиачная селитра церия
 | |
| Имена | |
|---|---|
| Название ИЮПАК Нитрат диаммония церия (IV) | |
| Другие имена Нитрат аммония церия (CAN) | |
| Идентификаторы | |
3D модель (JSmol) | |
| ChemSpider | |
| ECHA InfoCard | 100.037.100 |
| Номер ЕС |
|
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| ЧАС8N8Исполнительный директор18 | |
| Молярная масса | 548.218 г · моль−1 |
| Внешность | оранжево-красные кристаллы |
| Температура плавления | От 107 до 108 ° C (от 225 до 226 ° F, от 380 до 381 K) |
| 141 г / 100 мл (25 ° С) 227 г / 100 мл (80 ° С) | |
| Структура | |
| Моноклиника | |
| Икосаэдр | |
| Опасности | |
| Пиктограммы GHS |   [1] [1] |
| Сигнальное слово GHS | Опасность |
| H272, H302, H315, H319, H335 | |
| P220, P261, P305 + 351 + 338 | |
| Родственные соединения | |
Родственные соединения | Нитрат аммония Оксид церия (IV) |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Аммиачная селитра церия (CAN) - это неорганическое соединение с формулой (NH4)2Ce (НЕТ3)6. Этот оранжево-красный водорастворимый церий соль специализированный окислитель в органический синтез и стандартный окислитель в количественный анализ.
Подготовка, свойства и структура
В анион [Ce (НЕТ
3)
6]2−
образуется путем растворения Ce
2О
3 в горячем концентрированном HNO3.
Соль состоит из аниона [Ce (НЕТ
3)
6]2−
и пара NH4+ противоионы. Ионы аммония не участвуют в окислительных реакциях этой соли. В анионе каждая нитратная группа хелатный к атому церия в двузубый как показано ниже:
Анион [Ce (НЕТ
3)
6]2−
имеет Tчас (идеализированный Oчас) молекулярная симметрия. Генеральный директор12 ядро определяет икосаэдр.[2]
Ce4+ это сильный одноэлектронный окислитель. По своему окислительно-восстановительному потенциалу (E ° ~ 1,61 В по сравнению с N.H.E.) это даже более сильный окислитель, чем Cl2 (Е ° ~ 1,36 В). Некоторые реагенты длительного хранения являются более сильными окислителями. В окислительно-восстановительном процессе Се (IV) превращается в Се (III), одноэлектронное изменение, о чем свидетельствует изменение цвета раствора от оранжевого до бледно-желтого (при условии, что субстрат и продукт не сильно окрашены).
Приложения в органической химии
В органическом синтезе CAN полезен как окислитель для многих функциональных групп (спирты, фенолы, и эфиры), а также связи C – H, особенно бензильные. Алкенес подвергаются динитроксилированию, хотя результат зависит от растворителя. Хиноны производятся из катехины и гидрохиноны и даже нитроалканы окисляются.
CAN представляет собой альтернативу Неф реакция; например, для кетомакролид синтез, при котором обычно возникают осложнения побочных реакций с использованием других реагентов. CAN может способствовать окислительному галогенированию. на месте окислитель для бензильного бромирования и йодирования кетонов и урацил производные.
Для синтеза гетероциклов
Каталитические количества водного CAN позволяют эффективно синтезировать хиноксалин производные. Хиноксалины известны своим применением в качестве красителей, органические полупроводники, и агенты, расщепляющие ДНК. Эти производные также входят в состав антибиотиков, таких как эхиномицин и актиномицин. Катализируемая CAN трехкомпонентная реакция между анилины и алкилвиниловые эфиры обеспечивает эффективное вхождение в 2-метил-1,2,3,4-тетрагидрохинолины и соответствующие хинолины полученный их ароматизация.
В качестве реагента для снятия защиты
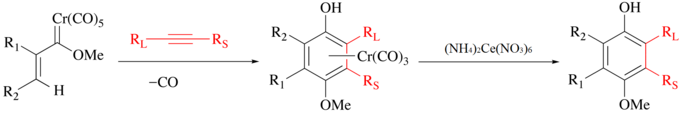
CAN традиционно используется для высвобождения органических лигандов из карбонилы металлов. При этом металл окисляется, выделяется CO, и органический лиганд высвобождается для дальнейших манипуляций.[3] Например, с Реакция Вульфа-Дёца алкин, окись углерода и хром карбен объединяются в хром полусэндвич-комплекс[4][5] и фенольный лиганд можно выделить мягким окислением CAN.
CAN используется для расщепления параграф-метоксибензиловый и 3,4-диметоксибензиловый эфиры, которые являются защитные группы для спиртов.[6][7] Для каждого эквивалента CAN требуется два эквивалента. параграф-метоксибензиловый эфир. Выделяется алкоголь, и параграф-метоксибензиловый эфир превращается в параграф-метоксибензальдегид. Сбалансированное уравнение выглядит следующим образом:
- 2 (NH4)2Ce (НЕТ3)6 + H3КОК6ЧАС4CH2ИЛИ + H2O → 4 NH4+ + 2 CE3+ + 12 НЕТ3− + 2 часа+ + H3КОК6ЧАС4CHO + HOR
Другие приложения
CAN также является компонентом хром травить,[8] материал, который используется в производстве фотошаблоны и жидкокристаллические дисплеи.[нужна цитата]
Рекомендации
- ^ Сигма-Олдрич Ко., Аммоний-церия (IV) нитрат. Проверено 13 мая 2015.
- ^ Томас А. Бейнеке; Х. Дельгаудио (1968). «Кристаллическая структура нитрата аммония церия». Неорг. Chem. 7 (4): 715–721. Дои:10.1021 / ic50062a020.
- ^ L. Brener, J. S. McKennis и R. Pettit "Циклобутадиен в синтезе: эндо-трицикло [4.4.0.02,5] дека-3,8-диен-7,10-дион" Org. Synth. 1976, 55, 43.Дои:10.15227 / orgsyn.055.0043
- ^ Waters, M .; Вульф, В. Д. (2008). «Синтез фенолов и хинонов через карбеновые комплексы Фишера». Органические реакции. 70 (2): 121–623. Дои:10.1002 / 0471264180.or070.02.
- ^ Дётц, К. Х. (1983). «Формирование углерод-углеродной связи посредством карбонил-карбеновых комплексов». Чистая и прикладная химия. 55 (11). Дои:10.1351 / pac198355111689.
- ^ Бунс, Герт-Ян .; Хейл, Карл Дж. (2000). Органический синтез с углеводами (1-е изд.) Шеффилд, Англия: Sheffield Academic Press. стр.33
- ^ Коценски, Филипп Дж. (1994). Защита групп Штутгарт, Нью-Йорк Георг Тим Верлаг. стр. 8-9, 52-54
- ^ Уокер, Перрин; Уильям Х. Тарн (1991). Справочник CRC по травильным материалам для металлов. стр.287–291. ISBN 0-8493-3623-6.