WikiDer > Тиосульфат аммония
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Диаммоний тиосульфат | |||
| Другие имена Тиосульфат аммония, САР | |||
| Идентификаторы | |||
3D модель (JSmol) | |||
| ЧЭБИ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.029.074 | ||
PubChem CID | |||
| UNII | |||
| |||
| |||
| Характеристики | |||
| ЧАС8N2О3S2 | |||
| Молярная масса | 148.20 г · моль−1 | ||
| Внешность | бесцветное или белое твердое вещество | ||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
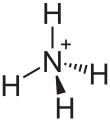
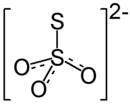
Тиосульфат аммония (тиосульфат аммония в Британский английский) является неорганическое соединение с формулой (NH4)2S2О3. Он белый кристаллический твердый с аммиак запах, легко растворимый в воды, слабо растворим в ацетон и нерастворим в этиловый спирт и диэтиловый эфир.[1]
Производство
Производится путем обработки сульфит аммония с серой:[2]
- (NH4)2ТАК3 + S → (NH4)2S2О3
Приложения
Тиосульфат аммония используется в фотографический фиксатор. Это так называемый быстрый фиксатор, действующий быстрее, чем тиосульфат натрия фиксаторы.[3] Фиксация включает в себя эти химические реакции (показано для бромид серебра):[4]
- AgBr + 2 (NH4)2S2О3 → (NH4)3[Ag (S2О3)2] + NH4Br
- AgBr + 3 (NH4)2S2О3 → (NH4)5[Ag (S2О3)3] + NH4Br
Тиосульфат аммония также используется для выщелачивание из золото и серебро. Работает при наличии медь как катализатор здесь. Этот процесс - нетоксичная альтернатива цианирование золота.[5] Преимущество тиосульфата аммония состоит в том, что пиролиз его комплексов серебра оставляет остаток только сульфида серебра, в отличие от комплексов, полученных из тиосульфата натрия.[2]
Другой
Тиосульфат аммония можно использовать в качестве удобрение.[6] Как показывают некоторые исследования, его можно использовать в качестве добавки к каменный уголь-напрасно тратить смеси для уменьшения образования очень опасных диоксины и фураны.[7]
Безопасность
LD50 (перорально, крыса) - 2890 мг / кг.[2]
Смотрите также
Рекомендации
- ^ Паспорт безопасности материалов - тиосульфат аммония
- ^ а б c Дж. Дж. Барбера; А. Мецгер; М. Вольф (2012). «Сульфиты, тиосульфаты и дитиониты». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a25_477.
- ^ Praní černobílých filmů a papírů
- ^ Келлер, Карлхайнц (2005). «Фотография». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a20_001.
- ^ Эйлмор, М.Г .; Мьюир, Д.М. (2001). «Тиосульфатное выщелачивание золота - обзор». Минерал Инжиниринг. 14 (2): 135–174. Дои:10.1016 / S0892-6875 (00) 00172-2.
- ^ McCarty, G.W .; Bremner1, J.M .; Крогмайер1, М. Дж. (1990). «Оценка тиосульфата аммония как ингибитора почвенной уреазы». Исследование удобрений. 24 (3): 135–139. Дои:10.1007 / BF01073581. S2CID 28574791.
- ^ Вельгосинский, Гжегож (2011). «Снижение выбросов диоксинов от процессов производства тепла и электроэнергии». Журнал Ассоциации управления воздухом и отходами. 61 (5): 511–526. Дои:10.3155/1047-3289.61.5.511. PMID 21608491. S2CID 44546628.