WikiDer > Barrelene
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Бицикло [2.2.2] окта-2,5,7-триен | |||
| Идентификаторы | |||
3D модель (JSmol) | |||
| ChemSpider | |||
PubChem CID | |||
| UNII | |||
| |||
| |||
| Характеристики | |||
| C8ЧАС8 | |||
| Молярная масса | 104.15 | ||
| Плотность | 1,013 г / мл | ||
| Точка кипения | 153,7 ° С (308,7 ° F, 426,8 К) | ||
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Barrelene это бициклический органическое соединение с химическая формула C8ЧАС8 и систематическое название бицикло [2.2.2] окта-2,5,7-триен. Впервые синтезировано и описано Говард Циммерман в 1960 году название происходит от сходства с бочкас тремя шестами этилен единицы прикреплены к двум метин группы. Это формальный Дильс – Альдер присоединение бензол и ацетилен. Из-за своего необычного молекулярная геометрия, соединение представляет значительный интерес для химиков-теоретиков.
Иптицены, с алкеновыми группами, входящими в состав арены, являются родственными соединениями. Он также является исходным материалом для многих других органических соединений, таких как полубулвален.
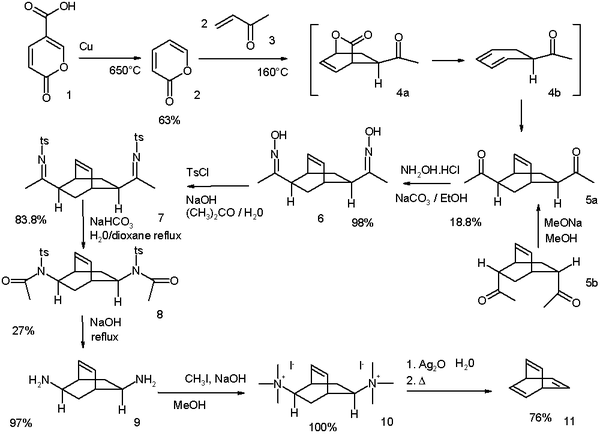
Оригинальный Циммерман, модифицированный в 1969 г.,[1] начинается с кумаловая кислота:[2]
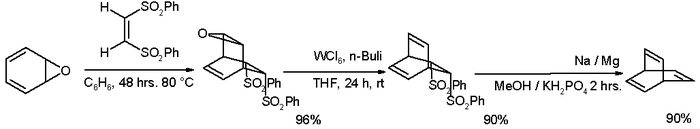
С тех пор было разработано много альтернативных маршрутов, один из которых начинался с оксепин:[3][4]
Также сообщалось об альтернативном пути, который позволяет синтезировать исходную систему барреленов и различных замещенных барреленов.[5]
Реакции баррелена
Баррелин гидрогенизированный с газообразным водородом и Катализатор Адамса в этиловый спирт к полностью насыщенному бицикло [2.2.2] -октан. Бромирование с бром в тетрахлорметан дает дибромный аддукт, потому что реакция сочетания вмешивается:
Эпоксидирование баррелена с оксон дает триоксатришомобаррелен[6] который на перестановка с трифторид бора (движущая сила: облегчение энергия деформации) превращается в триоксатришомокубан:[7]
Это соединение можно представить как кубан с тремя атомами кислорода, вставленными в три противоположных края, или как 9-крон-3 ограничен двумя метин единицы. Молекула хиральный и отдельный энантиомеры были изолированы.
Некоторые баррелены использовались в качестве мономер в метатезисная полимеризация с раскрытием цикла :[8] [9]
Катализатор - это Карбен Фишера (а молибденовый бис- (гексафтор-трет-бутокси) карбеновый катализатор) и длинная алкильная цепь, присоединенная к мономеру, необходима для растворимости. Окисление полимера DDQ дает нафталиновую подвеску поли (п-фенилен винилен).
Изопентан растворы баррелена проходят фотолитический изомеризация когда ацетон добавляется как фотосенсибилизатор производить полубулвален. Продолжительное облучение приводит к дальнейшей изомеризации с образованием циклооктатетраен.[10]
Рекомендации
- ^ Синтез и физические свойства баррелена, уникальной молекулы типа Мебиуса Ховард Э. Циммерман, Гэри Л. Грюневальд, Роберт М. Пауфлер, Мейнард А. Шервин Варенье. Chem. Soc.; 1969; 91(9); 2330–2338. Дои:10.1021 / ja01037a024
- ^ Схема реакции: декарбоксилирование из кумаловая кислота (1) происходит при 650 ° C с медь дать α-пирон (2). Реакция с метилвинилкетон (3) тандем Дильс – Альдер/ ретро-последовательность Дильса – Альдера / Дильса – Альдера, которая дает ди-кетон 5 как смесь двух изомеры. Возможно преобразование эндо-изомер 5b к экзо-изомеру 5a посредством эпимеризация процесс через энол. Кетоновые группы превращаются в оксим групп в 6 по реакции с гидроксиламин а затем в тозилат групп в 7 по реакции с тозилхлорид. Базовый Перестановка Бекмана берет схему, чтобы дать амид 8 и его гидролиз к ди-амин 9 проходит с едкий натр. Наконец, Устранение Хофмана через аммониевая соль 10 дает бочонок 11.
- ^ Баррелен, новый удобный синтез Серхио Коссу, Симоне Баттаджиа и Отторино де Лучки J. Org. Chem.; 1997; 62 (12) pp 4162–4163; Дои:10.1021 / jo962267f
- ^ Шаг первый в этой реакции между оксепин (один из возможных таутомеры) с (Z) -1,2-бис (фенилсульфонил) этилен представляет собой Реакция Дильса – Альдера. Реагенты для деэпоксидирование находятся гексахлорид вольфрама и бутиллитий. Второй реакция элиминации происходит с амальгама натрия в Юлия олефинирование стиль.
- ^ Синтез замещенных бицикло [2.2.2] октатриенов. Майкл В. Вагаман, Эрика Беллманн, Мишель Кукулу и Роберт Х. Граббс J. Org. Chem.; 1997; 62 (26) pp 9076–9082; Дои:10.1021 / jo971039y
- ^ эндо, экзо, син-3,7,10-Триоксапентацикло [3.3.3.02,4.06,8.09,11] ундекан
- ^ 4,7,11-Тригетеротришомокубаны - высоко симметричные киральные молекулы пропеллерной формы, полученные из баррелена Кожушков Сергей Иванович и др. Европейский журнал органической химии, том 2006, Выпуск 11, страницы 2590 - 2600 Абстрактный
- ^ Синтез поли (1,4-нафтиленвиниленов): метатезисная полимеризация бензобарреленов Линь Пу, Майкл В. Вагаман и Роберт Х. Граббс Макромолекулы; 1996; 29 (4), стр. 1138–1143; (Статья) Дои:10.1021 / ma9500143
- ^ Синтез органических и водорастворимых поли (1,4-фениленвиниленов), содержащих карбоксильные группы: метатезис-полимеризация с раскрытием живого цикла (ROMP) 2,3-дикарбоксибарреленов Майкл В. Вагаман и Роберт Х. Граббс Макромолекулы; 1997; 30 (14) pp 3978–3985; (Статья) Дои:10.1021 / ma9701595
- ^ Zimmerman, H.E .; Грюневальд, Г. Л. (1966). "Химия баррелена. III. Уникальная фотоизомеризация в семибулвален". Варенье. Chem. Soc. 88 (1): 183–184. Дои:10.1021 / ja00953a045.