WikiDer > Перестановка ручья
В органическая химия то Перестановка ручья относится к миграции любого [1, n] углерода в силильный кислород. В перестановка был впервые обнаружен в конце 1950-х годов канадским химиком. Адриан Гиббс Брук (1924–2013), в честь которого названа реакция.[1] Этим миграциям можно способствовать множеством различных способов, в том числе термически, фотолитически или в основных / кислотных условиях.[2] В прямом направлении эти силильные миграции производят силиловые эфиры как продукты, которые обусловлены стабильностью связи кислород-кремний.
Силильные заместители могут быть алифатический или же ароматный, а если кремний является центром хиральность, миграция происходит с удержанием в этом центре. Эта миграция происходит через переходное состояние где кремний пента-координировать и несет частичный отрицательный заряд.[3] Если центр хиральности присутствует в углеродном центре, к которому присоединена силильная группа, то в этом центре происходит инверсия. В качестве примера, если (триметилсилил) метанол должен быть депротонирован, произойдет перегруппировка [1,2] -Брука.
Механизм реакции
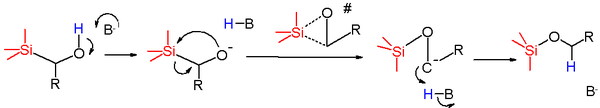
В механизм реакции поскольку эта перегруппировка зависит от условий, используемых для воздействия на перегруппировку, и природы исходного материала.[2] Анионные перегруппировки являются наиболее часто наблюдаемыми перегруппировками Брука, и их механизмы можно разбить на две общие категории. Первая категория начинается с протонной абстракции ближайшего гидроксил группа по основание. Это порождает алкоксид который затем действует как нуклеофил и атакует атом кремния в нуклеофильное смещение реакция, с метиленовой группой, действующей как уходящая группа. Созданный карбанион затем протонируется частицами H-B с образованием продукта. В случае, когда используемое основание расходуется в реакции (т.е. Бутиллитий), то карбанион может действовать как основание для дальнейшего депротонирования исходного материала с образованием конечного продукта.
Предлагаемое переходное состояние для этой стадии реакции представляет собой трехчленное кольцо со значительным накоплением отрицательного заряда на атоме углерода и атоме кремния, как показано Hammett сигма и ро исследования. Эта реакция обычно протекает с низкой энергией активации и большим отрицательным энтропия активации. Это дополнительно поддерживает циклическое трехэлементное переходное состояние, поскольку оно будет значительно более упорядоченным, чем основное состояние исходного материала. Реакция протекает с общим удерживанием в центре кремния, как показано с помощью Цикл Уолдена (показано ниже). Это поддерживает пентакоординированный кремний как часть механизма, поскольку тригонально-бипирамидный Геометрия вокруг кремния с одной из осей O или C и другой экваториальной может объяснить наблюдаемое сохранение конфигурации в центре кремния. Этот механизм также протекает с инверсией в углеродном центре.
Эта реакция, как известно, обратима. В зависимости от относительной стабильности образующихся карбаниона и оксианиона, силиловый эфир вполне способен перегруппировываться в частицы, в которых кремний связан с атомом углерода, и присутствует свободный спирт. Это можно было бы назвать перестройкой Ретро-Ручья.
Вторая категория анионных перестроек ручья связана с нуклеофильной атакой на зр2 гибридизированный центр для образования окси-аниона, на два атома удаленных от атома кремния. Затем это может пройти внутримолекулярный атака окси-анионом с образованием силилового эфира, но окончательная судьба карбаниона часто зависит от рассматриваемого субстрата. Например, попытка выполнить Реакция Виттига на ацилсилан приводит к формированию силиловый эфир енола вместо ожидаемого алкена из-за отщепления карбанионом вместо протонирования, как показано выше.
Было показано, что перегруппировка Брука происходит с сохранение конфигурации в кремниевом центре, как показано в следующем цикле Уолдена:
Известно, что на всех этапах этого цикла сохраняется конфигурация, за исключением атаки литиевого реагента (которая происходит путем инверсии) и перегруппировки Брука, которая исследуется. Начав с хирального кремния известной конфигурации, можно определить стереохимию реакции, глядя на удельное вращение восстановленного силана. Поскольку известно, что атака литиевым реагентом происходит с инверсией, восстановленный силан должен быть противоположным. энантиомер исходного силана (одиночная инверсия), если перегруппировка Брука протекает с удерживанием, и того же энантиомера, если реакция протекает с инверсией (двойная инверсия). Экспериментально восстановленный силан был противоположным энантиомером, что показывает, что реакция протекает с удерживанием в центре кремния.
Объем
Перестройки ручья известны в ацилсиланы.[4] Помимо этого, ацилсиланы хорошо известны своим гидролизом в щелочном растворе до силанол и альдегид. Это происходит в результате перегруппировки Брука, инициированной атакой на карбонильная группа. Родственная реакция, включающая начальную атаку на центр кремния, вызывает миграцию одной из групп кремния к карбонильному углероду, что инициирует перегруппировку Брука. Если группа кремния была хиральной, конечным продуктом является хиральный силиловый эфир, поскольку происходит миграция стереоспецифично.
Перегруппировки, аналогичные перегруппировке Брука, известны для многих других типов атомов. К ним относятся азот, фосфор, и сера как нуклеофильный компонент, с бор и германий аналог известен как электрофильный компонент.
Рекомендации
- ^ Брук, А. Г. (1958). «Изомерия некоторых α-гидроксисиланов к силиловым эфирам». Варенье. Chem. Soc. 80 (8): 1886–1889. Дои:10.1021 / ja01541a026.
- ^ а б Брук, А.Г .; Бассиндейл, А. Р. (1980). «Глава 9. Молекулярные перегруппировки кремнийорганических соединений». Перестройки в основном и возбужденном состояниях, Том 2. Нью-Йорк: Academic Press. С. 149–221. ISBN 9781483218724.
- ^ Брук, А. Г. (1974). «Молекулярные перегруппировки кремнийорганических соединений». Соотв. Chem. Res. 7 (3): 77–84. Дои:10.1021 / ar50075a003.
- ^ Патросинио, Амаури Ф. и Моран, Пауло Дж. С. Ацилсиланы и их применение в органической химии. J. Braz. Chem. Soc., 2001, т. 12, № 1, с. 07-31. ISSN 0103-5053. Интернет-статья