WikiDer > Сонное тело
| Сонное тело | |
|---|---|
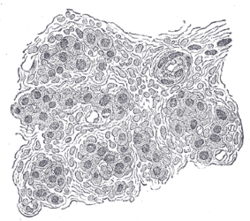 Разрез части сонной артерии человека. Сильно увеличено. В разрезе между клетками видны многочисленные кровеносные сосуды. | |
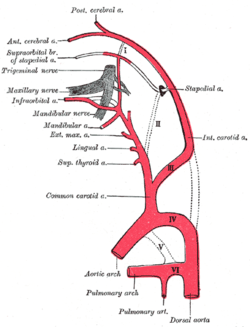 Диаграмма, показывающая истоки основных ветвей сонных артерий. | |
| Подробности | |
| Нерв | ветвь языкоглоточного нерва к сонному синусу |
| Идентификаторы | |
| латинский | Glomus Caroticum |
| MeSH | D002344 |
| TA98 | А12.2.04.007 |
| TA2 | 3886 |
| FMA | 50095 |
| Анатомическая терминология | |
В сонная артерия это небольшой кластер хеморецепторные клетки, и поддерживая стентакулярные клетки. Тело сонной артерии находится в адвентиция, в бифуркации (вилке) общая сонная артерия, который проходит по обе стороны шея.[1][2]
Каротидное тело обнаруживает изменения в составе артериальная кровь протекает через него, в основном парциальное давление артериального кислорода, но и углекислый газ. Он также чувствителен к изменениям в pH крови, и температура.
Структура
Каротидное тело состоит из двух типов клеток, называемых клетки клубочка: клетки glomus I типа периферические хеморецепторы, а клетки гломуса II типа являются сустентакулярный поддерживающие клетки.
- Клетки Glomus I типа происходят из нервный гребень.[3] Выпускают самые разные нейротрансмиттеры, включая ацетилхолин, АТФ, и дофамин этот триггер ВПСП в синапсированных нейронах, приводящих к дыхательный центр. Они иннервируются аксонами языкоглоточного нерва, которые в совокупности называются нервом каротидного синуса.
- Клетки Glomus II типа напоминают глиальные клетки, экспрессируйте глиальный маркер S100 и действуют как поддерживающие клетки.
Функция
Эта секция нужно больше медицинские справки за проверка или слишком сильно полагается на основные источники. (Октябрь 2019) |
Сонная артерия функционирует как сенсор: она реагирует на раздражитель, в первую очередь на O2 парциальное давление, которое определяется клетками типа I (гломус), и запускает потенциал действия сквозь афферентные волокна из языкоглоточный нерв, который передает информацию в центральную нервную систему.
Стимул
Каротидное тело периферические хеморецепторы в первую очередь чувствительны к понижению парциального давления кислорода (PО2). Это в отличие от центральные хеморецепторы в продолговатый мозг которые в первую очередь чувствительны к изменениям pH и PCO2 (снижение pH и увеличение PCO2). Хеморецепторы каротидного тела также чувствительны к pH и PCO2, но только во вторую очередь. В частности, чувствительность хеморецепторов каротидного тела к снижению PО2 больше при понижении pH и PCO2 увеличена.
Частота импульсов для каротидных тел особенно чувствительна к изменениям артериального РО2 в диапазоне от 60 до 30 мм рт. Ст., В диапазоне, в котором насыщение гемоглобина кислородом быстро снижается.[2]
Выход каротидных тел при кислородной частичное давление выше примерно 100 мм рт. ст. (13,3 kПа) (при нормальном физиологическом pH), но ниже 60 мм рт.ст. активность клеток типа I (гломус) быстро увеличивается из-за снижения сатурации гемоглобина и кислорода ниже 90%.
Обнаружение
Механизм обнаружения снижения PО2 еще предстоит идентифицировать, может быть несколько механизмов и они могут варьироваться между видами.[4] Гипоксия обнаружение зависит от увеличения сероводород поколение произведено цистатионин гамма-лиаза поскольку обнаружение гипоксии снижается у мышей, у которых этот фермент выключен или фармакологически ингибирован. Процесс обнаружения включает взаимодействие цистатионин гамма-лиазы с гемеоксигеназа-2 и производство монооксид углерода.[5] Тем не менее, некоторые исследования показывают, что физиологическая концентрация сероводорода может быть недостаточно высокой, чтобы вызвать такие реакции.
Другие теории предполагают, что это может быть связано с митохондриальными сенсорами кислорода и гемосодержащими цитохромами, которые претерпевают обратимое одноэлектронное восстановление во время окислительного фосфорилирования. Гем обратимо связывает O2 со сродством, аналогичным сродству каротидного тела, предполагая, что гем, содержащий белки, может играть роль в O2потенциально это может быть один из комплексов, участвующих в окислительно-фосфорилировании. Это приводит к увеличению количества активных форм кислорода и повышению внутриклеточного Ca2+. Однако неизвестно, приводит ли гипоксия к увеличению или уменьшению количества активных форм кислорода. Роль активных форм кислорода в восприятии гипоксии также находится под вопросом.[6]
Кислородзависимый фермент гемоксидаза также был предложен в качестве сенсора гипоксии. При нормоксии гемоксигеназа вырабатывает монооксид углерода (CO), CO активирует калиевый канал с большой проводимостью, активируемый кальцием, BK. Падение CO, которое происходит в результате гипоксии, приведет к закрытию этого калиевого канала, что приведет к деполяризации мембраны и, как следствие, к активации каротидного тела.[7] Роль «энергетического сенсора» AMP-активированной протеинкиназы (AMPK) также была предложена в восприятии гипоксии. Этот фермент активируется во время потребления чистой энергии и метаболического стресса, включая гипоксию. AMPK имеет ряд целей, и, по-видимому, в теле сонной артерии, когда AMPK активируется гипоксией, это приводит к закрытию нижележащих калиевых каналов обоих O2-сентивные ТАСК-подобные и БК каналы[8]
Повышенный PCO2 обнаруживается, потому что CO2 распространяется в клетку, где увеличивается концентрация угольная кислота и поэтому протоны. Точный механизм CO2 зондирование неизвестно, однако было продемонстрировано, что CO2 и низкий pH ингибируют TASK-подобную проводимость калия, уменьшая ток калия. Это приводит к деполяризации клеточной мембраны, что приводит к образованию Ca2+ проникновение, возбуждение клеток клубочка и последующее высвобождение нейромедиатора.[9]
Артериальный ацидоз (либо метаболический или из измененного пCO2) ингибирует кислотно-основные переносчики (например, Na+-ЧАС+) которые повышают внутриклеточный pH, и активирует транспортеры (например, Cl−-HCO3−), которые его уменьшают. Изменения концентрации протонов, вызванные ацидозом (или наоборот алкалоз) внутри клетки стимулирует те же пути, участвующие в PCO2 зондирование.
Другой механизм - через чувствительные к кислороду калиевые каналы. Падение растворенного кислорода приводит к закрытию этих каналов, что приводит к деполяризации. Это приводит к высвобождению нейромедиатора дофамина в языкоглотке и аферентном блуждающем нерве в вазомоторную область.
Потенциал действия
Клетки типа I (гломус) в сонной артерии (и телах аорты) происходят из нейроэктодермы и, таким образом, являются электрически возбудимыми. Снижение парциального давления кислорода, повышение парциального давления углекислого газа и снижение рН артериальной крови могут вызвать: деполяризация из клеточная мембрана, и они влияют на это, блокируя калий токи. Это сокращение мембранный потенциал открывается закрытый по напряжению кальций каналов, что вызывает повышение концентрации внутриклеточного кальция. Это вызывает экзоцитоз из пузырьки содержащий множество нейротрансмиттеры, включая ацетилхолин, норадреналин, дофамин, аденозин, АТФ, вещество P, и мет-энкефалин. Они действуют на рецепторы на афферентных нервных волокнах, которые лежат в приложении к клетке гломуса, чтобы вызвать потенциал действия.
Реле
Обратная связь от сонной артерии отправляется в кардиореспираторные центры в продолговатый мозг через афферентные ветви языкоглоточный нерв. Эфферентные волокна аортальное тело хеморецепторы передаются блуждающий нерв. Эти центры, в свою очередь, регулируют дыхание и артериальное давление, а гипоксия вызывает усиление вентиляции.
Клиническое значение

Параганглиома
А параганглиома это опухоль, которая может поражать тело сонной артерии и обычно доброкачественный. Редко злокачественная нейробластома может происходить из каротидного тела.
Рекомендации
- ^ «Каротидное тело и каротидный синус - Общая информация». Протоколы головы и шеи штата Айова. медицина.uiowa.edu. Получено 23 октября 2019.
- ^ а б Холл, Джон Эдвард. Гайтон и Холл учебник медицинской физиологии (13-е изд.). Филадельфия, Пенсильвания. ISBN 978-1-4557-7005-2. OCLC 900869748.
- ^ Гонсалес К., Алмараз Л., Обесо А., Ригуал Р. (1994). «Хеморецепторы сонных артерий: от естественных раздражителей до сенсорных разрядов». Physiol. Rev. 74 (4): 829–98. Дои:10.1152 / Physrev.1994.74.4.829. PMID 7938227.
- ^ Уорд JP (2008). «Датчики кислорода в контексте». Biochim Biophys Acta. 1777 (1): 1–14. Дои:10.1016 / j.bbabio.2007.10.010. PMID 18036551.
- ^ Пэн И-Дж., Нандури Дж., Рагураман Дж., Суваннакитти Д., Гадалла М. М., Кумар Г. К., Снайдер С. Х., Прабхакар Н. Р.. (2010). H2S опосредует зондирование O2 в сонной артерии PNAS 107 (23) 10719-10724. Дои:10.1073 / pnas.1005866107
- ^ Гонсалес С., Санс-Альфаяте Дж., Агапито М. Т., Гомес-Ниньо А., Роше А., Обесо А. (2002). «Датчики кислорода в контексте». Респир Физиол Нейробиол. 132 (1): 17–41. Дои:10.1016 / S1569-9048 (02) 00047-2. PMID 12126693. S2CID 25674998.
- ^ Уильямс С.Е., Вуттон П., Мейсон Х.С., Боулд Дж., Ильес Д.Е., Риккарди Д., Сверстники С., Кемп П.Дж. (2004). «Гемоксигеназа-2 - датчик кислорода для кальций-чувствительного калиевого канала». Наука. 306 (5704): 2093–7. Дои:10.1126 / science.1105010. PMID 15528406. S2CID 41811182.
- ^ Wyatt CN, Mustard KJ, Pearson SA, Dallas ML, Atkinson L, Kumar P, Peers C, Hardie DG, Evans AM (2007). «АМФ-активированная протеинкиназа опосредует возбуждение сонных артерий при гипоксии». J Biol Chem. 282 (11): 8092–8. Дои:10.1074 / jbc.M608742200. ЧВК 1832262. PMID 17179156.
- ^ Баклер К.Дж., Уильямс Б.А., Оноре Э. (2000). «Чувствительный к кислороду, кислоте и анестетикам TASK-подобный фоновый калиевый канал в артериальных хеморецепторных клетках крыс». J. Physiol. 525 (1): 135–142. Дои:10.1111 / j.1469-7793.2000.00135.x. ЧВК 2269923. PMID 10811732.