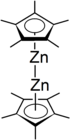WikiDer > Декаметилдизинкоцен - Википедия
| Идентификаторы | |||
|---|---|---|---|
3D модель (JSmol) | |||
| |||
| Характеристики | |||
| C20ЧАС30Zn2 | |||
| Молярная масса | 401.22 г · моль−1 | ||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Декаметилдизинкоцен является цинкорганическое соединение с формулой [Zn2(η5–C5Мне5)2]. Это первая[1] и необычный пример соединения со связью Zn-Zn.[2] Декаметилдизинкоцен - бесцветный кристаллическое твердое вещество который самопроизвольно горит в присутствии кислорода и вступает в реакцию с водой. Он стабилен при комнатной температуре и особенно хорошо растворяется в диэтиловый эфир, бензол, пентан, или же тетрагидрофуран.[3]
Синтез
Способность металлов образовывать гетероядерный или же гомоядерный связь металл-металл варьируется в зависимости от периодическая таблица. Среди 12 элементов группы, Меркурий легко образует [M-M]2+ единиц, тогда как элементы кадмий и цинк образуют меньше примеров таких видов.[2] В 2004 г. Кармона и его коллеги сообщили о декаметилдизинкоцене как о неожиданном товар из реакция между декаметилцинкоценом (Zn (C5Мне5)2) и диэтилцинк (ZnEt2).[2]
- 2 (η5-C5Мне5)2Zn + Et2Zn → (η5-C5Мне5)2Zn2 + 2 (η5-C5Мне5) ZnEt + углеводород (ы)
Аналогичная реакция цинкоцена (Zn (C5ЧАС5)2) с диэтилцинком дает (η5-C5ЧАС5) ZnEt.[4] Следовательно, стабилизирующий эффект метильные группы на циклопентадиенильных кольцах имеет большое значение в образовании декаметидизинкоцена. Использование ZnEt2 как реагент имеет особое значение.
Предшественник цинкаорганического происхождения очень важен. Дифенилцинк (Zn (C6ЧАС5)2), несмотря на его более низкую растворимость, может использоваться вместо ZnEt2. С другой стороны, ZnMe2 дает только состав полусэндвича [(η5-C5Мне5) ZnMe].[3]
Оба (η5-C5Мне5) ZnEt и декаметилдизинкоцен образуются в результате реакции между Zn (η5-C5Мне5)2 и ZnEt2. Относительные количества зависят от условий реакции, которые можно оптимизировать в пользу того или другого.[2] Например, если эта реакция проводится в пентан при -40 ° C, (η5-C5Мне5) ZnEt - единственный продукт. И наоборот, если реакцию проводят в диэтиловом эфире при -10 ° C, (Zn2(η5-C5Мне5)2) является основным продуктом.
Непредсказуемость синтеза
Однако образование декаметилдизинкоцена довольно непредсказуемо. Несколько дублирований этой реакции (в условиях, благоприятствующих образованию декаметилдизинкоцена) необъяснимым образом привели к образованию только полусэндвич-комплекса (η5-C5Мне5) ZnEt. Образование продуктов (η5-C5Мне5) ZnEt и Zn2(η5-C5Мне5)2 происходят через отдельные, конкурентные пути реакции, и, следовательно, эти два продукта не превращаются друг в друга, когда их оставляют для реакции в течение продолжительных периодов времени.[3]
Считается, что образование полусэндвич-комплекса происходит через гидрокарбил-мостовой промежуточные звенья. Однако механизм реакции не ясен. Ранее была выдвинута гипотеза, что образование декаметилдизинкоцена происходило в результате разложения диэтилцинка, продукты разложения которого имели бы способность сокращение от декаметилзинкоцена до декаметилдизинкоцена. Однако сейчас считается, что образование декаметилдизинкоцена происходит через радикальная реакция включающий комбинацию двух (η5-C5Мне5) Zn• радикалы.
В новом более эффективном и более общем пути к декаметилдизинкоцену гидрид калия используется для восстановления декаметилзинкоцена до декаметилдизинкоцена. Другой восстановители Такие как K, Na, или же CaH2 может также использоваться для восстановления декаметилзинкоцена до декаметилдизинкоцена.[3]
Этот комплекс не реагирует с Базы Льюиса такой PMe3, PPh3, Сеть3, или же пиридин и не реагирует с H2, CO2, или CO. Это соединение, по-видимому, бесконечно стабильно при комнатной температуре (однако рекомендуется хранение при -20 ° C) и сублимируется около 70 ° C.[2]
Структура
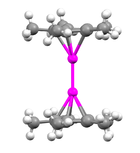
Для определения структуры декаметилдизинкоцена использовались различные методы, включая дифракция рентгеновских лучей, 1H ЯМР, и масс-спектрометрии. С помощью методов дифракции рентгеновских лучей было обнаружено, что атомы цинка зажаты между двумя параллельными C5Мне5 кольца, плоскости которых перпендикулярны оси связи металл-металл.[3] Расстояние между двумя кольцевыми плоскостями составляет примерно 6,40 Å. C5Мне5 кольца находятся в затмение с метильными заместителями, слегка загнутыми наружу (от центральных атомов металла) под углами от 3 до 6 градусов.[5]
В одноядерных металлоценах изгиб заместители прикрепленные к кольцам служат для предотвращения стерическое препятствие; однако радиус метильная группа составляет всего 2,0 Å, и поэтому изгиб в декаметилдизинкоцене не служит этой цели, поскольку расстояние между двумя кольцами намного больше, чем это значение. Считается, что в случае декаметилдизинкоцена изгиб метильных групп, присоединенных к циклопентадиенильным лигандам, является предпочтительным, поскольку он концентрирует электронная плотность от центральных положительно заряженных атомов металла. Расстояние между каждым атомом Zn и центром присоединенного к нему циклопентадиенильного кольца составляет приблизительно 2,04 Å, а расстояние Zn-C (кольцо) составляет от 2,27 до 2,30 Å.[3] Расстояние связи Zn-Zn составляет 2,035 Å, что указывает на довольно сильную связь между двумя атомами цинка. Это можно сравнить с известным [Hg-Hg]2+ длина облигации от 2,5 до 2,7 Å.[6] Были предложены два отдельных типа структур для диметаллоценов, включая коаксиальную структуру (которая представляет собой структуру декаметилдизинкоцена) и перпендикулярную структуру, в которой ось связи металл-металл параллельна плоскости циклопентадиенильных лигандов (которая, как предполагается, является структура для дикупроценов).[7] Соединение, рассматриваемое в этой статье, по существу линейно с валентными углами Zn-Zn приблизительно 177 °:[3]
Отсутствие мостиковых лигандов
1Исследования H ЯМР и масс-спектрометрии были полезны для доказательства того, что декаметилдизинкоцен не включает мостиковые лиганды. Это исследование важно, учитывая, что комплекс, ранее предполагавшийся как Co2(η5-C5Мне5)2 позже был обнаружен с использованием 1Данные H ЯМР и масс-спектрометрии подтверждаются тремя мостиковыми атомами водорода.[8] В 1H ЯМР декаметилдизинкоцена показывает только один сигнал при δ 2,02 из-за атомов водорода, присоединенных к метильным группам на циклопентадиенильных лигандах.[3]
Электронная структура и характеристики связи
Декаметилдизинкоцен имеет скопление электронная плотность между двумя атомами цинка, что указывает на связь.[9] У этой облигации есть предсказанный энергия диссоциации 62 ккал · моль−1 и примерно такой же прочный, как и среди металлическихгалогенид облигации. Анализ NBO (Natural Bond Order) показал, что сигма-склеивание происходит между 4s-орбиталями центральных атомов металла с связывающая орбиталь заполняемость 1,9445,9 Использование фрагментный молекулярно-орбитальный анализ (FMOA) было обнаружено, что есть один главный молекулярная орбиталь который участвует в связывании Zn-Zn с характером связывания примерно 88%, сосредоточенным между атомами Zn.
Рекомендации
- ^ Housecroft, C.E .; Шарп, А. Г. (2008). Неорганическая химия (3-е изд.). Прентис Холл. п. 843. ISBN 978-0-13-175553-6.
- ^ а б c d е Resa, I .; Carmona, E .; Gutierrez-Puebla, E .; Монж, А. (2004). «Декаметилдизинкоцен, стабильное соединение Zn (I) со связью Zn-Zn». Наука. 305 (5687): 1136–8. Дои:10.1126 / science.1101356. PMID 15326350.
- ^ а б c d е ж грамм час Grirrane, A; Resa, I; Родригес, А; Кармона, Э; Альварес, Э; Gutierrez-Puebla, E; Monge, A; Галиндо, А; и другие. (2007). «Цинк-цинковые цинкоценовые структуры. Синтез и характеристика Zn.2(η5-C5Мне5)2 и Zn2(η5-C5Мне4Et)2". Варенье. Chem. Soc. 129 (3): 693–703. Дои:10.1021 / ja0668217. PMID 17227033.
- ^ Haaland, A .; Samdal, S .; Зейп, Р. (1978). «Молекулярная структура мономерного метил (циклопентадиенил) цинка, (CH3) Zn (η-C5ЧАС5), определенный методом дифракции электронов в газовой фазе ». J. Organomet. Chem. 153 (2): 187. Дои:10.1016 / S0022-328X (00) 85041-X.
- ^ Philpott, M; Кавазое, Ю. ТЕОХИМА 2006, 733, 43.
- ^ Xie, Y .; Schaefer, H.F .; Кинг, Р. Б. (2005). "Дихотомия диметаллоценов: коаксиальные и перпендикулярные диметаллические единицы в сэндвич-соединениях". Варенье. Chem. Soc. 127 (9): 2818. Дои:10.1021 / ja042754 +.
- ^ Lutz, F .; Bau, R .; Wu, P .; Koetzle, T. F .; Крюгер, С .; Шнайдер, Дж. Дж. (1996). "Нейтронографический структурный анализ трехъядерного двухъядерного гидридного комплекса кобальта, [(η5-Cp *) Co]2ЧАС3". Неорг. Chem. 35 (9): 2698. Дои:10.1021 / ic951297i.
- ^ Канг, Х. (2005). «Теоретическое исследование комплексов расширенных циклопентадиенильных лигандов с цинком и кадмием». J. Phys. Chem. А. 109 (19): 4342. Дои:10.1021 / jp044293k.
- ^ Кресс, Дж. (2005). "Исследование функциональной теории плотности декаметилдизинкоцена". J. Phys. Chem. А. 109 (34): 7757. Дои:10.1021 / jp051065x.