WikiDer > Пламя

А пламя (от латинского фламма) это видимый, газообразный часть Огонь. Это вызвано очень экзотермический реакция происходит в тонкой зоне.[1] Очень горячее пламя достаточно горячее, чтобы ионизированный газообразные компоненты достаточной плотности для рассмотрения плазма.[нечеткий][нужна цитата]
Механизм
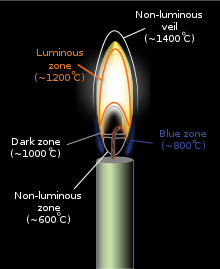
Цвет и температура пламени зависят от типа топливо участвует в горение, как, например, когда более легкий проводится свеча. Приложенное тепло заставляет топливо молекулы в свечной воск к испарять (Если этот процесс происходит в инертной атмосфере без окислитель, это называется пиролиз). В этом состоянии они могут легко реагировать с кислород в воздуха, который выделяет достаточно высокая температура в последующей экзотермической реакции для испарения еще большего количества топлива, таким образом поддерживая постоянное пламя. Высокая температура пламени заставляет молекулы испаренного топлива разлагать, образуя различные продукты неполного сгорания и свободные радикалы, и эти продукты затем вступают в реакцию друг с другом и с окислитель участвует в реакции. Можно исследовать все различные части пламени свечи с помощью холодной металлической ложки:[2] Более высокие части - это водяной пар, конечный результат сгорания; желтые части в середине сажа; вниз рядом с фитиль свечи несгоревший воск. Достаточный энергия в пламени будет возбуждать то электроны в некоторых промежуточных промежуточных продуктах реакции, таких как метилидиновый радикал (CH) и двухатомный углерод (C2), что приводит к излучению видимых свет поскольку эти вещества выделяют свою избыточную энергию (см. спектр ниже для объяснения того, какие конкретные виды радикалов производят определенные цвета). По мере увеличения температуры горения пламени (если пламя содержит мелкие частицы несгоревший углерод или другого материала), так же как и средняя энергия электромагнитное излучение испускается пламенем (см. Черное тело).
Для получения пламени можно использовать другие окислители, кроме кислорода. Водород горит в хлор образует пламя и при этом выделяет газообразный хлористый водород (HCl) как продукт сгорания.[3] Еще одна из многих возможных химических комбинаций: гидразин и четырехокись азота который гиперголичный и обычно используется в ракетные двигатели. Фторполимеры может использоваться для поставки фтор как окислитель металлического топлива, например в магний / тефлон / витон сочинение.
В химическая кинетика происходящие в пламени, очень сложны и обычно включают большое количество химические реакции и промежуточные виды, большинство из них радикалы. Например, известная схема химической кинетики GRI-Mech,[4] использует 53 вида и 325 элементарных реакций для описания горения биогаз.
Существуют различные методы подачи необходимых компонентов горения в пламя. В диффузионное пламякислород и топливо диффундируют друг в друга; пламя возникает там, где они встречаются. В предварительно смешанное пламякислород и топливо предварительно смешиваются, что приводит к другому типу пламени. Пламя свечи (диффузное пламя) действует через испарение топлива, которое поднимается в ламинарный поток горячего газа, который затем смешивается с окружающим кислородом и сгорает.
Цвет

Цвет пламени зависит от нескольких факторов, наиболее важным из которых обычно является излучение черного тела и спектральный диапазон эмиссия, с обоими спектральная линия излучение и поглощение спектральных линий играют меньшую роль. В наиболее распространенном типе пламени углеводород пламени, наиболее важным фактором, определяющим цвет, является подача кислорода и степень предварительного смешивания топлива с кислородом, которая определяет скорость горения и, следовательно, температура и пути реакции, тем самым создавая разные цветовые оттенки.

В лаборатория под нормальным сила тяжести условиях и при закрытом воздухозаборнике бунзеновская горелка горит желтым пламенем (также называемым безопасным пламенем) с максимальной температурой около 2000 K (3100 ° F). Желтый возникает из накал очень мелких частиц сажи, образующихся в пламени. При открытии воздухозаборника образуется меньше сажи. Когда подается достаточно воздуха, сажа не образуется и пламя становится синим. (Большая часть этого синего цвета ранее была скрыта из-за ярко-желтого излучения.) Спектр предварительно приготовленной смеси (полное сгорание) бутан пламя справа показывает, что синий цвет возникает именно из-за излучения возбужденного молекулярный радикалы в пламени, которые излучают большую часть своего света значительно ниже ≈565 нанометров в синей и зеленой областях видимый спектр.
Более холодная часть диффузионного (неполного сгорания) пламени будет красной, переходящей в оранжевый, желтый и белый цвета при повышении температуры, о чем свидетельствуют изменения в спектре излучения черного тела. Для данной области пламени, чем ближе к белому цвет на этой шкале, тем горячее эта часть пламени. Переходы часто видны при пожарах, при которых цвет, излучаемый ближе всего к топливу, - белый, с оранжевой полосой над ним, а красноватое пламя - самое яркое.[5] Пламя синего цвета возникает только тогда, когда количество сажи уменьшается и синие выбросы от возбужденных молекулярных радикалов становятся доминирующими, хотя синий цвет часто можно увидеть у основания свечей, где сажа в воздухе менее концентрирована.[6]
Определенные цвета можно придать пламени путем введения возбудимых видов с яркими спектр излучения линий. В аналитическая химия, этот эффект используется в испытания на пламя для определения наличия некоторых ионов металлов. В пиротехника, то пиротехнические красители используются для получения ярко окрашенных фейерверк.
Температура

Если посмотреть на температуру пламени, есть много факторов, которые можно изменить или применить. Важным является то, что цвет пламени не обязательно определяет сравнение температуры, потому что излучение черного тела - не единственное, что производит или определяет видимый цвет; следовательно, это только оценка температуры. Другими факторами, определяющими его температуру, являются:
- Адиабатическое пламя; т.е. без потери тепла в атмосферу (в некоторых частях может отличаться)
- Атмосферное давление
- Процентное содержание кислорода в атмосфера
- Тип используемого топлива (т. Е. Зависит от того, как быстро происходит процесс; насколько интенсивным является горение)
- Любой окисление топлива
- Температура атмосферы связана с адиабатической температурой пламени (то есть тепло быстрее передается в более прохладную атмосферу)
- Как стехиометрический процесс горения (стехиометрия 1: 1) предполагает отсутствие диссоциации при самой высокой температуре пламени; избыток воздуха / кислорода снизит его, как и недостаток воздуха / кислорода
При пожарах (особенно домашние пожары) более холодное пламя часто бывает красным и производит больше всего курить. Здесь красный цвет по сравнению с типичным желтым цветом пламени предполагает, что температура ниже. Это потому, что в комнате не хватает кислорода и, следовательно, есть неполное сгорание и температура пламени низкая, часто всего от 600 до 850 ° C (от 1112 до 1562 ° F). Это означает, что многие монооксид углерода образуется (горючий газ), когда существует наибольший риск обратная тяга. Когда это происходит, горючие газы на уровне или выше точка возгорания самовозгорания подвергаются воздействию кислорода, окиси углерода и перегретых углеводородов, и возникают временные температуры до 2000 ° C (3630 ° F).[нужна цитата]
Общие температуры
Эта секция возможно содержит оригинальные исследования. (Декабрь 2019 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |
Это приблизительное руководство по температуре пламени для различных распространенных веществ (в воздухе 20 ° C (68 ° F) при давлении 1 атм.):
| Материал сгорел | Температура пламени |
|---|---|
| Уголь Огонь | 750–1200 ° C (1,382–2,192 ° F) |
| Метан (натуральный газ) | 900–1 500 ° C (1,652–2,732 ° F) |
| бунзеновская горелка пламя | 900–1600 ° C (1 652–2912 ° F) [в зависимости от воздушного клапана, открытого или закрытого]. |
| Свеча пламя | ≈1 100 ° C (≈2 012 ° F) [большинство]; горячие точки могут иметь температуру 1300–1400 ° C (2372–2,552 ° F) |
| Пропан паяльная лампа | 1200–1700 ° C (2192–3 092 ° F) |
| Обратная тяга пик пламени | 1,700–1,950 ° C (3,092–3,542 ° F) |
| Магний | 1 900–2 300 ° C (3 452–4 172 ° F) |
| Водородная горелка | До ≈2000 ° C (≈3,632 ° F) |
| МАПП газ | 2,020 ° C (3,668 ° F) |
| Ацетилен паяльная лампа /паяльная лампа | До ≈2 300 ° C (≈4 172 ° F) |
| Окси ацетилен | До 3300 ° C (5972 ° F) |
| Материал сгорел | Максимум. температура пламени (на воздухе, диффузное пламя)[5] |
|---|---|
| Животный жир | 800–900 ° C (1,472–1,652 ° F) |
| Керосин | 990 ° С (1814 ° F) |
| Бензин | 1026 ° С (1878,8 ° F) |
| Дерево | 1027 ° С (1880,6 ° F) |
| Метанол | 1200 ° C (2192 ° F) |
| Уголь (принудительная тяга) | 1390 ° С (2534 ° F) |
Самая высокая температура
Дицианоацетилен, соединение углерод и азот с химическая формула C4N2 горит в кислороде ярким сине-белым пламенем при температуре 5,260K (4990 ° C; 9010 ° F) и до 6000 K (5730 ° C; 10340 ° F) в озон.[7] Такая высокая температура пламени частично объясняется отсутствием водорода в топливе (дицианоацетилен не является углеводородом), поэтому среди продуктов сгорания нет воды.
Циан, с формула (C N)2, при горении в кислороде дает второе по величине из известных естественное пламя с температурой более 4525 ° C (8177 ° F).[8][9]
Прохладное пламя
При температурах всего 120 ° C (248 ° F) топливно-воздушные смеси могут вступать в химическую реакцию с образованием очень слабого пламени, называемого холодным пламенем. Явление было открыто Хэмфри Дэви в 1817 г. Процесс зависит от точного баланса температуры и концентрации реагирующей смеси, и при подходящих условиях он может начаться без какого-либо внешнего источника воспламенения. Циклические колебания баланса химических веществ, особенно промежуточных продуктов реакции, вызывают колебания пламени с типичным изменением температуры около 100 ° C (212 ° F) или между «холодным» и полным воспламенением. Иногда вариация может привести к взрыву.[10][11]
В микрогравитации
В 2000 году эксперименты НАСА подтвердили, что гравитация играет косвенную роль в образовании и составе пламени.[12] Обычное распространение пламени в условиях нормальной силы тяжести зависит от конвекция, поскольку сажа имеет тенденцию подниматься к верхушке пламени (например, в свече при нормальных условиях гравитации), делая его желтым. В микрогравитация или же нулевая гравитация окружающая среда, например, в орбита, естественная конвекция больше не возникает, и пламя становится сферическим, с тенденцией становиться синим и более эффективным. Есть несколько возможных объяснений этой разницы, наиболее вероятным из которых является гипотеза о том, что температура достаточно равномерно распределена, чтобы не образовывалась сажа и происходило полное сгорание.[13] Эксперименты НАСА показывают, что диффузионное пламя в условиях микрогравитации позволяет большему количеству сажи полностью окиситься после его образования, чем диффузионное пламя на земной шар, из-за ряда механизмов, которые ведут себя в условиях микрогравитации иначе, чем в условиях нормальной гравитации.[14] Эти открытия имеют потенциальное применение в Прикладная наука и промышленность, особенно в отношении эффективность топлива.
Термоядерное пламя
Пламя не обязательно должно быть вызвано только выделением химической энергии. В звездах дозвуковые фронты горения, вызванные горением легких ядер (таких как углерод или гелий) и тяжелых ядер (вплоть до группы железа), распространяются как пламя. Это важно в некоторых моделях Сверхновые типа Ia. В термоядерном пламени теплопроводность преобладает над диффузией веществ, поэтому скорость и толщина пламени определяются термоядерная энергия выпуск и теплопроводность (часто в виде вырожденные электроны).[15]
Смотрите также
- Детектор пламени
- Международный фонд изучения пламени
- Окислительное и редуцирующее пламя
- Институт горения
Рекомендации
- ^ Закон, К. К. (2006). «Ламинарное пламя с предварительным смешиванием». Физика горения. Кембридж, Англия: Издательство Кембриджского университета. п. 300. ISBN 0-521-87052-6.
- ^ "Что такое огонь?". Получено 27 ноября 2019.
- ^ «Реакция хлора с водородом». Архивировано из оригинал 20 августа 2008 г.
- ^ Грегори П. Смит; Дэвид М. Голден; Майкл Френклах; Найджел В. Мориарти; Борис Эйтенеер; Михаил Гольденберг; К. Томас Боуман; Рональд К. Хэнсон; Сунхо Сонг; Уильям С. Гардинер младший; Виталий В. Лисянский; Чживэй Цинь. «GRI-Mech 3.0». Архивировано из оригинал 29 октября 2007 г.. Получено 8 ноября 2007.
- ^ а б Кристофер В. Шмидт; Стив А. Саймс (2008). Анализ сожженных человеческих останков. Академическая пресса. С. 2–4. ISBN 0-12-372510-0.
- ^ Юзеф Яросински; Бернар Вейсьер (2009). Явления горения: избранные механизмы образования, распространения и угасания пламени. CRC Press. п. 172. ISBN 0-8493-8408-7.
- ^ Киршенбаум, А.Д .; А. В. Гроссе (май 1956 г.). "Горение субнитрида углерода, Северная Каролина"4N и химический метод получения непрерывных температур в диапазоне 5000–6000 ° K ». Журнал Американского химического общества. 78 (9): 2020. Дои:10.1021 / ja01590a075.
- ^ Thomas, N .; Gaydon, A.G .; Брюэр, Л. (1952). "Пламя цианогена и энергия диссоциации азота"2". Журнал химической физики. 20 (3): 369–374. Bibcode:1952ЖЧФ..20..369Т. Дои:10.1063/1.1700426.
- ^ Дж. Б. Конвей; Р. Х. Уилсон-младший; А. В. Гроссе (1953). «ТЕМПЕРАТУРА ЦИАНОГЕН-КИСЛОРОДНОГО ПЛАМЕНИ». Журнал Американского химического общества. 75 (2): 499. Дои:10.1021 / ja01098a517.
- ^ Перлман, Ховард; Чапек, Ричард М. (24 апреля 2000 г.). «Холодное пламя и самовоспламенение в условиях микрогравитации». НАСА. Архивировано из оригинал 1 мая 2010 г.. Получено 13 мая 2010.
- ^ Джонс, Джон Клиффорд (сентябрь 2003 г.). «Низкотемпературное окисление». Безопасность углеводородных процессов: текст для студентов и профессионалов. Талса, ОК: PennWell. С. 32–33. ISBN 978-1-59370-004-1.
- ^ Спиральное пламя в микрогравитации В архиве 19 марта 2010 г. Wayback Machine, Национальное управление по аэронавтике и исследованию космического пространства, 2000.
- ^ Пламя свечи в условиях микрогравитации В архиве 26 октября 2011 г. Wayback Machine. НАСА
- ^ К. Х. Ким и другие. Эксперимент по ламинарным процессам сажи, проливающий свет на излучение пламени В архиве 11 января 2014 г. Wayback Machine. НАСА, HTML В архиве 20 июля 2012 г. Wayback Machine
- ^ Timmes, F. X .; Вусли, С. Э. (1 сентября 1992 г.). «Кондуктивное распространение ядерного пламени. I - Вырожденные белые карлики C + O и O + Ne + Mg». Астрофизический журнал. 396: 649–667. Bibcode:1992ApJ ... 396..649T. Дои:10.1086/171746.
внешняя ссылка
- Пламя свечи сильно влияло и перемещалось электрическое поле из-за пламени, содержащего ионы.
- Горелка со сверхнизким уровнем выбросов и низким уровнем завихрения
- 7 оттенков огня
- Лицензия, Питер. «Цветное пламя». Периодическая таблица видео. Ноттингемский университет.