WikiDer > Белок, взаимодействующий с рецептором глутамата
Белок, взаимодействующий с рецептором глутамата (GRIP) относится к семейству белков, которые связываются с рецептор глутамата или конкретно в GRIP1 белок в этой семье. Было показано, что белки семейства белков, взаимодействующих с рецептором глутамата (GRIP), взаимодействуют с GluR2, общая субъединица в Рецептор AMPA.[1] Эта субъединица также взаимодействует с другими белками, такими как белок, взаимодействующий с C-киназой1 (PICK1) и слитый белок, чувствительный к N-этилмалеимиду (NSF). Исследования начали выяснять его функцию; однако об этих белках еще предстоит многое узнать.
Открытие и история GRIP 1
Открытие белка, взаимодействующего с глутаматным рецептором (GRIP-1), явилось результатом наблюдения, что глутаматные рецепторы, такие как Рецептор NMDA, кластер в синапсах.[2] Вскоре после этого наблюдения исследователи идентифицировали область в С-концевой области рецепторов NMDA, названную мотивом tSXV, которая имеет способность связываться с PDZ домен из PSD-95 белок.[3]
Исследования локализации рецепторов NMDA проложили путь для исследований не-NMDA рецепторов, таких как рецепторы AMPA. Подобно рецепторам NMDA, было обнаружено, что рецепторы AMPA локализуются в синаптическом конце нейронов в Центральная нервная система.[4] Используя GFP (зеленый флуоресцентный белок) антител, которые соответствуют белку GRIP, исследователи смогли использовать флуоресценцию для определения местоположения GRIP в нейронах гиппокампа. Затем использовали другое антитело GFP для мечения субъединицы GluR2 рецепторов AMPA.[4] Используя иммуноцитохимия и сравнивая расположение рецепторов GRIP и AMPA, было определено, что рецепторы GRIP и AMPA испытывают колокализация в нейронах гиппокампа.[4] Эти данные подтвердили первоначальную гипотезу о том, что белок GRIP играет важную роль в связывании рецепторов AMPA с возбуждающими синапсами.
Структура GRIP содержит семь доменов PDZ и связывается с С-концом субъединицы GluR2 рецепторов AMPA.[4] Хотя количество доменов PDZ различно для белков PSD-95 и GRIP, домен PDZ является общим структурным мотивом в белках, который помогает опосредовать межбелковые взаимодействия.[5] Аминокислотная последовательность рецептора AMPA, с которой связывается белок GRIP, - это ESVKI. Консервативная аминокислота серина на С-конце рецепторов AMPA и NMDA предполагает, что она играет важную роль в облегчении взаимодействия GRIP и PSD-95.[6]
Роль GRIP в велоспорте AMPAR
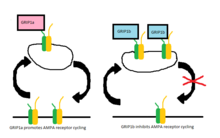
Рецепторы AMPA постоянно транспортируются между клеточной мембраной и внутриклеточным пространством, и первоначально считалось, что GRIP может быть ответственным за кластеризацию рецепторов AMPA в возбуждающем синапсе.[1] Хотя до сих пор неясна точная роль GRIP в этом перемещении, похоже, что PICK1 более непосредственно ответственен за кластеризацию рецепторов AMPA на поверхности и что GRIP участвует в стабилизации рецепторов AMPA внутриклеточно.[7] Одно исследование показало, что при нарушении взаимодействия между GluR2 и GRIP не происходит никаких изменений в поверхностной экспрессии рецепторов AMPA или конститутивной интернализации рецепторов AMPA.[8] Однако существует меньшее количество рецепторов, которые остаются интернализованными, когда цикл рецепторов модифицируется применением AMPA-1. Отношение возвращается к норме, когда разрешается конститутивная рециклинг, что позволяет предположить, что стабилизация внутриклеточных рецепторов имеет решающее значение только при интернализации, индуцированной AMPA.[8]
В более поздних исследованиях два белка, GRIP-1 (часто сокращается до GRIP) и ABP-L (также называется GRIP-2), было обнаружено, что они экспрессируются двумя отдельными генами, и их соответствующий вклад в цикл AMPA-рецепторов с тех пор хорошо изучен. Каждый из этих белков имеет разные изоформы из-за разницы Сплайсинг РНК.[9][10] Изоформы GRIP-1 называются GRIP-1a и GRIP-1b, а изоформы ABP-L обозначаются как ABP-L и pABP-L. Очевидное различие в обоих случаях состоит в том, что одна изоформа (GRIP1b и pABP-L соответственно) способна конъюгировать с Пальмитиновая кислота, действие называется Пальмитоилирование.
В то время как первоначально считалось, что GRIP участвует в стабилизации рецепторов AMPA либо на поверхности клетки, либо внутри клетки, когда интернализация запускается стимуляцией AMPA, теперь выясняется, что изоформы GRIP-1 по-разному участвуют в стабилизации рецепторов AMPA после интернализации. из-за NMDA стимуляция.[11] Было показано, что GRIP-1a снижает ожидаемые внутриклеточные уровни рецепторов AMPA после стимуляции NMDA. Напротив, GRIP-1b увеличивает внутриклеточные уровни рецепторов AMPA в тех же условиях.
ABP-L, как и GRIP-1b, связывается с внутриклеточными запасами рецепторов AMPA. Однако pABP-L связывается с рецепторами AMPA в качестве поверхностной мембраны.[12] Еще не показано, при каких условиях эти взаимодействия значимы в циклическом цикле AMPAR.
Роль GRIP1 в синдроме Фрейзера
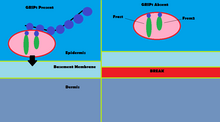
Мутации GRIP1 играют роль менее чем в 10% подтвержденных случаев группы врожденных дефектов, известных как Синдром Фрейзера.[13] С помощью иммунофлуоресценция, было показано, что GRIP1 обнаруживается в нескольких типах эмбриональных тканей, включая желудочно-кишечный тракт, зачатки мочеточника, кожу и полости рта и носа.[14] GRIP1 также важен для правильного функционирования и структуры дермо-эпидермального соединения.[15] В моделях мышей отключение белка GRIP1 приводит к нескольким деформациям, которые начинаются у эмбриона. Эти деформации включают субэпидермальные геморрагические пузыри, почечная агенезия, синдактилизм, полидактилизм и криптоптальм.[14] Одно исследование показало, что полный нокаут GRIP1 приводит к отсутствию почек.[14] Другое исследование показывает образование пузырей на эмбриональной ткани, в которой экспрессируется GRIP1, на 12-й день эмбриональной жизни мышей.[15]
Механизм GRIP1 при синдроме Фрейзера обнаруживается во взаимодействии GRIP1 с белками Fras1 и Frem2.[16] Fras1 и Frem2 - это белки внеклеточной мембраны, необходимые для правильного функционирования базальной мембраны, а также морфогенез.[16] GRIP1 играет жизненно важную роль в локализации Fras1 на базальной поверхности эпидермальных клеток, а также в локализации Frem2.[16] Нокаут или мутация белка GRIP1 приводит к плохой экспрессии Fras1 и Frem2.[16] GRIP1 специфически связывается с Fras1 через мотив PDZ, расположенный на Fras1.[16] Frem2 также имеет PDZ домен, хотя взаимодействие между GRIP1 и Frem2 неясно.[16] В одном случае синдрома Фрейзера у GRIP1 отсутствовали PDZ-домены 6 и 7. Только первые четыре PDZ-домена из семи PDZ-доменов GRIP1 необходимы для связывания с Fras1, что указывает на дополнительные механизмы и белки, с которыми взаимодействует GRIP1, которые могут привести к синдрому Фрейзера, когда мутировал.[17] Другие мутации в GRIP1, которые приводят к синдрому Фрейзера, включают бессмысленные мутации, мутации сдвига рамки считывания, мутации сайта сплайсинга, делецию генома и делецию экзона 18 гена GRIP1.[13]
Роль GRIP1 в морфологии нейронов и транспортировке грузов
Нейрон морфология, развитие и поддержание зависят от экспрессии GRIP1 в клетке.[18] Это жизненно важно на начальном этапе развития, так как выбивать эксперименты в мышиных моделях приводит к образованию кожи волдыри и эмбриональная летальность.[15] В разработанных мышах отключение мутаций, таких как трансфектон или же доминирующие негативы в GRIP1 может вызывать потерю до 75% «первичных, вторичных и высших» дендритов в развивающихся нейронах.[19] Отключение GRIP1 в живых здоровых нейронах в блюде приведет к 20% -ному сокращению самой толстой части нейрона и до 70% -ному сокращению ветвей.[18]
Дефекты морфологии нейронов из-за неисправности GRIP1 могут быть сохранены. Один из способов - сверхэкспрессировать GRIP1. Это приводит к усиленному, но не полному восстановлению ветвления.[18] Другой белок, EphB2, который взаимодействует с GRIP1, может быть мутирован так, что возможно восстановление ветвления на 70-90%. Однако сверхэкспрессия дикого типа приводит к снижению числа нейронов.[18]
Моторные белки, такие как Кинезин (KIF5) связаны с адапторными молекулами, такими как GRIP1, для перемещения груза из Гольджи к конечностям нейронной клетки. GRIP1 и KIF5 очень часто встречаются вместе из-за хорошего связывающая аффинность (Диапазон Kd от 10-20 нм[20]). Что касается того, как груз попадает в нужное место, существует гипотеза, названная «умным мотором».[21] В настоящее время считается, что «умный двигатель» распознает разницу между аксональный (покрытые белком KLC) и дендритный (покрытые KHC) белки.[21] Пункт назначения выбирается соответственно. К сожалению, подробности о промежуточных этапах транспортировки неизвестны. Однако в месте назначения связывание белка 14-3-3 нарушает взаимодействие между KIF5 и GRIP1.[19] Это освобождает груз.
Смотрите также
Рекомендации
- ^ а б Донг, H; О'Брайен, Р. Fung, E; Ланахан, А; Worley, P; Hunganir, R (март 1997 г.). «GRIP: синаптический белок, содержащий домен PDZ, который взаимодействует с рецепторами AMPA». Природа. 386 (6622): 279–84. Bibcode:1997Натура.386..279D. Дои:10.1038 / 386279a0. PMID 9069286.
- ^ Корнау, Ганс-Кристиан; Шенкер, Лесли Т .; Кеннеди, Мэри Б.; Зеебург, Питер Х. (1995). «Доменное взаимодействие между субъединицами рецептора NMDA и белком постсинаптической плотности PSD-95». Наука. 269 (5231): 1737–1740. Bibcode:1995Научный ... 269.1737K. Дои:10.1126 / science.7569905. PMID 7569905.
- ^ Ehlers, M.D .; Mammen, A. L .; Lau, L .; Хуганир, Р. Л. (1996). «Синаптическое нацеливание на рецепторы глутамата». Текущее мнение в области клеточной биологии. 8 (4): 484–489. Дои:10.1016 / S0955-0674 (96) 80024-X. PMID 8791455.
- ^ а б c d Донг, H; О'Брайен, Р. Fung, E; Ланахан, А; Worley, P; Hunganir, R (1997). «GRIP: синаптический белок, содержащий домен PDZ, который взаимодействует с рецепторами AMPA». Природа. 386 (6622): 279–84. Bibcode:1997Натура.386..279D. Дои:10.1038 / 386279a0. PMID 9069286.
- ^ Ли, HJ; Чжэн, JJ (2010). «Домены PDZ и их партнеры по связыванию: структура, специфичность и модификация». Сигнал сотовой связи. 8: 8. Дои:10.1186 / 1478-811X-8-8. ЧВК 2891790. PMID 20509869.
- ^ Ehlers, M .; Маммен, А .; Lau, L .; Хуганир Р. (1998). «Синаптическое нацеливание на рецепторы глутамата». Текущее мнение в области клеточной биологии. 8 (4): 484–489. Дои:10.1016 / S0955-0674 (96) 80024-X. PMID 8791455.
- ^ Ся, Дж; Чжан, X; Штаудингер, Дж; Хуганир, Р. (январь 1999 г.). «Кластеризация рецепторов AMPA с помощью белка PICK1, содержащего синаптический домен PDZ». Нейрон. 22 (1): 179–87. Дои:10.1016 / s0896-6273 (00) 80689-3. PMID 10027300.
- ^ а б Брейтуэйт, S; Ся, Н; Маленка, Р (2002). «Различная роль NSF и GRIP / ABP в циклическом цикле рецепторов AMPA». Труды Национальной академии наук. 99 (10): 7096–101. Bibcode:2002PNAS ... 99.7096B. Дои:10.1073 / pnas.102156099. ЧВК 124534. PMID 12011465.
- ^ Донг, H; Чжан, П; Песня, я; Petralia, R; Liao, D; Хунганир, Р. (15 августа 1999 г.). «Характеристика белков GRIP1 и GRIP2, взаимодействующих с рецептором глутамата». Журнал неврологии. 19 (16): 6930–41. Дои:10.1523 / JNEUROSCI.19-16-06930.1999. ЧВК 6782851. PMID 10436050.
- ^ Вышинский, М; Вальчанов, Дж; Naisbitt, S; Дуна, А; Kim, E; Standaert, D; и другие. (1 августа 1999 г.). «Ассоциация рецепторов AMPA с подмножеством белка, взаимодействующего с рецептором глутамата in vivo». Журнал неврологии. 19 (15): 6528–37. Дои:10.1523 / JNEUROSCI.19-15-06528.1999. ЧВК 6782830. PMID 10414981.
- ^ Хэнли, L; Хенли, Дж (2010). «Различная роль GRIP1a и GRIP1b в торговле рецепторами AMPA». Письма о неврологии. 485 (3): 167–72. Дои:10.1016 / j.neulet.2010.09.003. ЧВК 3310156. PMID 20837103.
- ^ ДеСуза, S; Фу, Дж; Состояния, B; Зифф, Э (2002). «Дифференциальное пальмитоилирование направляет белок ABP, связывающий рецептор AMPA, к шипам или внутриклеточным кластерам». Журнал неврологии. 22 (9): 3493–503. Дои:10.1523 / JNEUROSCI.22-09-03493.2002. ЧВК 6758378. PMID 11978826.
- ^ а б Шанце, Д. (2014). «Синдром Фрейзера, вызванный мутациями в GRIP1 - клинический фенотип в двух семьях и расширение спектра мутаций». Американский журнал медицинской генетики. 164 (3): 837–840. Дои:10.1002 / ajmg.a.36343. PMID 24357607.
- ^ а б c Takamiya, K .; Костуру, В .; Adams, S .; Jadeja, S .; Chalepakis, G .; Scambler, P.J .; Адамс, Р. Х. (2004). «Прямая функциональная связь между белком мульти-PDZ домена GRIP1 и белком синдрома Фрейзера Fras1». Природа Генетика. 36 (2): 172–7. Дои:10,1038 / ng1292. PMID 14730302.
- ^ а б c Бладт, Ф (2002). «Буллезный эпидермолиз и эмбриональная летальность у мышей, лишенных мульти-PDZ-домена белка GRIP1». Труды Национальной академии наук Соединенных Штатов Америки. 99 (10): 6816–6821. Bibcode:2002PNAS ... 99.6816B. Дои:10.1073 / pnas.092130099. ЧВК 124486. PMID 11983858.
- ^ а б c d е ж Киёзуми, Д. (2006). «Нарушение реципрокной стабилизации QBRICK / Frem1, Fras1 и Frem2 на базальной мембране вызывает дефекты, подобные синдрому Фрейзера». Труды Национальной академии наук Соединенных Штатов Америки. 103 (32): 11981–11986. Bibcode:2006PNAS..10311981K. Дои:10.1073 / pnas.0601011103. ЧВК 1567684. PMID 16880404.
- ^ Фогель, М., Зон, П., Брютон, Л., Гийзен, М., Туил, М., Кокс, П., ... Хельст, М. (2012). Мутации в GRIP1 вызывают синдром Фрейзера. Журнал медицинской генетики, 303-306.
- ^ а б c d Hoogenraad, Каспер (19 июня 2005 г.). «GRIP1 контролирует морфогенез дендритов, регулируя трафик рецептора EphB». Природа Неврология. 8 (7): 906–916. Дои:10.1038 / nn1487. PMID 15965473.
- ^ а б Гейгер, Юлия (24 февраля 2014 г.). «Путь GRIP1 / 14-3-3 координирует движение грузов и развитие дендритов». Клетка развития. 28 (4): 381–393. Дои:10.1016 / j.devcel.2014.01.018. PMID 24576423.
- ^ Скуфиас, Димитриос (14 января 1994 г.). «Карбоксиконцевой домен тяжелой цепи кинезина важен для связывания с мембраной». Журнал биологической химии. 269 (2): 1477–1485. PMID 8288613.
- ^ а б Сетоу, Мицутоши (2 мая 2002 г.). «Белок GRIP1, взаимодействующий с глутаматным рецептором, напрямую направляет кинезин в дендриты». Письма к природе. 417 (6884): 83–87. Bibcode:2002Натура 417 ... 83S. Дои:10.1038 / природа743. PMID 11986669.