WikiDer > P4HB
Протеин-дисульфид-изомераза, также известная как бета-подразделение из пролил 4-гидроксилаза (P4HB), является фермент что у людей кодируется P4HB ген. Человек P4HB Ген локализован в хромосоме 17q25.[5][6][7][8] В отличие от других белков семейства пролил-4-гидроксилаз, этот белок является многофункциональным и действует как оксидоредуктаза для дисульфид формирование, поломка и изомеризация.[9] Активность P4HB жестко регулируется. Как диссоциация димера, так и связывание субстрата, вероятно, увеличивают его ферментативную активность в процессе катализа.[10][11]
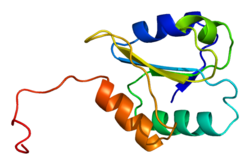
Структура
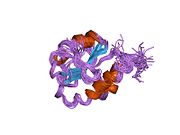
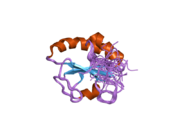
P4HB имеет четыре тиоредоксин домены (a, b, b ’и a’) с двумя CGHC активные сайты в доменах a и a ’. Как в восстановленном, так и в окисленном состоянии эти домены имеют форму подковы. В редуцированном P4HB области a, b и b 'находятся в одной плоскости, а область a' изгибается под углом ~ 45 °. При окислении четыре домена остаются в одной плоскости, а расстояние между активными центрами больше, чем в восстановленном состоянии. Окисленная форма также дает больше гидрофобный области и имеет большую щель для облегчения связывания субстрата.[12][13] Было показано, что P4HB димеризуется in vivo через некаталитические домены bb '. Образование димера блокирует сайт связывания субстрата и ингибирует активность P4HB.[14]
Функция
Этот ген кодирует бета-субъединицу пролил-4-гидроксилазы, широко распространенного многофункционального фермента, принадлежащего к семейству протеин-дисульфид-изомераз. Когда этот фермент присутствует в виде тетрамера, состоящего из двух альфа- и двух бета-субъединиц, он участвует в гидроксилировании пролильных остатков в препроколлагене. Этот фермент также представляет собой дисульфидизомеразу, содержащую два тиоредоксиновых домена, которые катализируют образование, разрыв и перегруппировку дисульфидных связей. Другие известные функции включают его способность действовать как шаперон, подавляющий агрегирование неправильно свернутых белков в зависимости от концентрации, его способность связывать гормон щитовидной железы, его роль как в притоке, так и в оттоке S-нитрозотиолсвязанный оксид азота, и его функция как субъединица микросомальной белок-переносчик триглицеридов сложный.[6]
Клиническое значение
P4HB - это фактор риска из боковой амиотрофический склероз (БАС). Исследования показали значимые генотипические ассоциации двух SNP в P4HB с FALS (семейный БАС), rs876016 (P = 0,0198) и rs2070872 (P = 0,0046). Вместе с другими ER стресс маркеры, P4HB значительно повышен в спинном мозге с БАС.[15] P4HB также может быть нитрозилирован, и повышение содержания нитрозилированного P4HB было показано в Болезнь Паркинсона и Болезнь Альцгеймера заболевание ткани головного мозга, а также у трансгенных мутантов супероксиддисмутаза 1 спорадический боковой амиотрофический склероз спинного мозга мыши и человека.[16][17] В дополнение к нейродегенеративные заболевания, Уровень P4HB повышается в мультиформная глиобластома (ГБМ) (опухоль головного мозга). Ингибирование P4HB снижает устойчивость к темозоломид, стандартный GBM химиотерапевтический через плечо PERK пути стрессовой реакции эндоплазматического ретикулума.[18] Более того, гетерозиготный промах мутация в P4HB может вызвать Синдром Коула-Карпентера, серьезный нарушение хрупкости костей.[19]
Взаимодействия
P4HB был показан взаимодействовать с участием UBQLN1,[20] ERO1LB[21][22] и ERO1L.[21][22]
использованная литература
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000185624 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000025130 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Shoulders CC, Brett DJ, Bayliss JD, Narcisi TM, Jarmuz A, Grantham TT, Leoni PR, Bhattacharya S, Pease RJ, Cullen PM (декабрь 1993 г.). «Абеталипопротеинемия вызывается дефектами гена, кодирующего 97 кДа субъединицу микросомального белка-переносчика триглицеридов». Молекулярная генетика человека. 2 (12): 2109–16. Дои:10.1093 / hmg / 2.12.2109. PMID 8111381.
- ^ а б «Ген Entrez: проколлаген-пролин P4HB, 2-оксоглутарат-4-диоксигеназа (пролин-4-гидроксилаза), бета-полипептид».
- ^ Галлиган Дж. Дж., Петерсен Д. Р. (июль 2012 г.). «Семейство генов протеин дисульфид изомеразы человека». Геномика человека. 6: 6. Дои:10.1186/1479-7364-6-6. ЧВК 3500226. PMID 23245351.
- ^ Паюнен Л., Джонс Т.А., Годдард А., Шеер Д., Соломон Э., Пихлаяниеми Т., Кивирикко К.И. (1991-01-01). «Региональное отнесение гена человека, кодирующего многофункциональный полипептид (P4HB), действующего как бета-субъединица пролил-4-гидроксилазы и фермент-дисульфид-изомеразы, к 17q25». Цитогенетика и клеточная генетика. 56 (3–4): 165–8. Дои:10.1159/000133078. PMID 1647289.
- ^ Lumb RA, Bulleid NJ (декабрь 2002 г.). «Является ли протеиндисульфид-изомераза редокс-зависимым молекулярным шапероном?». Журнал EMBO. 21 (24): 6763–70. Дои:10.1093 / emboj / cdf685. ЧВК 139105. PMID 12485997.
- ^ Бастос-Аристизабал С., Козлов Г., Геринг К. (май 2014 г.). «Структурное понимание димеризации дисульфидизомеразы человеческого белка». Белковая наука. 23 (5): 618–26. Дои:10.1002 / pro.2444. ЧВК 4005713. PMID 24549644.
- ^ Винтер Дж., Клаппа П., Фридман Р. Б., Лили Х., Рудольф Р. (январь 2002 г.). «Каталитическая активность и шаперонная функция протеин-дисульфидизомеразы человека необходимы для эффективного рефолдинга проинсулина». Журнал биологической химии. 277 (1): 310–7. Дои:10.1074 / jbc.M107832200. PMID 11694508.
- ^ Тиан Дж., Сян С., Нойва Р., Леннарц В. Дж., Шинделин Х. (январь 2006 г.). «Кристаллическая структура дисульфидизомеразы дрожжевого протеина предполагает кооперативность между ее активными центрами». Ячейка. 124 (1): 61–73. Дои:10.1016 / j.cell.2005.10.044. PMID 16413482. S2CID 17684326.
- ^ Ван С., Ли В., Рен Дж., Фанг Дж., Ке Х, Гонг В., Фенг В., Ван СС (июль 2013 г.). «Структурное понимание регулируемых окислительно-восстановительным потенциалом динамических конформаций дисульфидизомеразы человеческого белка». Антиоксиданты и редокс-сигналы. 19 (1): 36–45. Дои:10.1089 / ars.2012.4630. PMID 22657537.
- ^ Бастос-Аристизабал С., Козлов Г., Геринг К. (май 2014 г.). «Структурное понимание димеризации дисульфидизомеразы человеческого белка». Белковая наука. 23 (5): 618–26. Дои:10.1002 / pro.2444. ЧВК 4005713. PMID 24549644.
- ^ Аткин Д.Д., Фарг М.А., Уокер А.К., Маклин К., Томас Д., Хорн М.К. (июнь 2008 г.). «Стресс эндоплазматического ретикулума и индукция реакции развернутого белка при спорадическом боковом амиотрофическом склерозе». Нейробиология болезней. 30 (3): 400–7. Дои:10.1016 / j.nbd.2008.02.009. PMID 18440237. S2CID 44252514.
- ^ Уокер А.К., Фарг М.А., Пока Ч.Р., Маклин Калифорния, Хорн М.К., Аткин Д.Д. (январь 2010 г.). «Дисульфидизомераза протеина защищает от агрегации белков и S-нитрозилирована при боковом амиотрофическом склерозе». Мозг. 133 (Pt 1): 105–16. Дои:10.1093 / мозг / awp267. PMID 19903735.
- ^ Уэхара Т., Накамура Т., Яо Д., Ши З.К., Гу Зи, Ма И, Маслиах Э, Номура Ю., Липтон С.А. (май 2006 г.). «S-нитрозилированная протеин-дисульфид-изомераза связывает неправильное свертывание белков с нейродегенерацией». Природа. 441 (7092): 513–7. Bibcode:2006Натура.441..513U. Дои:10.1038 / природа04782. PMID 16724068. S2CID 4423494.
- ^ Сун С., Ли Д., Хо А.С., Пу Дж.К., Чжан XQ, Ли Н.П., Дэй П.Дж., Луи В.М., Фунг К.Ф., Люн Г.К. (май 2013 г.). «Ингибирование пролил-4-гидроксилазы, бета-полипептида (P4HB) ослабляет резистентность к темозоломиду в злокачественной глиоме через пути ответа на стресс эндоплазматического ретикулума (ERSR)». Нейроонкология. 15 (5): 562–77. Дои:10.1093 / neuonc / not005. ЧВК 3635523. PMID 23444257.
- ^ Раух Ф., Фахиминия С., Маевски Дж., Кэррот-Чжан Дж., Боудко С., Глорье Ф., Морт Дж. С., Бэчингер Х. П., Моффат П. (март 2015 г.) «Синдром Коула-Карпентера вызван гетерозиготной миссенс-мутацией в P4HB». Американский журнал генетики человека. 96 (3): 425–31. Дои:10.1016 / j.ajhg.2014.12.027. ЧВК 4375435. PMID 25683117.
- ^ Ко ХС, Уэхара Т., Номура Й. (сентябрь 2002 г.). «Роль убиквилина, связанного с протеин-дисульфид-изомеразой, в эндоплазматическом ретикулуме в вызванной стрессом апоптотической гибели клеток». Журнал биологической химии. 277 (38): 35386–92. Дои:10.1074 / jbc.M203412200. PMID 12095988.
- ^ а б Анелли Т., Алессио М., Мезграни А., Симмен Т., Таламо Ф., Бачи А., Сития Р. (февраль 2002 г.). «ERp44, новый помощник по складыванию эндоплазматического ретикулума из семейства тиоредоксинов». Журнал EMBO. 21 (4): 835–44. Дои:10.1093 / emboj / 21.4.835. ЧВК 125352. PMID 11847130.
- ^ а б Мезграни А., Фассио А., Бенхам А., Симмен Т., Браакман И., Сития Р. (ноябрь 2001 г.). «Манипуляции с окислительным сворачиванием белков и окислительно-восстановительным состоянием PDI в клетках млекопитающих». Журнал EMBO. 20 (22): 6288–96. Дои:10.1093 / emboj / 20.22.6288. ЧВК 125306. PMID 11707400.
дальнейшее чтение
- Галлиган Дж. Дж., Петерсен Д. Р. (июль 2012 г.). «Семейство генов протеин дисульфид изомеразы человека». Геномика человека. 6: 6. Дои:10.1186/1479-7364-6-6. ЧВК 3500226. PMID 23245351.
- Уилкинсон Б., Гилберт Х. Ф. (июнь 2004 г.). «Дисульфид-изомераза протеина». Biochimica et Biophysica Acta. 1699 (1–2): 35–44. Дои:10.1016 / j.bbapap.2004.02.017. PMID 15158710.
- Пихлаяниеми Т., Мюллюля Р., Кивирикко К.И. (1992). «Пролил 4-гидроксилаза и ее роль в синтезе коллагена». Журнал гепатологии. 13 Дополнение 3: S2-7. Дои:10.1016 / 0168-8278 (91) 90002-С. PMID 1667665.
- Уилкинсон Б., Гилберт Х. Ф. (июнь 2004 г.). «Дисульфид-изомераза протеина». Biochimica et Biophysica Acta. 1699 (1–2): 35–44. Дои:10.1016 / j.bbapap.2004.02.017. PMID 15158710.
- Hochstrasser DF, Frutiger S, Paquet N, Bairoch A, Ravier F, Pasquali C, Sanchez JC, Tissot JD, Bjellqvist B, Vargas R (декабрь 1992 г.). «Карта белков печени человека: справочная база данных, созданная путем микросеквенирования и сравнения гелей». Электрофорез. 13 (12): 992–1001. Дои:10.1002 / elps.11501301201. PMID 1286669. S2CID 23518983.
- Чесслер С.Д., Байерс PH (апрель 1992 г.). «Нарушение фолдинга и стабильная ассоциация с протеиндисульфидизомеразой / пролилгидроксилазой проколлагена типа I с делецией в цепи про-альфа 2 (I), которая сохраняет структуру повторов Gly-X-Y». Журнал биологической химии. 267 (11): 7751–7. PMID 1339453.
- Вуори К., Мюллюля Р., Пихлаяниеми Т., Кивирикко К.И. (апрель 1992 г.). «Экспрессия и сайт-направленный мутагенез протеин-дисульфидизомеразы человека в Escherichia coli. Этот многофункциональный полипептид имеет два независимо действующих каталитических сайта для активности изомеразы». Журнал биологической химии. 267 (11): 7211–4. PMID 1559965.
- Тасанен К., Оикаринен Дж., Кивирикко К.И., Пихлаяниеми Т. (июнь 1992 г.). «Промотор гена многофункционального полипептида дисульфидизомеразы протеина. Функциональное значение шести CCAAT-боксов и других элементов промотора». Журнал биологической химии. 267 (16): 11513–9. PMID 1597478.
- Bauw G, Rasmussen HH, van den Bulcke M, van Damme J, Puype M, Gesser B, Celis JE, Vandekerckhove J (июль 1990 г.). «Двумерный гель-электрофорез, электроблоттинг белков и микросеквенирование: прямая связь между белками и генами». Электрофорез. 11 (7): 528–36. Дои:10.1002 / elps.1150110703. PMID 1699755. S2CID 24768114.
- Уорд Л.Д., Хонг Дж., Уайтхед Р.Х., Симпсон Р.Дж. (октябрь 1990 г.). «Разработка базы данных аминокислотных последовательностей белков карциномы толстой кишки человека, разделенных с помощью двумерного электрофореза в полиакриламидном геле». Электрофорез. 11 (10): 883–91. Дои:10.1002 / elps.1150111019. PMID 2079031. S2CID 21541503.
- Тасанен К., Паркконен Т., Чоу Л.Т., Кивирикко К.И., Пихлаяниеми Т. (ноябрь 1988 г.). «Характеристика человеческого гена для полипептида, который действует как бета-субъединица пролил-4-гидроксилазы и как протеин-дисульфид-изомераза». Журнал биологической химии. 263 (31): 16218–24. PMID 2846539.
- Койву Дж., Мюллюля Р., Хелаакоски Т., Пихлаяниеми Т., Тасанен К., Кивирикко К.И. (май 1987 г.). «Один полипептид действует как бета-субъединица пролил-4-гидроксилазы и как протеин-дисульфид-изомераза». Журнал биологической химии. 262 (14): 6447–9. PMID 3032969.
- Пихлаяниеми Т., Хелаакоски Т., Тасанен К., Мюллюля Р., Хухтала М.Л., Койву Дж., Кивирикко К.И. (март 1987 г.). «Молекулярное клонирование бета-субъединицы человеческой пролил-4-гидроксилазы. Эта субъединица и протеиндисульфид-изомераза являются продуктами одного и того же гена». Журнал EMBO. 6 (3): 643–9. Дои:10.1002 / j.1460-2075.1987.tb04803.x. ЧВК 553446. PMID 3034602.
- Моррис Дж. И., Варандани П. Т. (февраль 1988 г.). «Характеристика кДНК для человеческой глутатион-инсулинтрансгидрогеназы (протеин-дисульфидизомераза / оксидоредуктаза)». Biochimica et Biophysica Acta (BBA) - Структура и экспрессия гена. 949 (2): 169–80. Дои:10.1016/0167-4781(88)90080-2. PMID 3342239.
- Госден Дж. Р., Миддлтон П. Г., Маршрут D, Де Ангелис С. (1987). «Хромосомная локализация онкогена человека ERBA2». Цитогенетика и клеточная генетика. 43 (3–4): 150–3. Дои:10.1159/000132313. PMID 3467900.
- Cheng SY, Gong QH, Parkison C, Robinson EA, Appella E, Merlino GT, Pastan I (август 1987 г.). «Нуклеотидная последовательность белка, связывающего гормон щитовидной железы человека, присутствующего в эндоплазматическом ретикулуме». Журнал биологической химии. 262 (23): 11221–7. PMID 3611107.
- Хелаакоски Т., Аннунен П., Вуори К., Макнейл И.А., Пихлаяниеми Т., Кивирикко К.И. (май 1995 г.). «Клонирование, экспрессия бакуловируса и характеристика второй изоформы альфа-субъединицы пролил-4-гидроксилазы мыши: образование альфа-2-бета-2-тетрамера с протеин-дисульфид-изомеразой / бета-субъединицей». Труды Национальной академии наук Соединенных Штатов Америки. 92 (10): 4427–31. Дои:10.1073 / пнас.92.10.4427. ЧВК 41957. PMID 7753822.
- Кемминк Дж., Дарби Н.Дж., Дейкстра К., Шик Р.М., Крейтон Т.Е. (декабрь 1995 г.). "Ядерно-магнитный резонанс N-концевого тиоредоксин-подобного домена протеин-дисульфид-изомеразы". Белковая наука. 4 (12): 2587–93. Дои:10.1002 / pro.5560041216. ЧВК 2143042. PMID 8580850.
- Кемминк Дж., Дарби Н.Дж., Дейкстра К., Нилгес М., Крейтон Т.Е. (июнь 1996 г.). «Определение структуры N-концевого тиоредоксиноподобного домена протеиндисульфидизомеразы с использованием многомерной гетероядерной 13C / 15N ЯМР-спектроскопии». Биохимия. 35 (24): 7684–91. Дои:10.1021 / bi960335m. PMID 8672469.
- Джи Х., Рид Г.Е., Мориц Р.Л., Эддес Дж.С., Берджесс А.В., Симпсон Р.Дж. (1997). «Двумерная база данных гелей белков карциномы толстой кишки человека». Электрофорез. 18 (3–4): 605–13. Дои:10.1002 / elps.1150180344. PMID 9150948. S2CID 25454450.