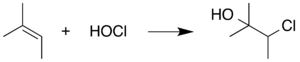WikiDer > Пинник окисление
| Пинник окисление | |
|---|---|
| Названный в честь | Гарольд В. Пинник |
| Тип реакции | Органическая окислительно-восстановительная реакция |
В Пинник окисление является органическая реакция по которому альдегиды могут быть окислены до их соответствующих карбоновые кислоты с помощью хлорит натрия (NaClO2) под мягким кислый условия. Первоначально он был разработан Линдгреном и Нильссоном.[1] Типичные условия реакции, используемые сегодня, были разработаны Г. А. Краусом.[2][3] H.W. Позже Пинник продемонстрировал, что эти условия могут применяться для окисления α, β-ненасыщенных альдегидов.[4] Существует множество различных реакций окисления альдегидов, но только некоторые из них поддаются широкому диапазону функциональные группы. Окисление Пинника оказалось устойчивым к чувствительным функциям и способно реагировать с стерически затрудненный группы. Эта реакция особенно полезна для окисления α, β-ненасыщенных альдегидов, и еще одним ее преимуществом является относительно низкая стоимость.[4][5]
Механизм
Предлагаемый механизм реакции вовлекает хлористая кислота как активный окислитель, образующийся в кислых условиях из хлорита.
- ClO2− + H2PO4− ⇌ HClO2 + HPO42−
Сначала к альдегиду присоединяется хлорноватистая кислота. Затем полученная структура подвергается перициклическая фрагментация в котором водород альдегида переносится на кислород на хлоре, при этом группа хлора высвобождается в виде хлорноватистая кислота (HOCl).[6]
Побочные реакции и поглотители
Побочный продукт HOCl, который сам по себе является реактивным окислителем, может быть проблемой по нескольким причинам.[6] Он может разрушить NaClO2 реагент:
- HOCl + 2ClO2− → 2ClO2 + Cl− + ОН−
делая его недоступным для желаемой реакции. Это также может вызвать другие нежелательные побочные реакции с органическими материалами. Например, HOCl может реагировать с двойными связями в органическом реагенте или продукте через реакция образования галогидрина.
Чтобы предотвратить помехи от HOCl, мусорщик обычно добавляется в реакцию для поглощения HOCl по мере его образования. Например, можно воспользоваться склонностью HOCl подвергаться этой реакции присоединения, добавляя жертвенное алкенсодержащее химическое вещество к реакционной смеси. Этот альтернативный субстрат вступает в реакцию с HOCl, предотвращая реакции HOCl, которые мешают самой реакции Пинника. 2-метил-2-бутен в этом контексте часто используется:
Резорцин и сульфаминовая кислота также являются обычными реагентами-поглотителями.[6][7]
Пероксид водорода (ЧАС2О2) может использоваться в качестве поглотителя HOCl, побочные продукты которого не вмешиваются в реакцию окисления Пинника:
- HOCl + H2О2 → HCl + O2 + H2О
В слабо кислый состояние, довольно концентрированный (35%) H2О2 раствор подвергается быстрой окислительной реакции без конкурентной реакции восстановления HClO2 чтобы сформировать HOCl.
- HClO2 + H2О2 → HOCl + O2 + H2О
Диоксид хлора быстро реагирует с H2О2 формировать хлористая кислота.
- 2ClO2 + H2О2 → 2HClO2 + O2
Также формирование кислород дает хорошее представление о ходе реакции. ДМСО был использован вместо H2О2 для окисления реакций, которые не дают больших выходов, с использованием только H2О2. В эту категорию попадают в основном альдегиды, богатые электронами.[7] (См. Ограничение ниже)
Кроме того, реагенты на твердой основе, такие как фосфатно-буферные силикагель при поддержке перманганат калия и хлорит на полимерной подложке были приготовлены и использованы для превращения альдегидов в карбоновую кислоту без необходимости проведения обычных процедур обработки. Реакция включает улавливание продукта на силикагеле в виде его солей калия. Таким образом, эта процедура облегчает удаление нейтральных примесей путем промывки органические растворители.[8]
Объем и ограничения
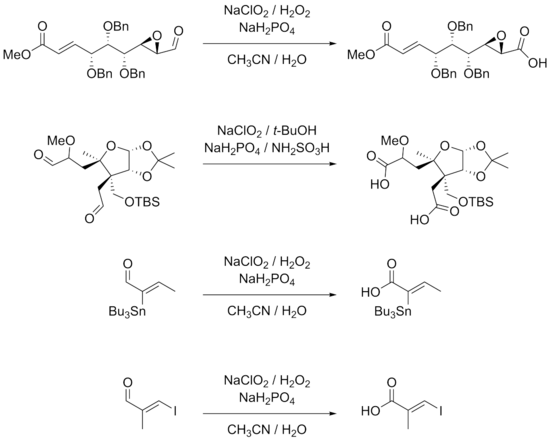
Реакция хорошо подходит для субстратов с множеством функциональных групп. β-арил-замещенный α, β-ненасыщенный альдегиды хорошо работают с условиями реакции. Тройные связи, непосредственно связанные с альдегидными группами или в спряжение с другими двойными связями также могут быть подвергнуты реакции.[7][9] Гидроксиды, эпоксиды, бензил эфиры, галогениды включая йодиды и даже станнаны довольно стабильны в реакции.[7][9][10][11] Примеры реакций, показанных ниже, также показывают, что стереоцентры α-атомов углерода остаются нетронутыми, в то время как двойные связи, особенно тризамещенные двойные связи, не претерпевают изменений. E/Z–Изомеризация в реакции.
Более низкие выходы получаются для реакций с участием алифатический α, β-ненасыщенные и более гидрофильные альдегиды. Двойные связи и богатые электронами альдегидные субстраты могут привести к хлорированию в качестве альтернативной реакции. Использование ДМСО в этих случаях дает лучший выход. Незащищенный ароматный амины и пирролы также не подходят для реакций. В частности, хиральные α-аминоальдегиды плохо реагируют из-за эпимеризации и из-за того, что аминогруппы могут быть легко преобразованы в соответствующие им группы. N-оксиды. Стандарт защитная группа подходы, такие как использование т-BOC, являются жизнеспособным решением этих проблем.[12]
Тиоэфиры также очень подвержены окислению. Например, окисление по Пиннику тиоанисальдегид дает высокий выход продуктов карбоновой кислоты, но с сопутствующим превращением тиоэфира в сульфоксид или же сульфон.[7]
Смотрите также
Рекомендации
- ^ Lindgren, Bengt O .; Нильссон, Торстен; Хусебай, Стейнар; Микалсен, ØYvind; Леандер, Курт; Сван, Карл-Гуннар (1973). «Получение карбоновых кислот из альдегидов (включая гидроксилированные бензальдегиды) окислением хлоритом». Acta Chem. Сканд. 27: 888–890. Дои:10.3891 / acta.chem.scand.27-0888.
- ^ Джордж А. Краус; Брюс Рот (1980). «Синтетические исследования веррукарола. 2. Синтез кольцевой системы AB». J. Org. Chem. 45 (24): 4825–4830. Дои:10.1021 / jo01312a004.
- ^ Джордж А. Краус; Майкл Дж. Ташнер (1980). «Модельные исследования для синтеза квассиноидов. 1. Построение кольцевой системы BCE». J. Org. Chem. 45 (6): 1175–1176. Дои:10.1021 / jo01294a058.
- ^ а б Bal, B.S .; Childers, W.E .; Пинник, Х.В. (1981). «Окисление α, β-ненасыщенных альдегидов». Тетраэдр. 37 (11): 2091–2096. Дои:10.1016 / S0040-4020 (01) 97963-3.
- ^ Mundy, B.J .; Эллерд, Майкл Дж .; Фавалоро, Фрэнк Г. (2005). «Пинник Оксидейшн». Назовите реакции и реагенты в органическом синтезе. Джон Уайли и сыновья. п. 518. ISBN 978-0-471-22854-7.
- ^ а б c Курти, Ласло; Чако, Барбара (2005). «Пинник Оксидейшн». Стратегические применения названных реакций в органическом синтезе: предпосылки и подробные механизмы. Эльзевир. С. 354–356. ISBN 9780124297852.
- ^ а б c d е Dalcanale, E; Монтанари, Ф (1986). «Селективное окисление альдегидов до карбоновых кислот с помощью хлорита натрия-перекиси водорода». J. Org. Chem. 51 (4): 567–569. Дои:10.1021 / jo00354a037.
- ^ Takemoto, T .; Ясуда, К .; Лей, С.В. (2001). «Реагенты на твердой подложке для окисления альдегидов до карбоновых кислот». Synlett. 2001 (10): 1555–1556. Дои:10.1055 / с-2001-17448.
- ^ а б Raach, A .; Райзер, О. (2000). «Хлорит натрия-перекись водорода, мягкий и селективный реагент для окисления альдегидов до карбоновых кислот». J. Prakt. Chem. 342 (6): 605–608. Дои:10.1002 / 1521-3897 (200006) 342: 6 <605 :: aid-prac605> 3.0.co; 2-i.
- ^ Ishihara, J .; Hagihara, K .; Chiba, H .; Ито, К .; Yanagisawa, Y .; Totani, K; Тадано, К. (2000). «Синтетические исследования вириденомицина. Построение части циклопентенкарбоновой кислоты». Tetrahedron Lett. 41 (11): 1771–1774. Дои:10.1016 / S0040-4039 (00) 00013-7.
- ^ Kuramochi, K .; Nagata, S .; Itaya, H .; Takao, H .; Кобаяши, С. (1999). «Конвергентный полный синтез эполактаена: применение стратегии оксиранилового аниона на плацдарме». Tetrahedron Lett. 40 (41): 7371–7374. Дои:10.1016 / S0040-4039 (99) 01512-9.
- ^ Dehoux, C .; Fontaine, E .; Escudier, J .; Балтас, М .; Горрихон, Л. (1998). «Полный синтез аналога тимидин 2-дезоксиполиоксина C». J. Org. Chem. 63 (8): 2601–2608. Дои:10.1021 / jo972116s. PMID 11672125.
| Викискладе есть медиафайлы по теме Пинник окисление. |