WikiDer > Полиоксометаллат
В химия, а полиоксометаллат (сокращенно ПОМ) это многоатомный ион, обычно анион, состоящий из трех или более переходный металл оксианионы связаны вместе общим кислород атомы образуют замкнутые трехмерные каркасы. Атомы металлов обычно группа 6 (Пн, З) или реже группа 5 (V, Nb, Ta) переходные металлы в их высокой состояния окисления. Обычно они бесцветные или оранжевые, диамагнитный анионы. Различают два широких семейства: изополиметаллаты, состоящие только из одного вида металлов и окись, и гетерополиметалаты, состоящие из одного металла, оксида и оксианиона основной группы (фосфат, силикат, так далее.). Существует множество исключений из этих общих утверждений.
Формирование
Оксиды d0 металлы, такие как V2О5, MoO3, WO3 раствориться в высоком pH давать ортометалаты, VO3−
4, МоО2−
4, WO2−
4. Для Nb2О5 и Та2О5, природа растворенных частиц менее ясна. При понижении pH эти ортометалаты протонировать с образованием оксидно-гидроксидных соединений, таких как W (ОН) O−
3 и В (ОН) О2−
3. Эти виды конденсируются посредством процесса, называемого олация. Конденсация происходит за счет потери воды и образования связей M – O – M. Сокращенная последовательность конденсации, проиллюстрированная ванадатами:[1]
- 4 VO3−
4 + 8 часов+ → V
4О4−
12 + 4 часа2О - 2 1⁄2 V
4О4−
12 + 6 часов+ → V
10О
26(ОЙ)4−
2 + 2 часа2О
Когда такое подкисление проводится в присутствии фосфат или силикат, то получается гетерополиметаллат. Например, фосфовольфрамат-анион PW
12О3−
40 состоит из двенадцати рамок восьмигранный оксианионы вольфрама, окружающие центральный фосфат группа.
Сборка полиоксометаллатов при подкислении растворов является примером ковалентный самосборка. Этот процесс дает однородные решения высокоорганизованных структур. При определенном наборе условий образуется только одна структура полиоксометаллата или ее небольшое подмножество. Факты показывают, что это происходит по механизму типа плотной фазы, при котором сначала небольшие оксометалат-ионы собирать нековалентно формировать супрамолекулярные структуры это может тогда конденсировать с образованием ковалентно связанного полиоксометаллата.[2]
История
Первый пример соединения полиоксометаллата был фосфомолибдат аммония, содержащий PMo
12О3−
40 анион, открытый в 1826 году.[3] Этот анион имеет ту же структуру, что и анион фосфовольфрамата, о структуре которого было сообщено в 1934 году. Эта структура называется Структура Кеггина после его первооткрывателя.[4] После этого открытия были обнаружены другие фундаментальные структуры, такие как ион Уэллса – Доусона, а также определен их химический состав и применение в качестве катализаторов.
Рамаззоит, первый образец минерала с катионом полиоксометаллата, был обнаружен в 2016 году в Mt. Шахта Рамаццо, Лигурия, Италия. Об этом полиоксометаллате не сообщалось в составе синтетического соединения.[5]
Структура

Повторяются определенные структурные мотивы. Ион Кеггина, например, является общим как для молибдатов, так и для вольфраматов с различными центральными гетероатомами. Примеры некоторых основных структур полиоксометаллата показаны ниже. Ион Линдквиста и остальные структуры первого ряда на следующем рисунке являются iso-полиоксометаллаты (в данном случае изополианионы), поскольку в их составе участвует только один тип атомов переходных металлов. Остальные конструкции относятся к гетеро-полиоксометаллат (гетерополианионы), поскольку они включают более одного типа атомов металла. Структуры Кеггина и Доусона имеют тетраэдрически-координированные гетероатомы, такие как п или Si, а структура Андерсона[6] имеет восьмигранный центральный атом, такой как алюминий.
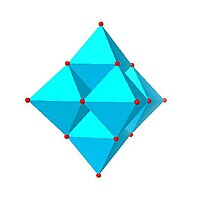 |  | 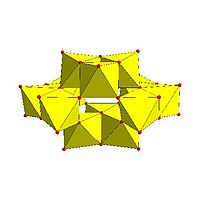 |  |
| Гексамолибдат Линдквиста, Пн 6О2− 19 | Декаванадат, V 10О6− 28 | Паравольфрамат B, ЧАС 2W 12О10− 42 | Пн36-полимолибдат, Пн 36О 112(ЧАС 2O)8− 16 |
 |  |  | |
| Структура Страндберга, HP 2Пн 5О4− 23 | Структура Кеггина, XM 12Оп− 40 | Структура Доусона, Икс 2M 18Оп− 62 | |
 |  |  |  |
| Структура Андерсона, XM 6Оп− 24 | Структура Аллмана – Во, XM 9Оп− 32 | Структура Уикли – Ямаса, XM 10Оп− 36 | Структура Декстера – Сильвертона, XM 12Оп− 42 |
Полиоксомолибдаты включают колеса в форме молибденовый синий анионы и сферические кеплераты. Многочисленные гибридные органо-неорганические материалы, содержащие ядра ПОМ,[7][8] новые потенциальные приложения на основе необычных магнитных[9] и оптический[10] свойства некоторых ПОМ и потенциальные медицинские применения, такие как противоопухолевые,[11] антибактериальный[12] и противовирусное использование.
Фреймворк
Типичные строительные блоки каркаса: многогранник агрегаты с 4-, 5-, 6- или 7-координатными металлическими центрами. Эти единицы имеют общие ребра и / или вершины, или, реже, грани (например, в ионном CeMo
12О8−
42, имеющий общие октаэдры с атомами Mo в вершинах икосаэдра).[13]
Наиболее распространенным звеном для полимолибдатов является октаэдрический {MoO6}, часто искажается из-за того, что атом Mo находится вне центра, давая одну более короткую связь Mo – O. Некоторые полимолибдаты содержат пятиугольный бипирамидальный единицы; это ключевые строительные блоки в молибденовый блюз.
Гетероатомы

Гетероатомы присутствуют во многих полиоксометаллатах. Многие различные элементы могут служить гетероатомами с различными координационные номера:
- 4-х координатный (четырехгранный) в Кеггин, Структуры Доусона и Линдквиста (например, PO3−
4, SiO4−
4, AsO3−
4) - 6-координатный (восьмигранный) в структуре Андерсона (например, Al (ОН)3−
6, TeO6−
6) - 8-координатный (квадратный антипризматический) в (Исполнительный директор
8) W
10О8−
28 - 12-координатный (икосаэдр) в (UO
12) Пн
12О8−
30
Гетероатом может быть расположен в центре аниона, как в структуре Кеггина, или в центре структурного фрагмента, такого как два атома фосфора в ионе Доусона, которые являются центральными по отношению к его двум симметричным фрагментам.
Полиоксометаллаты имеют сходство с клатрат конструкции. Ион Кеггина, например, можно сформулировать как PO3−
4@M
12О
36, а Доусон как (XO2−
4)
2@M
18О
54.[нужна цитата] В @ обозначение обозначает физическое ограждение левой стороны в правой части. Однако, в отличие от клатратов, гостевые анионы не могут быть удалены обратимо.
Известны некоторые клеточные структуры, содержащие другие ионы. Например, ванадат клетка V18О42 может заключить Cl− ион.[14] Эта структура имеет 5-координатные квадратно-пирамидальные звенья ванадия, соединенные вместе.
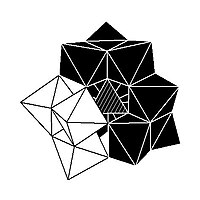
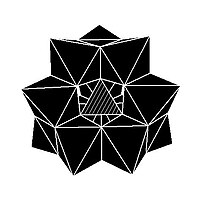
Изомерия
В некоторых ПОМ наблюдается изомерия. Например, структура Кеггина имеет 5 изомеров, которые получаются (концептуально) вращением одного или нескольких из четырех {M3О13} единиц через 60 °.[нужна цитата]
| α-XM 12Оп− 40 | β-XM 12Оп− 40 | γ-XM 12Оп− 40 | δ-XM 12Оп− 40 | ε-XM 12Оп− 40 |
|---|---|---|---|---|
 |  |  |  |  |
Лакунарные структуры
Структура некоторых ПОМ является производной от более крупной структуры ПОМ путем удаления одного или нескольких добавленных атомов и сопутствующих им оксидных ионов, что дает дефектную структуру, называемую лакунарная структура. Примером соединения с лакунарной структурой Доусона является As2W15О56.[15] В 2014 году сообщалось о разновидностях ванадата с аналогичными селективными свойствами связывания металлов.[16]
Полиоксотанталаты, ниобаты и ванадаты
Свойства полиниобатов и политанталатов аналогичны, но существенно отличаются от полиоксованадатов. На самом деле поливанадаты больше похожи на оксомолибдаты и вольфраматы.[17]
Сходство между полиниобатами и политанталатами проистекает в первую очередь из эквивалентности заряда их стабильного иона 5+ и их размера (64вечера) из-за сокращение лантаноидов. Наиболее частыми членами являются M
6О8−
19 (M = Nb, Ta), которые принимают структуру Линдквиста. Эти октаанионы образуются в сильно основных условиях из щелочных расплавов протяженных оксидов металлов (M2О5), а в случае Nb - даже из смесей ниобиевой кислоты и гидроксидов щелочных металлов в водном растворе. Гексатанталат можно также получить конденсацией пероксотанталата. Та (O
2)3−
4 в щелочной среде.[18] Эти полиоксометаллаты обнаруживают аномальную тенденцию растворимости в воде их солей щелочных металлов, поскольку их Cs+ и Rb+ соли более растворимы, чем их Na+ и Ли+ соли. Противоположная тенденция наблюдается в группа 6 ПОМ.[19] Декаметалаты с формулой M
10О6−
28 (M = Nb,[20] Та[21]) изоструктурны декаванадату и образуются исключительно за счет разделения ребер {MO6} октаэдры, тогда как структура декавольфрамата W
10О4−
32 состоит из вольфрамовых октаэдров с общими ребрами и общими углами.
Оксоалкоксометаллаты
Оксоалкоксометаллаты представляют собой кластеры, содержащие как оксидные, так и алкоксидные лиганды.[22] Обычно в них отсутствуют концевые оксолиганды. Примеры включают додекатитанат Ti12О16(OPri)16 (где OPri означает алкокси группа),[23] оксоалкоксометаллаты железа[24] и железо[25] и медь[26] Ионы Кеггина.
Сульфидо, имидо и др. О-замещенные оксометаллаты
Терминальные оксидные центры полиоксометаллатного каркаса в некоторых случаях могут быть заменены другими лигандами, такими как S2−, Br−, и NR2−.[3][27] Серозамещенные ПОМ называются полиоксотиометаллаты. Также были продемонстрированы другие лиганды, заменяющие ионы оксида, такие как нитрозил и алкокси группы.[22][28]
Приложения
ПОМ используются в качестве промышленных катализаторов окисления органических соединений.[29][30]
Потенциальные и новые приложения
Диапазон размеров, структуры и элементного состава полиоксометаллатов приводит к широкому диапазону свойств и соответствующему широкому диапазону потенциальных применений. Некоторые из приложений включают следующее:
- «Зеленое» окисление катализаторы как альтернатива хлорпроцессы отбеливания древесной массы,[31] метод обеззараживания воды,[32] и способ каталитического производства муравьиной кислоты из биомассы (OxFA процесс).[33] Было показано, что полиоксометаллаты катализируют расщепление воды.[34]
- энергонезависимое (постоянное) хранилище компоненты, также известные как флэш-память устройств.[35][36] Некоторые ПОМ обладают необычными магнитными свойствами.[37] и исследуются по мере возможности нанокомпьютер запоминающие устройства (см. кубиты).[38]
- В искусственный фотосинтезполиоксометаллаты, содержащие медь, были предложены в качестве катализаторов фотохимических расщепление воды и производство солнечного топлива.[39]
- Каталитическое эпоксидирование олефинов с использованием катализатора из модифицированного полиоксометаллата серебра (Ag / Ag-POM) и золотого катализатора, нанесенного на бариевую соль ПОМ (2% Au / BaPOM), очень важно в химической промышленности, поскольку эпоксиды являются универсальными и важными промежуточными продуктами. в синтезе многих тонких химикатов и фармацевтических препаратов.
Биомедицинские исследования
Потенциал противоопухолевый и противовирусное средство наркотики.[40] Полиоксомолибдаты и гептамолибдаты типа Андерсона проявляют активность по подавлению роста некоторых опухолей. В случае (NH3Pr)6[Пн7О24], активность связана с его окислительно-восстановительными свойствами.[41][42]
ПОМ со структурой Уэллса-Доусона может эффективно ингибировать агрегацию амилоида β (Aβ) в терапевтической стратегии болезни Альцгеймера.[43]
использованная литература
- ^ Greenwood, N. N .; Эрншоу, А. (1997). Химия элементов (2-е изд.). Оксфорд: Баттерворт-Хайнеманн. ISBN 978-0-7506-3365-9.
- ^ Шрайбер, Рой Э .; Аврам, Лиат; Нойман, Ронни (2018). «Самосборка посредством нековалентной предварительной организации реагентов: объяснение образования полифтороксометаллата». Химия - Европейский журнал. 24 (2): 369–379. Дои:10.1002 / chem.201704287. PMID 29064591.
- ^ а б Gouzerh, P .; Че, М. (2006). «От Шееле и Берцелиуса до Мюллера: новый взгляд на полиоксометаллаты (ПОМ) и« недостающее звено »между подходами снизу вверх и сверху вниз». L'Actualité Chimique. 298: 9.
- ^ Кеггин, Дж. Ф. (1934). «Структура и формула 12-фосфорновольфрамовой кислоты». Proc. Рой. Soc. А. 144 (851): 75–100. Bibcode:1934РСПСА.144 ... 75К. Дои:10.1098 / rspa.1934.0035.
- ^ Кампф, Энтони Р .; Россман, Джордж Р .; Ма, Чи; Бельмонте, Донато; Бьяджони, Кристиан; Кастелларо, Фабрицио; Кьяппино, Луиджи (4 апреля 2018 г.). «Рамаззоит, [Mg8Cu12 (PO4) (CO3) 4 (OH) 24 (H2O) 20] [(H0.33SO4) 3 (H2O) 36], первый минерал с катионом полиоксометаллата»). Европейский журнал минералогии. 30 (4): 182–186. Bibcode:2018EJMin..30..827K. Дои:10.1127 / ejm / 2018 / 0030-2748. Получено 21 мая 2018.
- ^ Блажевич, Амир; Ромпель, Аннетт (январь 2016 г.). «Полиоксометаллат Андерсона – Эванса: от неорганических строительных блоков через гибридные органо-неорганические структуры к завтрашнему дню» Bio-POM"". Обзоры координационной химии. 307: 42–64. Дои:10.1016 / j.ccr.2015.07.001.
- ^ Песня, Ю.-Ф .; Лонг, Д.-Л .; Кронин, Л. (2007). «Нековалентно связанные каркасы с наноразмерными каналами, собранные из связанного гибрида полиоксометаллата и пирена». Энгью. Chem. Int. Эд. 46 (21): 3900–3904. Дои:10.1002 / anie.200604734. PMID 17429852.
- ^ Го, Хун-Сюй; Лю, Ши-Сюн (2004). "Новый трехмерный органо-неорганический гибрид на основе сэндвич-гетерополимолибдата кадмия: [Cd4(ЧАС2O)2(2,2′-б.п.)2] Cd [Mo6О12(ОЙ)3(PO4)2(HPO4)2]2 [Пн2О4(2,2′-б.п.)2]2· 3H2О ". Связь по неорганической химии. 7 (11): 1217. Дои:10.1016 / j.inoche.2004.09.010.
- ^ Мюллер, Ахим; Любан, Маршалл; Модлер, Роберт; Кегерлер, Пауль; Аксенович Мария; Шнак, Юрген; Кэнфилд, Пол; Будко, Сергей; Харрисон, Нил (2001). «Классический и квантовый магнетизм в гигантских кеплератных магнитных молекулах». ХимФисХим. 2 (8–9): 517–521. Дои:10.1002 / 1439-7641 (20010917) 2: 8/9 <517 :: aid-cphc517> 3.0.co; 2-1. PMID 23686989.
- ^ Шнак, Юрген; Брюгер, Мирко; Любан, Маршалл; Кегерлер, Пауль; Моросан, Эмилия; Фукс, Рональд; Модлер, Роберт; Нодзири, Хироюки; Rai, Ram C .; Цао, Дзинбо; Musfeldt, Дженис; Вэй, Син (2006). «Зависимые от поля магнитные параметры в Ni4Пн12: Магнитострикция на молекулярном уровне? ». Phys. Ред. B. 73 (9): 094401. arXiv:cond-mat / 0509476. Bibcode:2006PhRvB..73i4401S. Дои:10.1103 / Physrevb.73.094401.
- ^ Биелич, Александар; Аурелиано, Мануэль; Ромпель, Аннет (2019-03-04). «Полиоксометаллаты как потенциальные металлопрепараты следующего поколения в борьбе с раком». Angewandte Chemie International Edition. 58 (10): 2980–2999. Дои:10.1002 / anie.201803868. ISSN 1433-7851. ЧВК 6391951. PMID 29893459.
- ^ Биелич, Александар; Аурелиано, Мануэль; Ромпель, Аннетт (2018). «Антибактериальная активность полиоксометаллатов: структуры, антибиотические эффекты и перспективы на будущее». Химические коммуникации. 54 (10): 1153–1169. Дои:10.1039 / C7CC07549A. ISSN 1359-7345. ЧВК 5804480. PMID 29355262.
- ^ Декстер, Д. Д .; Сильвертон, Дж. В. (1968). «Новый структурный тип гетерополистических анионов. Кристаллическая структура (NH4)2ЧАС6(CeMo12О42) · 12H2О ". Варенье. Chem. Soc. 1968 (13): 3589–3590. Дои:10.1021 / ja01015a067.
- ^ Мюллер, А .; Reuter, H .; Диллинджер, С. (1995). «Супрамолекулярная неорганическая химия: маленькие гости в малых и больших группах». Энгью. Chem. Int. Эд. Англ.. 34 (21): 2328–2361. Дои:10.1002 / anie.199523281.
- ^ Мбомбекалле, И. М .; Keita, B .; Nadjo, L .; Berthet, P .; Neiwert, W. A .; Hill, C.L .; Ritorto, M.D .; Андерсон, Т. М. (2003). «Марганцевые гетерополивольфраматы. Синтез и эффекты гетероатомов в сэндвич-комплексах, производных Уэллса-Доусона». Дальтон Транс. 2003 (13): 2646–2650. Дои:10.1039 / b304255c.
- ^ Кастнер, К .; Margraf, J. T .; Clark, T .; Стреб, К. (2014). «Стратегия молекулярного заполнителя для доступа к семейству кластеров оксида ванадия, функционализированных переходными металлами». Chem. Евро. J. 20 (38): 12269–12273. Дои:10.1002 / chem.201403592. PMID 25082170.
- ^ Хаяси, Ёсихито (2011). «Химия гетеро и лакунарных полиоксованадатов: синтез, реакционная способность и структурные аспекты». Coord. Chem. Rev. 255 (19–20): 2270–2280. Дои:10.1016 / j.ccr.2011.02.013. HDL:2297/29199.
- ^ Fullmer, L.B .; Molina, P. I .; Антонио, M. R .; Найман, М. (2014). «Противоположное поведение ионной ассоциации полиоксометаллатов Ta и Nb». Дальтон Транс. 2014 (41): 15295–15299. Дои:10.1039 / C4DT02394C. PMID 25189708.
- ^ Андерсон, Т. М .; Thoma, S.G .; Bonhomme, F .; Родригес, М. А .; Парк, H .; Parise, J. B .; Алан, Т. М .; Larentzos, J. P .; Найман, М. (2007). "Литиевые полиниобаты. Литий-водный адамантановый кластер на основе Линдквиста и превращение гексаниобата в дискретный комплекс Кеггина". Рост кристаллов и дизайн. 7 (4): 719–723. Дои:10.1021 / cg0606904.
- ^ Graeber, E.J .; Моросин, Б. (1977). «Молекулярная конфигурация иона деканиобата (Nb17О286−)". Acta Crystallographica B. 33 (7): 2137–2143. Дои:10.1107 / S0567740877007900.
- ^ Matsumoto, M .; Ozawa, Y .; Ягасаки, А .; Жэ Ю. (2013). «Декатанталат - последний член семейства декаметалатов пятой группы». Неорг. Chem. 52 (14): 7825–7827. Дои:10.1021 / ic400864e. PMID 23795610.
- ^ а б Папа, Майкл Тор; Мюллер, Ахим (1994). Полиоксометаллаты: от платоновых твердых тел до антиретровирусной активности. Springer. ISBN 978-0-7923-2421-8.
- ^ День, В. З .; Eberspacher, T. A .; Klemperer, W. G .; Парк, К. В. (1993). «Додекатитанаты: новое семейство стабильных полиоксотитанатов». Варенье. Chem. Soc. 115 (18): 8469–8470. Дои:10.1021 / ja00071a075.
- ^ Бино, Ави; Ардон, Майкл; Ли, Донгвэн; Спинглер, Бернхард; Липпард, Стивен Дж. (2002). «Синтез и структура [Fe13О4F24(OMe)12]5−: Первый Ион Кеггина с открытой оболочкой ". Варенье. Chem. Soc. 124 (17): 4578–4579. Дои:10.1021 / ja025590a. PMID 11971702.
- ^ Садеги, Омид; Захаров, Лев Н .; Найман, май (2015). «Водное образование и манипуляции железо-оксо ионом Кеггина». Наука. 347 (6228): 1359–1362. Bibcode:2015Научный ... 347.1359S. Дои:10.1126 / science.aaa4620. PMID 25721507.
- ^ Кондински, А .; Монахов, К. (2017). «Разрыв гордиева узла в структурной химии полиоксометаллатов: медь (II) –Oxo / Hydroxo Clusters». Химия: европейский журнал. 23 (33): 7841–7852. Дои:10.1002 / chem.201605876. PMID 28083988.
- ^ Эррингтон, Р. Джон; Wingad, Ричард Л .; Клегг, Уильям; Эльсегуд, Марк Р. Дж. (2000). "Прямое бромирование фрагментов Кеггина с получением [PW9О28Br6]3−: Полиоксавольфрамат с гексабромированным лицом ". Энгью. Chem. 39 (21): 3884–3886. Дои:10.1002 / 1521-3773 (20001103) 39:21 <3884 :: AID-ANIE3884> 3.0.CO; 2-M.
- ^ Gouzerh, P .; Jeannin, Y .; Пруст, А .; Роберт, Ф .; Ро, С.-Г. (1993). «Функционализация полиоксомолибдатов: на примере нитрозильных производных». Мол. Англ.. 3 (1–3): 79–91. Дои:10.1007 / BF00999625.
- ^ Мисоно, Макото (1993). «Каталитическая химия твердых полиоксометаллатов и их промышленное применение». Мол. Англ.. 3 (1–3): 193–203. Дои:10.1007 / BF00999633.
- ^ Кожевников, Иван В. (1998). «Катализ гетерополикислотами и многокомпонентными полиоксометаллатами в жидкофазных реакциях». Chem. Rev. 98 (1): 171–198. Дои:10.1021 / cr960400y. PMID 11851502.
- ^ Gaspar, A.R .; Gamelas, J. A. F .; Евтугуин, Д. В .; Нето, К. П. (2007). «Альтернативы делигнификации лигноцеллюлозной пульпы с использованием полиоксометаллатов и кислорода: обзор». Green Chem. 9 (7): 717–730. Дои:10.1039 / b607824a.
- ^ Hiskia, A .; Troupis, A .; Antonaraki, S .; Gkika, E .; Кормали, П .; Папаконстантину, Э. (2006). «Фотокатализ полиоксометаллатов для очистки водной среды от органических и неорганических загрязнителей». Int. J. Env. Анальный. Chem. 86 (3–4): 233. Дои:10.1080/03067310500247520.
- ^ Wölfel, R .; Taccardi, N .; Bösmann, A .; Вассершайд, П. (2011). «Селективное каталитическое превращение углеводов биологического происхождения в муравьиную кислоту с использованием молекулярного кислорода». Green Chem. 13 (10): 2759. Дои:10.1039 / C1GC15434F.
- ^ Rausch, B .; Symes, M.D .; Chisholm, G .; Кронин, Л. (2014). «Отделенное каталитическое выделение водорода от окислительно-восстановительного медиатора оксида металла при расщеплении воды». Наука. 345 (6202): 1326–1330. Bibcode:2014Научный ... 345.1326R. Дои:10.1126 / science.1257443. PMID 25214625.
- ^ «Флэш-память нарушает наномасштаб», Индуистский.
- ^ Busche, C .; Vila-Nadal, L .; Ян, Дж .; Miras, H.N .; Лонг, Д.-Л .; Георгиев, В. П .; Асенов, А .; Pedersen, R.H .; Gadegaard, N .; Мирза, М. М .; Пол, Д. Дж .; Poblet, J.M .; Кронин, Л. (2014). «Разработка и изготовление запоминающих устройств на основе наноразмерных кластеров полиоксометаллата». Природа. 515 (7528): 545–549. Bibcode:2014Натура.515..545Б. Дои:10.1038 / природа13951. PMID 25409147.
- ^ Мюллер, А .; Sessoli, R .; Krickemeyer, E .; Bögge, H; Meyer, J .; Gatteschi, D .; Pardi, L .; Westphal, J .; Hovemeier, K .; Rohlfing, R .; Деринг, Дж; Hellweg, F .; Beugholt, C .; Шмидтманн, М. (1997). «Полиоксованадаты: высокоядерные спиновые кластеры с интересными системами хозяин-гость и различными электронными популяциями. Синтез, организация спинов, магнитохимия и спектроскопические исследования». Неорг. Chem. 36 (23): 5239–5240. Дои:10.1021 / ic9703641.
- ^ Lehmann, J .; Gaita-Ariño, A .; Coronado, E .; Потеря, Д. (2007). «Спиновые кубиты с электрически закрытыми молекулами полиоксометаллата». Нанотехнологии. 2 (5): 312–317. arXiv:cond-mat / 0703501. Bibcode:2007НатНа ... 2..312л. Дои:10.1038 / nnano.2007.110. PMID 18654290.
- ^ Бувайло, Галина; Маханькова Валерия Г .; Кокозай, Владимир Н .; Омельченко, Ирина В .; Шишкина, Светлана В .; Езерская Юлия; Павлюк, Мария В .; Шилин, Сергей И. (2019). «Медьсодержащие гибридные соединения на основе чрезвычайно редкого [V2Mo6O26] 6– ПОМ в качестве катализаторов окисления воды». Границы неорганической химии. 6 (7): 1813–1823. Дои:10.1039 / C9QI00040B. ISSN 2052-1553.
- ^ Руле, Джеффри Т .; Hill, Craig L .; Джадд, Дебора А. (1998). «Полиоксометаллаты в медицине». Chem. Rev. 98 (1): 327–358. Дои:10.1021 / cr960396q. PMID 11851509.
- ^ Хазенкнопф, Бернольд; Бернольд; Hasenknopf (2005). «Полиоксометаллаты: введение в класс неорганических соединений и их биомедицинские применения». Границы биологических наук. 10 (1–3): 275–87. Дои:10.2741/1527. PMID 15574368.
- ^ Папа, Михаил; Мюллер, Ахим (1994). Полиоксометаллаты: от платоновых твердых тел до антиретровирусной активности - Springer. Темы молекулярной организации и инженерии. 10. С. 337–342. Дои:10.1007/978-94-011-0920-8. ISBN 978-94-010-4397-7.
- ^ Гао, Нан; Солнце, Ханьцзюнь; Донг, Кай; Рен, Джинсонг; Дуань, Тайчэн; Сюй, Джан; Цюй, Сяоган (04.03.2014). «Производные полиоксометаллата, замещенные переходным металлом, в качестве функциональных антиамилоидных агентов при болезни Альцгеймера». Nature Communications. 5: 3422. Bibcode:2014 НатКо ... 5,3422 г. Дои:10.1038 / ncomms4422. PMID 24595206.
дальнейшее чтение
- Long, D. L .; Burkholder, E .; Кронин, Л. (2007). «Кластеры полиоксометаллата, наноструктуры и материалы: от самосборки до дизайнерских материалов и устройств». Chem. Soc. Rev. 36 (1): 105–121. Дои:10.1039 / b502666k. PMID 17173149.
- Поуп, М. Т. (1983). Гетерополия и изополия оксометаллатов. Нью-Йорк: Springer Verlag.
- Папа, М. Т .; Мюллер, А. (1991). «Химия полиоксометаллата: старая область с новыми измерениями в нескольких дисциплинах». Энгью. Chem. Int. Эд. Англ.. 30: 34–48. Дои:10.1002 / anie.199100341.
- Хилл, К. Л. (1998). «Специальный объем по полиоксометаллатам». Chem. Rev. 98 (1): 1–2. Дои:10.1021 / cr960395y. PMID 11851497.
- Кронен, Лерой; Мюллер, Ахим (2012). Cronin, L .; Мюллер, А. (ред.). «Спецвыпуск по полиоксометаллатам». Chem. Soc. Rev. 2012 (22): 7325–7648. Дои:10.1039 / C2CS90087D. PMID 23052289.



