WikiDer > Реакция Сандмейера
| Реакция Сандмейера | |
|---|---|
| Названный в честь | Трауготт Сандмейер |
| Тип реакции | Реакция замещения |
| Идентификаторы | |
| Портал органической химии | реакция Сандмейера |
| RSC ID онтологии | RXNO: 0000021 |
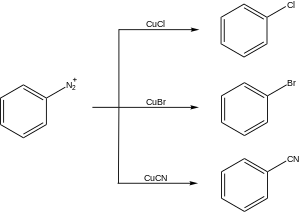
В Реакция Сандмейера это химическая реакция используется для синтеза арилгалогениды из арила соли диазония использование солей меди в качестве реагентов или катализаторов.[1][2][3]Это пример радикально-нуклеофильного ароматического замещения. Реакция Сандмейера обеспечивает метод, с помощью которого можно выполнять уникальные превращения бензола, такие как галогенирование, цианирование, трифторметилирование, и гидроксилирование.
Реакция была открыта в 1884 году швейцарским химиком. Трауготт Сандмейер, когда он попытался синтезировать фенилацетилен из хлорида бензолдиазония и ацетилид меди. Вместо этого основным продуктом, который он выделил, был фенилхлорид.[4] В наше время реакция Сандмейера относится к любому методу замещения ароматической аминогруппы путем получения ее диазониевой соли с последующим ее замещением нуклеофилом в присутствии каталитических солей меди (I). (Из-за низкой стоимости солей меди стехиометрическое количество часто используется для лучшей реакционной способности, даже когда возможен катализ.) Наиболее часто применяемыми реакциями Зандмейера являются реакции хлорирования, бромирования, цианирования и гидроксилирования с использованием CuCl, CuBr, CuCN, и Cu2O соответственно. Совсем недавно было разработано трифторметилирование солей диазония, которое называется реакцией «типа Сандмейера». Соли диазония также реагируют с боронатами, иодидом, тиолы, воды, гипофосфорная кислота и другие,[5] и фторирование можно проводить с использованием анионов тетрафторбората (Реакция Бальца – Шимана). Однако, поскольку эти процессы не требуют металлического катализатора, их обычно не называют реакциями Сандмейера. Во многих разработанных вариантах были также использованы соли других переходных металлов, включая медь (II), железо (III) и кобальт (III).[6] Благодаря своей широкой синтетической применимости, реакция Сандмейера, наряду с другими превращениями диазониевых соединений, дополняет электрофильное ароматическое замещение.
Условия и механизм реакции
В азотистая кислота обычно готовится на месте из нитрат натрия и кислота. После двух протонирование шагов, один эквивалент воды теряется, чтобы сформировать ион нитрозония. Ион нитрозония тогда действует как электрофил в реакции с ароматный (или же гетероциклический) амин, такой как анилин, с образованием соли диазония, проходя через нитрозамин средний.[5] Типичные условия реакции следующие:[7][8]
Хлорирование: ArN2+Cl–, CuCl, HCl (36% водн.), 50–100 ° C; бромирование: ArN2+HSO4–, CuBr, HBr (48% водн.), 50–100 ° C; цианирование: ArN2+Cl–, CuCN, KCN, H2О, бензол, 0 ° С; гидроксилирование: Cu2O, Cu (НЕТ3)2, H2О, 25 ° С.
Реакция Сандмейера является примером радикально-нуклеофильное ароматическое замещение (SRNАр). Радикальный механизм реакции Зандмейера подтверждается обнаружением биарил побочные продукты.[9] Замещение ароматической диазогруппы галогеном или псевдогалоген инициируется механизмом одноэлектронного переноса, катализируемым медью (I), с образованием арильный радикал с потерей газообразного азота.[10][11][12][9] Замещенный арена возможно, образуется путем прямого переноса Cl, Br, CN или OH от разновидностей меди (II) к арильному радикалу с образованием замещенного арена и регенерации катализатора на основе меди (I). В альтернативном предложении временное промежуточное соединение меди (III), образованное в результате связывания арильного радикала с разновидностями меди (II), подвергается быстрому восстановительному отщеплению с получением продукта и регенерацией меди (I).[13][14][15] Однако доказательства существования такого промежуточного медьорганического соединения являются слабыми и в основном косвенными.[16][17] и точный путь может зависеть от субстрата и условий реакции. Эти возможности показаны ниже.
Образование иона нитрозония
Образование иона бензолдиазония
Перенос одного электрона
Синтетические приложения
Варианты реакции Сандмейера были разработаны для различных синтетических применений. Эти реакции обычно протекают через образование арилдиазониевой соли с последующей реакцией с солью меди (I) с образованием замещенного арена в соответствии со схемой ниже.
Некоторые примеры синтетических применений реакции Сандмейера представлены ниже.
Галогенирование
Одним из наиболее важных применений реакции Сандмейера является образование арилгалогенидов. Выбранный растворитель для синтеза арил йодиды является дииодметан,[18][19] а для синтеза арилбромиды, бромоформ используется. Для синтеза арилхлориды, хлороформ является предпочтительным растворителем.[20] При синтезе (+) - куркуфенола, биологически активного соединения, которое проявляет противогрибковую и противораковую активность, используется реакция Зандмейера для замены аминогруппы на бромгруппу.[21]
В одном протоколе бромирования используется смесь Cu (I) / Cu (II) с дополнительными количествами двузубый лиганд фенантролин и катализатор межфазного переноса дибензо-18-краун-6 для превращения соли арилдиазония тетрафторбората в арилбромид.[22]
В Реакция Бальца – Шимана использует тетрафторборат и доставляет галогенидзамещенный продукт, фторбензол, что не получается при использовании фториды меди. В этой реакции проявляются мотивы, характерные для реакции Зандмейера.[23]
Цианирование
Другое использование реакции Сандмейера - цианирование что позволяет формировать бензонитрилы, важный класс органических соединений. Ключевой промежуточный продукт в синтезе антипсихотического препарата, Флуанксол, синтезируется путем цианирования по реакции Сандмейера.[24]
Реакция Сандмейера также использовалась в синтезе неоамфимедина, соединения, которое, как предполагается, нацелено на топоизомераза II как противораковое средство.[25]
Трифторметилирование
Было продемонстрировано, что реакции типа Сандмейера могут быть использованы для получения арильных соединений, функционализированных трифторметильными группами заместителей. Этот процесс трифторметилирование обеспечивает уникальные химические свойства с широким спектром практических применений. В частности, лекарственные препараты с МВ3 группы расширили метаболическая стабильность, липофильность, и биодоступность. Реакции трифторметилирования по типу Сандмейера характеризуются мягкими реакционными условиями и большей толерантностью по функциональным группам по сравнению с более ранними методами трифторметилирования.[26][27] Пример реакции трифторметилирования типа Сандмейера представлен ниже.[28]
Гидроксилирование
Реакция Зандмейера также может быть использована для превращения ариламинов в фенолы протекая через образование арилдиазониевой соли, как показано ниже.[8] В присутствии медного катализатора эта реакция легко протекает при комнатной температуре. Процедура, описанная Коэном и соавторами, требует использования закиси меди вместе с избытком нитрата меди в нейтральной воде. В этом отличие от классической процедуры (известной под немецким названием Verkochung, Verkochung), который требует кипячения диазониевой соли в водной кислоте, процесс, который, как полагают, включает арильный катион вместо радикала и, как известно, генерирует другие побочные продукты нуклеофильного присоединения в дополнение к желаемому продукту гидроксилирования.
Триазен
Обработка вторым эквивалентом анилина даст триазен. Сравните, например, Диминазен (Беренил) и Изометамидия хлорид.
Рекомендации
- ^ Трауготт Сандмейер (1884). "Ueber die Ersetzung der Amidgruppe durch Chlor in den aromatischen Substanzen". Berichte der deutschen chemischen Gesellschaft. 17 (3): 1633–1635. Дои:10.1002 / cber.18840170219.
- ^ Трауготт Сандмейер (1884). "Ueber die Ersetzung der Amid-gruppe durch Chlor, Brom und Cyan in den aromatischen Substanzen". Berichte der Deutschen Chemischen Gesellschaft. 17 (4): 2650–2653. Дои:10.1002 / cber.188401702202.
- ^ Людвиг Гаттерманн (1890). "Untersuchungen über Diazoverbindungen". Berichte der Deutschen Chemischen Gesellschaft. 23 (1): 1218–1228. Дои:10.1002 / cber.189002301199.
- ^ Ходжсон, Герберт Х. (1947-04-01). «Реакция Сандмейера». Химические обзоры. 40 (2): 251–277. Дои:10.1021 / cr60126a003. ISSN 0009-2665. PMID 20291034.
- ^ а б Ван, Зеронг (2010). «Реакция Сандмейера». Комплексные органические названия реакций и реагенты. John Wiley & Sons, Inc., стр. 2471–2475. ISBN 9780470638859.
- ^ М. П. Дойл, Б. Зигфрид и Дж. Ф. Деллария (1977). «Реакции дезаминирования алкилнитрита и галогенида металла. 2. Заместительное дезаминирование ариламинов алкилнитритами и галогенидами меди (II). Прямое и чрезвычайно эффективное превращение ариламинов в арилгалогениды». J. Org. Chem. 42 (14): 2426–2431. Дои:10.1021 / jo00434a017.
- ^ Чандлер, Норман, Р. О. (Ричард Освальд (1993). Принципы органического синтеза. Коксон, Дж. М. (Джеймс Моррис), 1941- (3-е изд.). Лондон: Blackie Academic & Professional. ISBN 978-0751401264. OCLC 27813843.
- ^ а б Коэн, Теодор; Дитц, Альберт Дж .; Мизер, Джейн Р. (1977-06-01). «Простое получение фенолов из ионов диазония путем образования и окисления арильных радикалов солями меди». Журнал органической химии. 42 (12): 2053–2058. Дои:10.1021 / jo00432a003. ISSN 0022-3263.
- ^ а б Галли, Карло (август 1988 г.). «Радикальные реакции ионов арендиазония: легкий вход в химию арильного радикала». Химические обзоры. 88 (5): 765–792. Дои:10.1021 / cr00087a004.
- ^ Дж. К. Кочи (1957). «Механизм реакций Сандмейера и Меервейна». Варенье. Chem. Soc. 79 (11): 2942–2948. Дои:10.1021 / ja01568a066.
- ^ Х. Х. Ходжсон (1947). «Реакция Сандмейера». Chem. Ред. 40 (2): 251–277. Дои:10.1021 / cr60126a003. PMID 20291034.
- ^ Nonhebel, D. C .; Уотерс, В. А. (8 октября 1957 г.). "Исследование механизма реакции Сандмейера". Труды Королевского общества A: математические, физические и инженерные науки. 242 (1228): 16–27. Bibcode:1957RSPSA.242 ... 16N. Дои:10.1098 / rspa.1957.0150. S2CID 97536209.
- ^ 1960-, Анслин, Эрик В. (2006). Современная физическая органическая химия. Догерти, Деннис А., 1952-. Саусалито, Калифорния: Университетская наука. ISBN 978-1891389313. OCLC 55600610.CS1 maint: числовые имена: список авторов (связь)
- ^ К., Воллхардт, К. Питер (29 января 2018 г.). Органическая химия: структура и функции. Schore, Neil Eric, 1948- (8-е изд.). Нью-Йорк. ISBN 9781319079451. OCLC 1007924903.
- ^ 1937-, Кэри, Фрэнсис А. (2007). Продвинутая органическая химия. Часть B, Реакции и синтез. Сандберг, Ричард Дж., 1938- (5-е изд.). Нью-Йорк, штат Нью-Йорк: Спрингер. ISBN 9781601195494. OCLC 223941000.CS1 maint: числовые имена: список авторов (связь)
- ^ Тиммс, Аллан В .; Уолтон, Пол Х .; Роуэлл, Саймон С .; Хэнсон, Питер (2004-06-28). «Содействие гидроксилированию Сандмейера (гомолитическому гидроксидиазонированию) и гидродиазонированию путем хелатирования медного катализатора: бидентатные лиганды». Органическая и биомолекулярная химия. 2 (13): 1838–1855. Дои:10.1039 / B404699D. ISSN 1477-0539. PMID 15227536.
- ^ Тиммс, Аллан В .; Уолтон, Пол Х .; Тейлор, Алек Б.; Роуэлл, Саймон С .; Хэнсон, Питер (2002-05-22). «Реакции Сандмейера. Часть 6. Механистическое исследование стадий восстановления и переноса лиганда при цианировании Сандмейера». Журнал химического общества, Perkin Transactions 2. 0 (6): 1126–1134. Дои:10.1039 / B200747A. ISSN 1364-5471.
- ^ В. Б. Смит; О. К. Хо (1990). «Применение изоамилнитрит-дииодметанового пути к арилиодидам». J. Org. Chem. 55 (8): 2543–2545. Дои:10.1021 / jo00295a056.
- ^ В. Наир; С. Г. Ричардсон (1982). «Модификация оснований нуклеиновых кислот с помощью радикальных промежуточных соединений: синтез дигалогенированных пуриновых нуклеозидов». Синтез. 1982 (8): 670–672. Дои:10.1055 / с-1982-29896.
- ^ Дж. И. Г. Кадоган; Д. А. Рой; Д. М. Смит (1966). «Альтернатива реакции Сандмейера». J. Chem. Soc.: 1249–1250. Дои:10.1039 / J39660001249.
- ^ Ким, Сун-Гон; Ким, Джэхак; Юнг, Хиджунг (апрель 2005 г.). «Эффективный полный синтез (+) - куркуфенола посредством асимметричного органокатализа». Буквы Тетраэдра. 46 (14): 2437–2439. Дои:10.1016 / j.tetlet.2005.02.047.
- ^ П. Белецкая; Александр Сергеевич Сигеев; Александр Сергеевич Перегудов; Павел В. Петровский (2007). «Каталитическое бромирование Сандмейера». Синтез. 2007 (16): 2534–2538. Дои:10.1055 / с-2007-983784.
- ^ Ван, Зеронг (2009). Исчерпывающие органические названия реакций и реагентов. Хобокен, штат Нью-Джерси: Джон Вили. С. 185–190. ISBN 9780471704508.
- ^ Нильсен, Мартин Анкер; Нильсен, Майкл Ким; Питтелькоу, Томас (ноябрь 2004 г.). «Масштабирование и оценка безопасности реакции Сандмейера». Исследования и разработки в области органических процессов. 8 (6): 1059–1064. Дои:10.1021 / op0498823.
- ^ LaBarbera, Daniel V .; Bugni, Tim S .; Ирландия, Крис М. (октябрь 2007 г.). «Полный синтез неоамфимедина». Журнал органической химии. 72 (22): 8501–8505. Дои:10.1021 / jo7017813. ЧВК 2547140. PMID 17900144.
- ^ Браун, Дункан Л. (3 февраля 2014 г.). «Трифторметилирующая реакция Сандмейера: метод превращения C-N в C-CF». Angewandte Chemie International Edition. 53 (6): 1482–1484. Дои:10.1002 / anie.201308997. PMID 24376150.
- ^ Дай, Цзянь-Цзюнь; Клык, Чи; Сяо, Бинь; Йи, июнь; Сюй, Цзюнь; Лю, Чжао-Цзин; Лу, Си; Лю, Лэй; Фу, Яо (12 июня 2013 г.). «Медь-промотируемая реакция трифторметилирования Сандмейера». Журнал Американского химического общества. 135 (23): 8436–8439. Дои:10.1021 / ja404217t. PMID 23718557.
- ^ Данун, Грегори; Баярманьяй, Бильгуун; Грюнберг, Маттиас Ф .; Гуссен, Лукас Й. (29 июля 2013 г.). «Трифторметилирование Сандмейера тетрафторборатов арендиазония». Angewandte Chemie International Edition. 52 (31): 7972–7975. Дои:10.1002 / anie.201304276. PMID 23832858.