WikiDer > Синтез Штаудингера
В Синтез Штаудингера, также называемое циклоприсоединением Штаудингера Кетен-Имин, является химический синтез в котором я добываю 1 реагирует с кетен 2 через не-фотохимический 2+2 циклоприсоединение произвести β-лактам 3.[1] Реакция имеет особое значение в синтезе β-лактамные антибиотики.[2] Синтез Штаудингера не следует путать с Реакция Штаудингера, реакция фосфина или фосфита, используемая для восстановления азидов до аминов.
Опубликованы обзоры механизма, стереохимии и применения реакции.[3][4][5]
История
Реакция была открыта в 1907 году немецким химиком. Герман Штаудингер.[6] Реакция не вызывала интереса до 1940-х годов, когда структура пенициллин было выяснено. В β-лактамный фрагмент первого синтетического пенициллина был сконструирован с использованием этого циклоприсоединения,[7] и он остается ценным инструментом в синтетической органической химии.
Механизм
Первый шаг - это нуклеофильный атака со стороны я добываю азот на карбонил углерод создать цвиттерионный промежуточный. Электронные донорские группы на я добываю облегчить этот шаг, в то время как электроноакцепторные группы препятствуют атаке.[8] Второй этап - это либо внутримолекулярное замыкание нуклеофильного кольца, либо колебательный электроциклический кольцо закрытия.[9] Второй этап отличается от типичного электроциклического замыкания колец, как предсказывают Правила Вудворда – Хоффмана. В фотохимических и микроволновых условиях 4π-электронная система промежуточного продукта не может подвергнуться дисротационному замыканию кольца с образованием β-лактама, возможно потому, что две двойные связи не компланарны.[10] Некоторые продукты синтеза Штаудингера отличаются от предсказанных бирюзовыйэлектронный модель.[11] Кроме того, электронная структура переходного состояния отличается от структуры других замыканий конротарного кольца.[11]Результаты вычислительных исследований модельных систем свидетельствуют о том, что в газовой фазе механизм согласован.[5]
Стереохимия
В стереохимия синтеза Штаудингера может быть трудно предсказать, потому что любой шаг может быть ставка определения.[12] Если этап замыкания кольца является определяющим, стереохимические прогнозы, основанные на селективности вращения, являются надежными.[12] Другие факторы, влияющие на стереохимию, включают начальную региохимию имина. В общем, (E) -имины образуют цис-β-лактамы, а (Z) -имины образуют транс-β-лактамы.[5] Другие заместители также влияют на стереохимию. Кетены с сильными электронодонорными заместителями в основном производят цис-β-лактамы, тогда как кетены с сильными электроноакцепторными заместителями обычно производят транс-β-лактамы. Кетеновый заместитель влияет на переходное состояние, ускоряя или замедляя продвижение к β-лактаму. Более медленная реакция позволяет изомеризовать имин, что обычно приводит к транс-продукту.[11]
Вариации
Обзоры на асимметричная индукция синтеза Штаудингера, включая использование органических и металлоорганический катализаторов.[1][5][13]
Имин можно заменить, добавив олефин произвести циклобутанон, карбонил произвести β-лактон, или карбодиимиды производить 4-имино β-лактамы.[1] Синтез Штаудингера и вариации - все циклоприсоединения кетена.
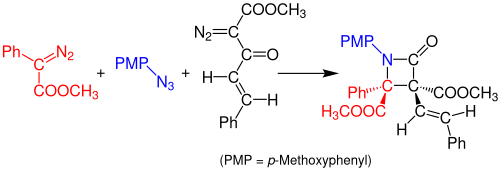
В 2014 году Дойл и его коллеги сообщили об однокомпонентном многокомпонентном синтезе по Штаудингеру β-лактамов из азидов и двух диазосоединений. Реакция происходит посредством катализируемой ацетатом родия реакции между арилдиазоацетатом (красный) и органическим азидом (синий) с образованием имина. Перегруппировка Вольфа диазоацетоацетатенона (черный) образует стабильный кетен, который реагирует с имином с образованием стабильного β-лактамного соединения. Растворителем, используемым для этой реакции, является дихлорметан (DCM) и раствор необходимо оставить в течение 3 часов при комнатной температуре. Выход реакции составляет около 99%.[14]
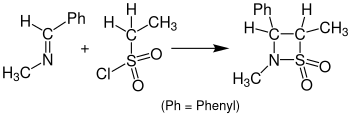
Реакция с сульфены вместо кетенов, приводящих к β-сультамы называется Циклоприсоединение сульфамида-Штаудингера. На следующем рисунке показан пример циклоприсоединения Sulfa-Staudinger. Бензилиденметиламин реагирует с этансульфонилхлоридом с образованием β-сультама. Для этой реакции была тетрагидрофуран (THF) использовали в качестве растворителя, и раствор нужно было оставить в течение 24 часов.[15]
использованная литература
- ^ а б c Райт, Стивен в Кори, под редакцией Джи Джек Ли; предисловие Э.Дж. (2010). Назовите реакции образования карбоциклических колец. Хобокен, штат Нью-Джерси: Wiley. п. 45. ISBN 9780470872208.CS1 maint: дополнительный текст: список авторов (ссылка на сайт)
- ^ Тидвелл, Т. Т. (2008). «Хьюго (Уго) Шифф, Основы Шиффа и век синтеза β-лактамов». Энгью. Chem. Int. Эд. 47 (6): 1016–1020. Дои:10.1002 / anie.200702965. PMID 18022986.
- ^ Весело.; Тидвелл, Т. Т. "Получение β-лактамов путем [2 + 2] циклоприсоединения кетенов и иминов" Тетраэдр 2008, 64, 10465-10496. ([1])
- ^ Георг, Гунда И. (1992). Органическая химия β-лактамов. Нью-Йорк: Verlag Chemie. ISBN 978-0471187998.
- ^ а б c d Cossio, F. P .; Arrieta, A .; Сьерра, М. Г. (2008). "Механизм реакции Кетене-Имин (Штаудингера) в ее столетний юбилей: все еще нерешенная проблема?". Отчеты о химических исследованиях. 41 (8): 925–936. Дои:10.1021 / ar800033j. PMID 18662024.
- ^ Х. Штаудингер (1907). "Zur Kenntniss der Ketene. Diphenylketen". Justus Liebigs Ann. Chem. 356 (1–2): 51–123. Дои:10.1002 / jlac.19073560106.
- ^ J.C. Sheehan, E.L. Буле, E.J. Кори, Г.Д. Лаубах, Дж. Дж. Райан (1950). «Полный синтез 5-фенилпенициллина: метил-5-фенил- (2-карбометоксиэтил) -пенициллинат». Варенье. Chem. Soc. 72 (8): 3828–9. Дои:10.1021 / ja01164a534.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ Райт, Стивен в Кори, под редакцией Джи Джек Ли; предисловие Э.Дж. (2010). Назовите реакции образования карбоциклических колец. Хобокен, штат Нью-Джерси: Wiley. п. 47. ISBN 9780470872208.CS1 maint: дополнительный текст: список авторов (ссылка на сайт)
- ^ Ци, Хэнчжэнь; Ли, Синьяо; Сюй, Цзяси (декабрь 2010 г.). «Стереоселективный контроль в реакциях Штаудингера с участием монозамещенных кетенов с электроноакцепторными заместителями: экспериментальное исследование и теоретическое обоснование». Органическая и биомолекулярная химия. 9 (8): 2702–2714. Дои:10.1039 / C0OB00783H. PMID 21359284. S2CID 37085450.
- ^ Лян, Юн; Цзяо, Лэй; Чжан, Шивэй; Сюй, Цзяси (2005). "Реакции Штаудингера, индуцированные микроволновым и фотооблучением циклических иминов и кетенов, образованных из α-диазокетонов. Дальнейшее исследование стереохимического процесса". Журнал органической химии. 70 (1): 334–337. Дои:10.1021 / jo048328o. PMID 15624943.
- ^ а б c Цзяо, Лэй; Лян, Юн; Сюй, Цзяси (2006). "Происхождение относительной стереоселективности образования β-лактама в реакции Штаудингера". Журнал Американского химического общества. 128 (18): 6060–6069. Дои:10.1021 / ja056711k. PMID 16669675.
- ^ а б Лян, Юн; Цзяо, Лэй; Чжан, Шивэй; Юй Чжи-Сян; Сюй, Цзяси (2009). «Новые взгляды на торкоселективность реакции Штаудингера». Журнал Американского химического общества. 131 (4): 1542–1549. Дои:10.1021 / ja808046e. PMID 19132931.
- ^ Паломо, Клаудио; Aizpurua, Jesus M .; Ганбоа, Иньяки; Oiarbide, Микель (1999). «Асимметричный синтез β-лактамов с помощью реакции циклоприсоединения Штаудингера кетен-имин». Европейский журнал органической химии. 1999 (12): 3223–3235. Дои:10.1002 / (SICI) 1099-0690 (199912) 1999: 12 <3223 :: AID-EJOC3223> 3.0.CO; 2-1.
- ^ Мандлер, Майкл Д .; Truong, Phong M .; Завалий, Петр Юрьевич .; Дойл, Майкл П. (2014). «Каталитическое превращение диазокарбонильных соединений в имины». Органические буквы. 16 (3): 740–743. Дои:10.1021 / ol403427s. PMID 24423056.
- ^ Ян, Чжаньхуэй; Чен, Нин; Сюй, Цзяси (2015). "Контролируемая заместителями аннулоселективность и стереоселективность в циклоприсоединениях сульфат-Штаудингера". Журнал органической химии. 80 (7): 3611–3620. Дои:10.1021 / acs.joc.5b00312. ISSN 0022-3263. PMID 25756543.