WikiDer > Ремоделирование сосудов у эмбриона
Эта статья поднимает множество проблем. Пожалуйста помоги Улучши это или обсудите эти вопросы на страница обсуждения. (Узнайте, как и когда удалить эти сообщения-шаблоны) (Узнайте, как и когда удалить этот шаблон сообщения)
|

Ремоделирование сосудов - процесс, который обычно начинается на 22-й день и продолжается примерно до десятой недели эмбриогенез человека, когда на 22-й день незрелый сердце начинает сокращаться, выталкивая жидкость через ранние сосудистая сеть. Этот первый проход жидкости вызывает сигнальный каскад и движение клеток на основе физического реплики включая напряжение сдвига и окружное напряжение, что необходимо для ремоделирования сосудистой сети, артериальный-венозный личность, ангиогенез, и регулирование гены через механотрансдукция. Этот эмбриональный процесс необходим для будущей стабильности зрелой сосудистой сети.[2]
Васкулогенез является первоначальным установлением компонентов кровеносный сосуд сеть, или сосудистое дерево. Это продиктовано генетическими факторами и не имеет никакой внутренней функции, кроме как установить предварительную схему сердечно-сосудистая система. Как только начинается поток жидкости, биомеханический и гемодинамический входные данные поступают в систему, созданную васкулогенезом, и может начаться активный процесс ремоделирования.
Физические подсказки, такие как давление, скорость, поток паттерны и напряжение сдвига, как известно, действуют на сосудистую сеть различными способами, включая разветвление морфогенез, увеличение сосудов в областях с высоким потоком, ангиогенез и развитие венозных клапанов. Механотрансдукция этих физических сигналов к эндотелиальный и гладкомышечные клетки в сосудистой стенке также может запускать продвижение или репрессию определенных генов, ответственных за расширение сосудов, выравнивание клеток и другие факторы, снижающие напряжение сдвига. Эта связь между генетика и среда не совсем понятно, но исследователи пытаются прояснить его, комбинируя надежные генетические методы, такие как генетическая абляция модельные организмы и ткани, с новыми технологиями, разработанными для измерения и отслеживания структуры потока, профилей скорости и колебаний давления in vivo.[2]
Обе in vivo учиться и моделирование являются необходимыми инструментами для понимания этого сложного процесса. Сосудистое ремоделирование имеет отношение к лечение раны и правильная интеграция трансплантация тканей и пожертвования органов. Содействие активному процессу ремоделирования в некоторых случаях может помочь пациентам быстрее выздороветь и сохранить функциональное использование донорских тканей. Однако помимо заживления ран хронический ремоделирование сосудов у взрослых часто симптоматический из сердечно-сосудистые заболевания. Таким образом, возросло понимание этого биомедицинский явление может помочь в развитии терапия или профилактические меры по борьбе с такими заболеваниями, как атеросклероз.
Исторический взгляд
Более 100 лет назад Тома заметил, что увеличение местного кровотока вызывает расширение сосуда. диаметр и он даже зашел так далеко, что постулировал, что кровоток может быть ответственным за рост и развитие кровеносных сосудов [3] . Впоследствии Чепмен в 1918 году обнаружил, что удаление сердца куриного эмбриона нарушает процесс ремоделирования, но первоначальный паттерн сосудов, заложенный васкулогенезом, остается неизменным. Затем, в 1926 году Мюррей предложил, чтобы диаметр сосуда был пропорциональный к величине напряжения сдвига на стенке сосуда; то есть суда активно адаптированный для моделей потока, основанных на физических сигналах окружающей среды, таких как напряжение сдвига.
Химические основы морфогенеза, "написанная в 1952 г. математик и специалист в области информатики Алан Тьюринг выступал за различные биологические модели, основанные на молекулярная диффузия из питательные вещества.[4] Однако диффузная модель сосудистого развития, казалось бы, не соответствует сложности капиллярные русла и переплетенная сеть артерий и вен.[4][5] В 2000 году Флери предположил, что вместо диффузионных молекул, несущих ответственность за морфогенез ветвления сосудистого дерева, дальнодействующий морфоген могут быть замешаны. В этой модели бегущая волна давления будет воздействовать на сосудистую сеть через напряжение сдвига, переставляя ветви в конфигурацию с наименьшей энергией, расширяя сосуды, несущие повышенный кровоток, и перестраивая сети при инициировании потока жидкости.[4][6] Известно, что механические силы могут сильно повлиять на морфология и сложность сосудистого дерева.[5][6] Однако эти силы имеют сравнительно небольшое влияние на распространение питательных веществ, и поэтому маловероятно, что получение питательных веществ и кислород играет важную роль в ремоделировании сосудов эмбриона.[5]
Сейчас это широко принято[ласковые слова][кем?] что ремоделирование сосудов у эмбриона - это процесс, отличный от васкулогенеза; однако эти два процесса неразрывно связаны. Васкулогенез происходит до ремоделирования сосудов, но является необходимым этапом в развитии сети кровеносных сосудов и имеет значение для идентификации сосудов как артериальных или венозных. Один раз сокращение сердца, ремоделирование сосудов прогрессирует за счет взаимодействия сил, возникающих в результате биомеханических сигналов и динамика жидкостей, которые переводятся механотрансдукцией в изменения при сотовый и генетические уровни.
Васкулогенез

Васкулогенез - это формирование ранней сосудистой сети, которая определяется генетическими факторами.[7] Структуры под названием острова крови форма в мезодерма слой желточный мешок к клеточная дифференциация из гемангиобласты в эндотелиальный и красные кровяные тельца.[7] Далее капилляр сплетение формируется, когда эндотелиальные клетки мигрируют наружу с островков крови и образуют случайную сеть непрерывных цепей.[7] Затем эти нити подвергаются процессу, называемому люменизацией, спонтанной перестройкой эндотелиальных клеток из твердого тяжа в полую трубку.[8]
Внутри эмбриона дорсальная аорта образует и в конечном итоге соединяет сердце с капиллярным сплетением желточного мешка.[7] Это образует замкнутую систему жестких эндотелиальных трубок. Даже на этой ранней стадии васкулогенеза, до начала кровотока, участки трубочной системы могут экспрессировать эфрины или же нейропилины, генетические маркеры артериальной или венозной идентичности соответственно.[7] Эти идентичности все еще в некоторой степени гибки, но первоначальная характеристика важна для процесса ремоделирования эмбриона.[2]
Ангиогенез также вносит вклад в сложность исходной сети; прорастающие эндотелиальные зачатки образуются экструзия-подобный процесс, который вызван выражением фактор роста эндотелия сосудов (VEGF).[8] Эти эндотелиальные зачатки растут от материнского сосуда, образуя более мелкие дочерние сосуды, достигающие новой территории.[8] Инвагинацияявление расщепления одной трубки с образованием двух ветвящихся трубок также способствует ангиогенезу.[8] Ангиогенез обычно отвечает за колонизацию отдельных систем органов кровеносными сосудами, тогда как васкулогенез закладывает начальные трубопроводы сети.[9] Известно также, что ангиогенез происходит во время ремоделирования сосудов.[9]
Артериально-венозная идентичность

Классификация ангиобласты в артериальные или венозные идентифицированные клетки является важным для формирования правильной морфологии ветвления.[2] Артериальные сегменты ранней сосудистой сети экспрессируют эфрин В2 и DLL4 тогда как венозные сегменты экспрессируют нейропилин-2 и EPHB4; Считается, что это помогает управлять потоком из артериально-венозных участков петли.[2] Тем не мение, механический сигналы, поступающие от первых сокращений сердца, по-прежнему необходимы для полного ремоделирования.[2]
Первое событие иерархического ремоделирования под действием биомеханики происходит сразу после начала сердечного ритма, когда желточная артерия формируется путем слияния нескольких более мелких капилляров. Впоследствии боковые ветви могут отсоединиться от основной артерии и снова присоединиться к венозной сети, эффективно меняя свою идентичность.[10] Это мысль[кем?] быть из-за высокого просвет давление в артериальных линиях, которое предотвращает повторное прикрепление ветвей обратно к артериальным сосудам.[10] Это также предотвращает образование шунты между двумя компонентами сети.[5] Moyon et al. показали, что эндотелиальные клетки артерий могут становиться венозными и наоборот. [11] Они привили участки перепел эндотелиальные трубки, которые ранее экспрессировали артериальные маркеры на цыпленок вен (или наоборот), демонстрируя пластичность системы. Изменение направления потока в артериях и / или венах также может иметь тот же эффект, хотя неясно, связано ли это с различиями в физических или химических свойствах венозного и артериального кровотока (т. Е. Профиля давления и напряжение кислорода).[10]
Другой пример текучести артериально-венозной идентичности - это межсомитный сосуд. На ранних этапах это судно подключено к аорта, делая его частью артериальной сети.[2] Однако ростки из сердечная вена может сливаться с межсомитным сосудом, который медленно отсоединяется от аорты и становится веной.[2] Этот процесс до конца не изучен, но может происходить из-за необходимости сбалансировать механические силы, такие как давление и перфузия.[2]
Артериально-венозная идентичность на ранних стадиях ремоделирования эмбриональных сосудов является гибкой, при этом артериальные сегменты часто рециклируются в венозные линии, а физическая структура и генетические маркеры сегментов активно ремоделируются вместе с самой сетью.[10] Это указывает на то, что система в целом демонстрирует степень пластичности, которая позволяет формировать ее с помощью преходящих паттернов потока и гемодинамических сигналов, однако генетические факторы действительно играют роль в начальной спецификации идентичности сосудов.[2]
Биомеханика
Как только сердце начинает биться, механические силы начинают действовать на раннюю сосудистую систему, которая быстро расширяется и реорганизуется, чтобы обслуживать ткани. метаболизм.[9] У эмбрионов, лишенных кровотока, эндотелиальные клетки сохраняют недифференцированную морфологию, аналогичную ангиобластам (по сравнению с уплощенными эпителиальные клетки обнаружен в зрелой сосудистой сети).[2] Как только сердце начинает биться, морфология и поведение эндотелиальных клеток меняются.[2][12] Изменяя частота сердцебиениясердце также может управлять перфузией или давлением, воздействующим на систему, чтобы вызвать прорастание новых сосудов.[2] В свою очередь, прорастание новых сосудов уравновешивается расширением других тканей эмбриона, которые компресс кровеносные сосуды по мере их роста.[5] В равновесие Эти силы играют главную роль в ремоделировании сосудов, но хотя ангиогенные механизмы, необходимые для запуска прорастания новых сосудов, были изучены, мало что известно о процессах ремоделирования, необходимых для сдерживания роста ненужных ветвей.[2]
Когда кровь перфузирует систему, она оказывает на стенки сосудов силы сдвига и давления. В то же время рост ткани за пределами сердечно-сосудистой системы отталкивает внешние стенки сосудов. Эти силы должны быть сбалансированы для получения эффективного энергетического состояния для недорогой доставки питательных веществ и кислорода ко всем тканям тела эмбриона.[2] Когда рост желточного мешка (внешней ткани) ограничен, баланс между сосудистыми силами и тканевыми силами смещается, и некоторые сосудистые ветви могут отключаться или уменьшаться во время процесса ремоделирования, поскольку они не могут прокладывать новые пути через сжатую ткань.[2] В целом жесткость и сопротивление этих тканей определяет степень, в которой они могут быть деформированный и каким образом биомеханические силы могут влиять на них.[2]
Развитие сосудистой сети самоорганизованный в каждой точке ткани из-за баланса между сжимающими силами расширения ткани и растяжением стенок сосудов по окружности.[5] Со временем это означает, что мигрирующие линии становятся прямыми, а не изогнутыми; это сродни представлению двух движущихся границ, наталкивающихся друг на друга.[5] Прямые сосуды обычно параллельно к линиям изоподавления, потому что границы действовали для уравновешивания градиенты давления.[5] Кроме того, направление судна имеет тенденцию следовать направлению нормали к самому крутому градиенту напряжения.[5]
Кроме того, биомеханические силы внутри эмбриональных сосудов имеют важные эффекты ремоделирования. Колебания давления приводят к колебаниям напряжения и деформации, которые могут «тренировать» сосуды, чтобы выдерживать нагрузку. грузы позже в развитии организма.[9] Слияние нескольких мелких сосудов может также привести к образованию крупных сосудов в тех областях сосудистого дерева, где кровяное давление и скорость потока выше.[10] Закон Мюррея представляет собой отношение между радиусом материнских сосудов и радиусом ветвей, которое справедливо для системы кровообращения. Это подчеркивает баланс между наименьшим сопротивлением потоку, обусловленным размером сосуда (поскольку сосуды большого диаметра демонстрируют низкое сопротивление потоку). падение давления) и поддержание самой крови как живой ткани, которая не может диффундировать до бесконечности.[2] Следовательно, для снабжения кровью систем органов требуется сложное разветвление, поскольку одна только диффузия не может быть ответственна за это.[согласно кому?][оригинальное исследование?]
Биомеханика также действует на соединения сосудистой сети. Было показано, что давление в просвете направляет рециркуляцию сегментов сосуда в области высокого давления,[5] и управлять отсоединением сегментов сосуда от артериальных линий и повторным прикреплением к венозным линиям для формирования сети.[7] Этот тип разрушения сосуда может даже косвенно быть ответственным за развитие некоторых систем органов и эволюция Для более крупных организмов, поскольку без отслоения и миграции большие массы ткани в эмбрионе останутся отключенными от кровоснабжения.[5] Как только сосуды отрываются от материнской артерии, они также могут подвергаться ангиогенезу, заражая ткани. дистальный к остальной части сети.[2]
Динамика жидкостей

Гидродинамика также играет важную роль в ремоделировании сосудов. Напряжение сдвига, приложенное к стенкам сосуда, пропорционально вязкость и схемы течения жидкости. Нарушенная структура потока может способствовать образованию клапанов, а повышение давления может повлиять на радиальный рост сосудов.[9] Примитивное сердце в течение первых нескольких дней сокращения лучше всего описать как Перистальтический насос, однако через три дня поток становится пульсирующим.[9] Пульсирующий поток играет важную роль в ремоделировании сосудов, поскольку структура потока может влиять на механотрансдукцию стресса на эндотелиальные клетки.[7][13]
Безразмерные отношения, такие как Число Рейнольдса и Число Уомерсли может использоваться для описания кровотока в ранней сосудистой сети.[7] Низкое число Рейнольдса, присутствующее во всех ранних сосудах, означает, что течение можно рассматривать как ползучий и ламинарный.[7] Низкое число Уомерсли означает, что в структуре потока преобладают вязкие эффекты и что пограничные слои можно считать несуществующим.[7] Это позволяет расчетам гидродинамики опираться на определенные предположения которые упрощают математика.[оригинальное исследование?]
На первых этапах ремоделирования сосудов эмбриона высокоскоростной кровоток присутствует не только в сосудах большого диаметра, но он самовосстанавливается за счет эффектов ремоделирования сосудов в течение первых двух дней кровотока.[14] Это известно[кем?] что эмбриональные сосуды реагируют на повышение давления увеличением диаметра сосуда.[9] Из-за отсутствия гладкомышечных клеток и гликокаликс, которые обеспечивают эластичную опору в сосудах взрослого человека, кровеносные сосуды развивающегося эмбриона намного более устойчивы к течению.[7] Это означает, что на увеличение потока или давления можно ответить только быстрым, полупостоянным расширением диаметра сосуда, а не более постепенным растяжением и расширением кровеносных сосудов взрослых.[7]
Переставляя Лаплас и Пуазейля Это соотношение предполагает, что радиальный рост происходит в результате растяжения по окружности, а рост по окружности происходит в результате напряжения сдвига.[9] Напряжение сдвига пропорционально скорости внутри емкости, а также перепаду давления между двумя фиксированными точками на стенке емкости.[5] Считается, что точным механизмом ремоделирования сосуда является высокая нагрузка на внутреннюю стенку сосуда, которая может вызвать рост, ведущий к равномерному сжатию и сжатию. растягивающее напряжение с обеих сторон стенки сосуда.[9] В общем, было найдено[кем?] это окружное остаточное напряжение является сжимающим и растягивающим, что указывает на то, что внутренние слои эндотелиальной трубки растут больше, чем внешние слои.[15]
Механотрансдукция и генетическая регуляция
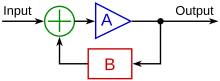
Механизм, с помощью которого различные типы потоков и другие физические сигналы по-разному влияют на ремоделирование сосудов эмбриона, называется механотрансдукцией. Турбулентный поток, что является обычным явлением в развивающейся сосудистой сети, играет роль в формировании сердечных клапанов, которые предотвращают обратный ток, связанный с турбулентностью.[16] Также было показано, что неоднородный модели потока в больших сосудах могут создавать асимметрия, возможно, путем преимущественной активации генов, таких как PITX2 на одной стороне сосуда или, возможно, вызывая окружное растяжение с одной стороны, способствуя регрессу с другой стороны.[6][17] Ламинарный поток также имеет генетические эффекты, такие как уменьшение апоптоз, подавляя распространение, выравнивая клетки в направлении потока и регулируя многие клеточные сигнальные факторы.[7] Механотрансдукция может действовать как положительно, так и отрицательно. петли обратной связи, которые могут активировать или подавлять определенные гены в ответ на физический стресс или нагрузку на сосуд.
Ячейка "считывает" схемы потока через интегрин зондирование рецепторы которые обеспечивают механическую связь между внеклеточный матрикс и актин цитоскелет. Этот механизм определяет, как клетка будет реагировать на паттерны потока и может опосредовать клеточная адгезия, что особенно актуально при прорастании новых сосудов.[2] В процессе механотрансдукции напряжение сдвига может регулировать экспрессию многих различных генов. Следующие примеры были изучены в контексте ремоделирования сосудов с помощью биомеханики:
- Эндотелиальная синтаза оксида азота (eNOS), способствует однонаправленному кровотоку в начале сердечных сокращений и усиленный по напряжению сдвига[18]
- Фактор роста тромбоцитов (PDGF), трансформирующий фактор роста бета (TGFβ) и Круппелеподобный фактор 2 (Klf-2) индуцируются напряжением сдвига и могут оказывать повышающее регулирующее действие на гены, отвечающие за эндотелиальный ответ на турбулентный поток.[7]
- Напряжение сдвига вызывает фосфорилирование рецепторов VEGF, которые отвечают за развитие сосудов, особенно за прорастание новых сосудов[2][7]
- Гипоксия может вызвать выражение фактор, индуцируемый гипоксией 1 (HIF-1) или VEGF, чтобы инициировать рост новых ростков в областях эмбриона, лишенных кислорода[2]
- PDGF-β, VEGFR-2 и коннексион 43 активируются аномальными структурами кровотока[2]
- Повышает напряжение сдвига NF-κB, что вызывает матричные металлопротеиназы вызвать расширение кровеносных сосудов[19]
Различные модели потока и их продолжительность могут вызывать очень разные ответы, основанные на генах, регулируемых сдвигающим напряжением.[7] Как генетическая регуляция, так и физические силы ответственны за процесс ремоделирования сосудов эмбриона, однако эти факторы редко изучаются в тандеме.[2][7]
В естественных условиях изучать
Основная трудность в in vivo Исследование ремоделирования эмбриональных сосудов было направлено на разделение эффектов физических сигналов от доставки питательных веществ, кислорода и других сигнальных факторов, которые могут влиять на ремоделирование сосудов.[7] Предыдущая работа включала контроль вязкости крови на ранних этапах сердечно-сосудистого кровотока, например предотвращение попадания красных кровяных телец в плазма крови, тем самым снижая вязкость и связанные с ней напряжения сдвига.[18] Крахмал также могут вводиться в кровоток для увеличения вязкости и напряжения сдвига.[18] Исследования показали, что ремоделирование сосудов у эмбриона происходит без присутствия эритроциты, которые отвечают за доставку кислорода.[18] Следовательно, ремоделирование сосудов не зависит от присутствия кислорода и фактически происходит до того, как перфузируемые ткани потребуют доставки кислорода.[7] Однако до сих пор неизвестно, могут ли другие питательные вещества или генетические факторы оказывать стимулирующее влияние на ремоделирование сосудов.[18]
Измерение профилей параболической скорости в сосудах живых эмбрионов показывает, что стенки сосудов подвергаются воздействию ламинарных и сдвиговых напряжений, которые могут иметь биоактивный эффект.[14] Напряжение сдвига на эмбриональном мышь а сосудистая сеть цыплят колеблется от 1 до 5 дин / см2.[14] Это можно измерить, разрезав участки кровеносных сосудов и наблюдая за углом отверстия, которое изгибается для облегчения остаточный стресс,[15] или измеряя гематокрит присутствует в кровеносных сосудах и вычисляет кажущуюся вязкость жидкости.[7]
Из-за трудностей, связанных с визуализацией развития живых эмбрионов и точным измерением небольших значений вязкости, давления, скорости и направления потока, разработке точной модели этого процесса уделялось повышенное внимание. Таким образом, эффективный метод изучения этих эффектов in vitro можно найти.[согласно кому?]
Моделирование
Был предложен ряд моделей для описания влияния жидкости на ремоделирование сосудов эмбриона. Один момент, который часто упускают[согласно кому?] в этих аналогиях есть тот факт, что процесс происходит внутри живой системы; тупик может оборваться и снова присоединиться к другому месту, ответвления закрываются и открываются на стыках или образуют клапаны, а сосуды чрезвычайно деформируемы, способны быстро адаптироваться к новым условиям и формировать новые пути. Теоретически формирование сосудистого дерева можно рассматривать с точки зрения теория перколяции. Сеть трубок возникает случайным образом и в конечном итоге устанавливает путь между двумя отдельными и не связанными точками. После того, как некоторое критическое количество трубок для проращивания переместится в ранее незанятую область, путь, называемый фрактал можно установить между этими двумя точками.[8] Фракталы - это биологически полезные конструкции, поскольку они полагаются на бесконечное увеличение площадь поверхности, что с биологической точки зрения означает значительное повышение эффективности транспортировки питательных веществ и отходов.[8] Фрактальный путь гибкий; если одно соединение разорвано, создается другое, чтобы восстановить путь.[8] Это полезная иллюстрация того, как формируется сосудистое дерево, хотя ее нельзя использовать в качестве модели. ограниченная диффузией агрегация модель дала смоделированный результаты, которые наиболее близки по сравнению с сосудистыми деревьями in vivo. Эта модель предполагает, что рост сосудов происходит по градиенту напряжения сдвига на стенке сосуда, что приводит к увеличению радиусов сосудов.[20] Ограниченная диффузией агрегация предполагает, что агрегат растет на слияние случайных пешеходов, которые сами идут по градиенту давления.[5] Случайная прогулка представляет собой просто вероятностную версию уравнения диффузии.[5] Таким образом, применяя эту модель к сосудистому дереву, небольшие устойчивые сосуды необходимо заменить большими проводящими сосудами, чтобы уравновесить давление во всей системе.[5] Эта модель дает структуру, которая более случайна на концах, чем на основных линиях, что связано с тем фактом, что лапласианские формулы стабильны, когда скорость отрицательна по отношению к градиенту давления.[5] В крупных линиях это всегда так, но у маленьких ростков скорость колеблется около 0, что приводит к нестабильному, случайному поведению.[5]
Другим важным компонентом процесса ремоделирования является отключение разветвленных сосудов, которые затем мигрируют в дистальные области, чтобы обеспечить однородное кровоснабжение.[5] Было обнаружено, что морфогенез ветвления следует за модель диэлектрического пробоя, в том, что только сосуды с достаточным потоком будут увеличиваться, а другие закроются.[5] В местах внутри сосуда, где две трубки отделяются от одной, одно плечо разделения, вероятно, закроется, отсоединится и переместится к венозной линии, где она снова присоединится. В результате закрытия ответвления поток увеличивается и становится менее турбулентным в основной магистрали, в то время как кровь также начинает течь в области, которых не хватает.[5] Какая ветвь закроется, зависит от скорости потока, направления и угла разветвления; как правило, угол разветвления 75 ° или более требует закрытия меньшего ответвления.[5]
Таким образом, несколько важных параметров ремоделирования сосудов можно описать с помощью комбинированных моделей агрегации, ограниченной диффузией, и диэлектрического пробоя: вероятность того, что ветвь закроется (пластичность расщепления сосуда), что сосуд снова соединится с венозной линией (пластичность роста отростка), сопротивление усадке кончиков отростков (баланс между внешним сжатием и внутренним напряжением сдвига) и отношение роста внешней ткани к расширению внутреннего сосуда. Однако эта модель не учитывает диффузию кислорода или сигнальные факторы, которые могут играть роль в ремоделировании сосудов эмбриона.[5] Эти модели последовательно воспроизводят большинство видимых аспектов сосудистой сети. in vivo в нескольких различных специализированных случаях.[5]
Приложение для изучения прогрессирования заболевания
Ремоделирование сосудов в неэмбриональных тканях считается симптомом прогрессирования заболевания. Сердечно-сосудистые заболевания остаются одной из самых распространенных причин смерти во всем мире[22] и часто ассоциируется с закупоркой или стеноз кровеносных сосудов, которые могут иметь драматические биомеханические эффекты. В острый и при хроническом ремоделировании увеличение напряжения сдвига из-за уменьшения диаметра заблокированного сосуда может вызвать расширение сосудов, тем самым восстанавливая типичные уровни напряжения сдвига.[6][23] Однако расширение также приводит к усилению кровотока через сосуд, что может привести к гиперемия, влияют на физиологические регулирующие действия ниже пораженного сосуда и оказывают повышенное давление на атеросклеротические бляшки, что может привести к их разрыву.[6] В настоящее время закупорка кровеносных сосудов лечится хирургическим вмешательством. стенты для принудительного открытия диаметров сосудов и восстановления нормального кровотока. Понимая значение повышенного напряжения сдвига для гомеостатический Регуляторы, альтернативные, менее инвазивные методы могут быть разработаны для лечения закупорки сосудов.
Рост опухоли часто приводит к реактивации роста кровеносных сосудов и ремоделированию сосудов, чтобы перфузировать новую ткань кровью и поддерживать ее разрастание.[2] Было показано, что рост опухоли является самоорганизующейся и ведет себя скорее как эмбриональные ткани, чем взрослые ткани.[24] Также считается, что рост сосудов и динамика кровотока в опухолях[кем?] к резюмировать рост сосудов у развивающихся эмбрионов.[2] В этом смысле ремоделирование сосудов эмбриона можно рассматривать как модель тех же путей, которые активируются при росте опухоли, и более глубокое понимание этих путей может привести к новым терапевтическим средствам, которые могут ингибировать образование опухоли.[оригинальное исследование?]
Напротив, ангиогенез и ремоделирование сосудов являются важным аспектом заживления ран и долговременной стабильности тканевых трансплантатов.[2] Когда кровоток нарушается, ангиогенез обеспечивает прорастание сосудов, которые мигрируют в лишенные ткани и восстанавливают перфузию. Таким образом, изучение ремоделирования сосудов может также дать важную информацию о разработке новых методов улучшения заживления ран и улучшения интеграции тканей из трансплантатов за счет снижения частоты отторжения.[согласно кому?]
Рекомендации
- ^ Уоллс, Дж. Р., Култас Л., и другие. (2008) Трехмерный анализ развития сосудов у эмбриона мыши. PLoS ONE 3 (8): e2853. Дои:10.1371 / journal.pone.0002853
- ^ а б c d е ж грамм час я j k л м п о п q р s т ты v ш Икс у z аа Джонс, E.A.V., и другие. (Декабрь 2006 г.). Что определяет структуру кровеносных сосудов? Генетическая преспецификация против гемодинамики. Физиология 21: 388 - 395. Дои:10.1152 / Physiol.00020.2006
- ^ Тома, Р. (1893). Untersuchungen über die Histogenese und Histo- Mechanik des 1186 Gefä ßsystems. Штутгарт, Германия: Фердинанд Энке
- ^ а б c Флери, В. (2000). Морфогенез ветвления в модели реакции-диффузии. Physical Review E 61: 4156 - 4160. PMID 11088210
- ^ а б c d е ж грамм час я j k л м п о п q р s т ты v ш Нгуен, Т.Х., и другие. (Июнь 2006 г.). Динамика морфогенеза ветвления: влияние кровотока и тканевого кровотока. Физический обзор E 73. Дои:10.1103 / PhysRevE.73.061907
- ^ а б c d е Коллер А. и Кейли Г. (1996). Регулирование сосудистого сопротивления, зависимое от напряжения сдвига, при здоровье и болезни: роль эндотелия. Эндотелий 4: 247 - 272. Дои:10.3109/10623329609024701
- ^ а б c d е ж грамм час я j k л м п о п q р s т Джонс, E.A.V. (Апрель 2010 г.). Механотрансдукция и гидродинамика крови в развивающихся кровеносных сосудах. Канадский журнал химической инженерии 88: 136 - 143. Дои:10.1002 / cjce.20290
- ^ а б c d е ж грамм Форгакс, Г. и Ньюман, С.А. (2005). Биологическая физика развивающегося эмбриона. Кембридж, Великобритания: Издательство Кембриджского университета. ISBN 978-0-521-78337-8
- ^ а б c d е ж грамм час я Табер, Л.А. (июнь 2001 г.). Биомеханика сердечно-сосудистого развития. Ежегодный обзор биомедицинской инженерии 3: 1–25. Дои:10.1146 / annurev.bioeng.3.1.1
- ^ а б c d е Ле Нобль, Ф. и другие. (Октябрь 2003 г.). Поток регулирует артериально-венозную дифференцировку в желточном мешке куриного эмбриона. Развитие 131: 361 - 375. Дои:10.1242 / dev.00929
- ^ Мойон, Д. и другие. (Сентябрь 2001 г.). Пластичность эндотелиальных клеток при артериально-венозной дифференцировке у птичьего эмбриона. Развитие 128: 3359 - 3370. PMID 11546752
- ^ Вакимото и другие. (2000). Целенаправленное нарушение гена обменника Na + / Ca2 + приводит к апоптозу кардиомиоцитов и нарушению сердечного ритма. Журнал биологической химии 275: 36991 - 36998. Дои:10.1074 / jbc.M004035200
- ^ Бушманн, И. и другие. (Апрель 2010 г.). Пульсирующий сдвиг и Gja5 модулируют артериальную идентичность и события ремоделирования во время артериогенеза, управляемого потоком. Развитие 137: 2187–2196. PMID 20530546
- ^ а б c Джонс, E.A.V. и другие. (2004). Измерение гемодинамических изменений во время развития млекопитающих. Американский журнал физиологии. Сердце и физиология кровообращения 287: H1561 - H1569. Дои:10.1152 / ajpheart.00081.2004
- ^ а б Чыонг, С.Дж. и Фунг, Ю.С. (1986). Об остаточном напряжении в артериях. Журнал биомеханики 108: 189 - 192. PMID 3079517
- ^ Хоув, Дж. и другие. (2003). Силы внутрисердечной жидкости являются важным эпигенетическим фактором эмбрионального кардиогенеза. Природа 421: 172 - 177. Дои:10.1038 / природа01282
- ^ Яширо, К. и другие. (2007). Гемодинамика, определяемая генетической программой, определяет асимметричное развитие дуги аорты. Природа 450: 285 - 288. Дои:10.1038 / природа06254
- ^ а б c d е Лучитти, Дж. и другие. (Июль 2007 г.). Сосудистое ремоделирование желточного мешка мыши требует гемодинамической силы. Развитие 134, 3317 - 3326. Дои:10.1242 / dev.02883
- ^ Кастье, Ю. и другие. (Март 2009 г.). Роль NF-κB в индуцированном кровотоком ремоделировании сосудов. Антиоксиданты и редокс-сигналы 11: 1641–1649. Дои:10.1089 / ars.2008.2393
- ^ Флери В. и Шварц Л. (1999). Ограниченная диффузией агрегация из-за напряжения сдвига как простая модель васкулогенеза. Фракталы 7:33 - 39. Дои:10.1142 / S0218348X99000050
- ^ Ясуока и другие. (2009). Экспрессия нейропилина-2 при раке молочной железы: корреляция с метастазами в лимфатические узлы, плохой прогноз и регуляция экспрессии CXCR4. BMC Cancer 2009 9: 220. Дои:10.1186/1471-2407-9-220
- ^ Мендис, С. и другие. (2011). Глобальный атлас профилактики и контроля сердечно-сосудистых заболеваний. Всемирная организация здравоохранения: Женева. ISBN 978-92-4-156437-3
- ^ Кастье, Ю. и другие. (Август 2005 г.). p47phox-зависимая НАДФН-оксидаза регулирует индуцированное кровотоком ремоделирование сосудов. Исследование обращения 97: 533 - 540. Дои:10.1161 / 01.RES.0000181759.63239.21
- ^ Дорманн С. и Дойч А. (2002). Моделирование самоорганизованного бессосудистого роста опухоли с помощью гибридного клеточного автомата. В биологии Silico 2: 393-406. PMID 12542422
