WikiDer > Β-Бутиролактон - Википедия
 | |
| Имена | |
|---|---|
| Название ИЮПАК 4-метилоксетан-2-он | |
| Идентификаторы | |
3D модель (JSmol) | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| ECHA InfoCard | 100.019.392 |
| Номер ЕС |
|
| КЕГГ | |
PubChem CID | |
| UNII | |
| Номер ООН | 1993 |
| |
| |
| Характеристики | |
| C4ЧАС6О2 | |
| Молярная масса | 86.090 г · моль−1 |
| Внешность | От бесцветной до светло-желтой жидкости[1] |
| Точка кипения | 71–73 ° C (160–163 ° F, 344–346 К) 39 чПа[2] |
| 268 г · л−1[1] | |
| Растворимость | Растворим в различных органических растворителях[1] |
| Опасности | |
| Пиктограммы GHS |    |
| Сигнальное слово GHS | Предупреждение |
| H226, H315, H319, H351 | |
| P201, P202, P210, P233, P240, P241, P242, P243, P264, P280, P281, P302 + 352, P303 + 361 + 353, P305 + 351 + 338, P308 + 313, P321, P332 + 313, P337 + 313, P362, P370 + 378, P403 + 235, P405, P501 | |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
β-бутиролактон это внутримолекулярный эфир карбоновой кислоты (лактон) оптически активных 3-гидроксибутановая кислота. Он образуется при химическом синтезе в виде рацемат. β-Бутиролактон подходит в качестве мономер для производства биоразлагаемых полигидроксиалканоат поли (3-гидроксибутират) (PHB). Полимеризация рацемических (RS) -β-бутиролактон обеспечивает (RS) -полигидроксимасляная кислота, которая, однако, уступает по основным свойствам (например, прочности или способности к разложению) по сравнению с (р) -поли-3-гидроксибутират, происходящий из природных источников.[3]
Производство
β-Бутиролактон получают с выходом 63% путем добавления этанал к этенон (кетен) в присутствии глинистый минерал монтмориллонит.[4]
С этой целью этенон также может производиться на месте путем дегидробромирование из ацетилбромид с основанием Hünig диизопропилэтиламином. В присутствии хирального комплекса алюминия этенон реагирует энантиоселективно к (S) -β-бутиролактон с выходом 92% с энантиомерный избыток ее более 98%.[5]
Гидрирование из дикетен на палладиевом контактном катализаторе дает β-бутиролактон с выходом 93%.[6]
Асимметричное гидрирование дикетена рутением БИНАП катализатор в оптически активный (р) -β-бутиролактон с 97% селективностью и 92% энантиомерным избытком также описан.[7]
При 50 ° C и прибл. Давление CO 60 бар, (R) -2-метилоксиран (оксид пропилена) карбонилируется до (R) -β-бутиролактона при сохранении конфигурации с выходом 95%,[8] если гомогенный катализатор карбонилирования [(salph) Al (THF)2] [Co (CO)4] по словам Джеффри Коутса[9] используется (доступный из модифицированного алюминиево-саленового комплекса [(salph) AlCl и тетракарбонилкобальтата натрия NaCo (CO)4]).
В карбонилирование 2-метилоксирана в присутствии гомогенных порфирин-карбонилкобальтатных катализаторов в тетрагидрофуран также удается ок. 14 бар монооксид углерода частичное давление и дает β-бутиролактон с выходом 97%.[10]
Из-за проблем с разделением и рециркуляцией гомогенных катализаторов карбонилирования в последнее время также были исследованы аналоги гетерогенных полимеров, которые обеспечивают столь же высокие выходы (до 96%) при давлении CO 60 бар. Однако эти катализаторы пока не выглядят многообещающими кандидатами для промышленного применения, поскольку они показывают значительно более низкую каталитическую активность в лабораторных партиях с молярным содержанием 50 мм.[11]
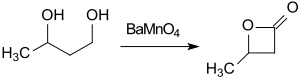
Дешевый исходный материал бутан-1,3-диол можно преобразовать с помощью окислитель манганат бария (BaMnO4) в ацетонитрил при микроволновом облучении в течение 1 ч до β-бутиролактона (выход 74%).[12]
Характеристики
β-Бутиролактон - прозрачная жидкость с запахом ацетона или мяты.[1] Он смешивается с водой и растворяется во многих органических растворителях. Согласно МАИР Согласно классификации, β-бутиролактон отнесен к группе 2B: «возможно канцерогенный».
Использовать
(р) -β-бутиролактон реагирует в толуол ок. Давление CO 14 бар и 55 ° C в присутствии комплекса салена в течение 24 часов с инверсией конфигурации с выходом 94% в оптически чистый (> 99% ee) (S) -метилянтарный ангидрид.[13]
Гомо- и сополимеры из β-бутиролактона
Коммерциализация полигидроксимасляная кислота (PHB) или гомо- и сополимерных полигидроксиалканоатов в качестве аэробно биоразлагаемых термопластов, выделенных из бактерий под торговой маркой Biopol of Imperial Chemical Industries (ICI) в 1983 году установила отправную точку для поиска синтетических альтернатив, которые должны были избежать таких недостатков ПГБ, как хрупкость и жесткость, термическое разложение при температурах чуть выше температуры плавления (175-180 ° C) и, в частности, неконкурентоспособность.[14] из-за дорогостоящей ферментации, выделения и очистки.
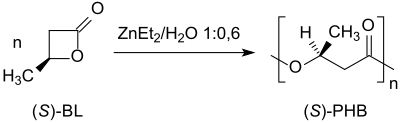
В полимеризация с раскрытием кольца из (S) -β-бутиролактон с диэтилцинк ZnEt2/ water производит поли- (S) -3-гидроксибутират с ее> 97% при сохранении конфигурации у хирального атома углерода:[15]
С соединениями олова (distannoxanes) в качестве катализаторов полимеризация (р) -β-бутиролактон также производит высокомолекулярный (Mп > 100000) синтетических (R) -полигидроксибутиратов с удерживанием, которые напоминают природные полигидроксиалканоаты.[16]
Анионная полимеризация оптически активного β-бутиролактона приводит к кристаллическим, изотактическим полигидроксибутиратам при инверсии, низкий уровень которых полидисперсность Mш/ Мп ≈ 1,2 указывают на живая полимеризация.[17][18]
Также сильные базы, такие как диазабициклоундецен (DBU), 1,5,7-триазабицикло (4.4.0) dec-5-en (TBD) и фосфазен БЭМП способны катализировать полимеризацию с раскрытием кольца β-бутиролактона в веществе при 60 ° C, достигая низкомолекулярных ПОБ (Mп <21,000) с узким молекулярно-массовым распределением.[19]
Катионная полимеризация с раскрытием кольца β-бутиролактона с сильными кислотами, такими как трифторметансульфоновая кислота, приводит к низкомолекулярным ПОБ (Mп <8,200) с живыми концами гидроксильной цепи, к которым, например, капролактон блоки может быть сополимеризован.[20]
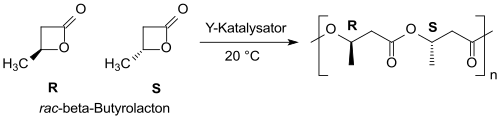
С иттрийкатализаторы на основе рацемический β-бутиролактон может быть преобразован (в основном) в синдиотактический ПОБ с узким молекулярно-массовым распределением.[21][22]
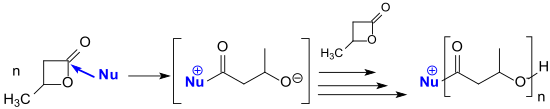
N-гетероциклические карбены (NHC) имидазол-2-илиденового типа являются сильными нуклеофилами и также подходят в качестве инициаторов полимеризации с раскрытием цикла лактонов, таких как β-бутиролактон.[23]
Синтетические варианты ПОБ, которые были разработаны как гомополимеры β-бутиролактона или сополимеров с другими лактонами, до сих пор не смогли компенсировать недостатки биогенного материала, в частности, неблагоприятные механические и термические свойства и высокую цену. Вместо этого были введены новые проблемы с токсичными тяжелыми металлами в катализаторах (например, оловом, кобальтом или хромом) и компонентами атактического полимера (жидкими и трудно разделяемыми) с нежелательными свойствами материала. Даже более чем через 30 лет после выхода на рынок экономический успех биополимер Биопол® и его (био) синтетические аналоги по-прежнему скромны, и, несмотря на амбициозные цели в отношении производственных мощностей (фактические мировые производственные мощности полигидроксиалканоатов в 2018 г .: около 30 000 тонн[24]) продажи пока сильно отстают от оптимистичных прогнозов производителей.
Рекомендации
- ^ а б c d Вход из β-бутиролактон из TCI Europe, получено 20 декабря 2018 г.
- ^ Сигма-Олдрич Ко., β-бутиролактон.
- ^ Х. Абэ; И. Мацубара; Y. Doi; Ю. Хори; А. Ямагути (1994). «Физические свойства и ферментативная разлагаемость стереоизомеров поли (3-гидроксибутирата) с различными стереорегулярностями». Макромолекулы. 27 (21). С. 6018–6025. Дои:10.1021 / ma00099a013.
- ^ США 2580714, Ф. Янг, Дж. Фитцпатрик, «Производство лактонов бета-гидроксикарбоновых кислот из кетена и альдегида с глинистым катализатором», выпущенный 1952-1-1, переданный Union Carbide and Carbon Corp.
- ^ С.Г. Нельсон; W.S. Чунг; А.Дж. Кассик; М.А.Хильфикер (2002). «A de novo энантиоселективный полный синтез (-) - лаулималида». J. Amer. Chem. Soc. 124 (46). С. 13654–13655. Дои:10.1021 / ja028019k. PMID 12431077.
- ^ США 2763664, J. Sixt, «Процесс производства β-бутиролактона из дикетена», выпущенный 1956-9-18, переуступлен Wacker-Chemie GmbH.
- ^ Т. Охта; Т. Мияке; Х. Такая (1992). «Эффективный синтез оптически активного 4-метилоксетан-2-она: асимметричное гидрирование дикетена, катализируемое комплексами бинап – рутений (II) [бинап = 2,2′-бис (дифенилфосфино) -1,1′-бинафтил]». J. Chem. Soc., Chem. Commun. 0 (23). С. 1725–1726. Дои:10.1039 / C39920001725.
- ^ Y.D.Y.L. Гетцлер; В. Махадеван; Э. Лобковский; G.W. Коутс (2002). «Синтез β-лактонов: высокоактивный и селективный катализатор карбонилирования эпоксидов». J. Amer. Chem. Soc. 124 (7). С. 1174–1175. Дои:10.1021 / ja017434u. PMID 11841278.
- ^ «Катализаторы карбонилирования». Aldrich ChemFiles 2007, 7.5, 3. Сигма Олдрич. 2007 г.. Получено 2018-12-20.
- ^ США 2012123137, С.Д. Аллен, Р.Р. Валенте, Х. Ли, А.Э. Чериан, Д.Л. Баннинг, Н.А.Клинтон, О.С. Fruchey, B.D. Домбек, «Процесс производства бета-лактона», выпущенный 2012-5-17, передан Novomer, Inc.
- ^ Дж. Цзян; С. Юн (2018). "Металлизированный пористый порфириновый полимер с [Co (CO)4]− анион как эффективный гетерогенный катализатор карбонилирования с расширением цикла ». Научные отчеты. 8 (13243). С. 1–6. Дои:10.1038 / s41598-018-31475-6. ЧВК 6125460. PMID 30185794.
- ^ M.C. Бэгли; З. Линь; Д.Дж. Филлипс; А.Э. Грэм (2009). «Манганат бария в реакциях окисления с помощью микроволнового излучения: синтез лактонов реакциями окислительной циклизации». Tetrahedron Lett. 50 (49). С. 6823–6825. Дои:10.1016 / j.tetlet.2009.09.117.
- ^ Y.D.Y.L. Гетцлер; В. Кунднани; Э. Лобковский; G.W. Коутс (2004). «Каталитическое карбонилирование β-лактонов до янтарных ангидридов». J. Amer. Chem. Soc. 126 (22). С. 6842–6843. Дои:10.1021 / ja048946m. PMID 15174834.
- ^ «ICI снижает стоимость, увеличивает возможности Biopol». ICIS. 1991-09-22. Получено 2018-12-20.
- ^ Ю. Чжан; Р.А. Валовой; Р. В. Ленц (1990). «Стереохимия полимеризации с раскрытием цикла (S) -β-бутиролактон ». Макромолекулы. 23 (13). С. 3206–3212. Дои:10.1021 / ma00215a002.
- ^ Ю. Хори; М. Сузуки; А. Ямагути; Т. Нишишита (1993). «Полимеризация с раскрытием цикла оптически активного β-бутиролактона с использованием дистанноксановых катализаторов: Синтез высокомолекулярного поли (3-гидроксибутирата)». Макромолекулы. 26 (20). С. 5533–5534. Дои:10.1021 / ma00072a037.
- ^ З. Едлински; П. Курчак (1998). «Первый легкий синтез биомиметического поли (р) -3-гидроксибутират региоселективной анионной полимеризацией (S) -β-бутиролактон ». Макромолекулы. 31 (19). С. 6718–6720. Дои:10.1021 / ma980663p.
- ^ Р. Курчак; М. Смига; З. Едлински (2002). «Полимеризация β-бутиролактона, инициированная карбоксилатами тетрабутиламмония: новый подход к биомиметическому синтезу полиэфиров». J. Polym. Sci., Часть A: Polym. Chem. 40 (13). С. 2184–2189. Дои:10.1002 / pola.10285.
- ^ К.Г. Джаффредо; Ж.-Ф. Карпентье; С.М. Гийом (2012). «Контролируемая ROP β-бутиролактона просто опосредована амидином, гуанидином и фосфазеновыми органокатализаторами». Макромол. Быстрое общение. 33 (22). С. 1938–1944. Дои:10.1002 / marc.201200410. PMID 22887774.
- ^ А. Коффен; Б. Мартин-Вака; Д. Бурису; К. Наварро (2014). «Селективное раскрытие O-ацильного кольца β-бутиролактона, катализируемое трифторметансульфоновой кислотой: применение для получения четко определенных блок-сополимеров». Polym. Chem. 5 (1). С. 161–168. Дои:10.1039 / C3PY00935A.
- ^ А. Амгун; СМ. Томас; С. Иллинка; Т. Ройснель; Ж.-Ф. Карпентье (2006). «Высокоактивные, продуктивные и синдиоспецифические инициаторы иттрия для полимеризации рацемического β-бутиролактона». Энгью. Chem. Int. Эд. 45 (17). С. 2782–2784. Дои:10.1002 / anie.200600058. PMID 16548028.
- ^ Ж.-Ф. Карпентье (2010). «Дискретные металлические катализаторы для стереоселективной полимеризации с раскрытием цикла хиральных рацемических β-лактонов». Макромол. Rapid Commun. 31 (19). С. 1696–1705. Дои:10.1002 / marc.201000114. PMID 21567583.
- ^ W.N. Ottou; Х. Сардон; Д. Месерри; Ж. Виньоль; Д. Татон (2016). «Обновление и проблемы в реакциях органо-опосредованной полимеризации» (PDF). Прогресс в науке о полимерах. 56. С. 64–115. Дои:10.1016 / j.progpolymsci.2015.12.001.
- ^ Биопластический рынок Датен, abgerufen am 20. Декабрь 2018.