WikiDer > Ацетоацетатдекарбоксилаза - Википедия
| Ацетоацетат декарбоксилаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
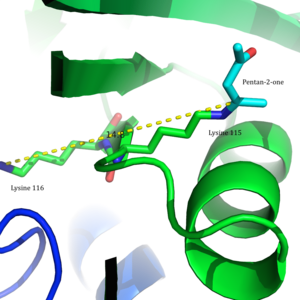
 Ацетоацетат декарбоксилаза додекамер структура с привязкой 2-пентанон привязан к своим активным сайтам. | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 4.1.1.4 | ||||||||
| Количество CAS | 9025-03-0 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
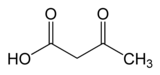
Ацетоацетат декарбоксилаза (AAD или же АЦП) является ферментом, участвующим как в кетоновое тело путь продуцирования у людей и других млекопитающих, и сольвентогенез в бактериях. Ацетоацетатдекарбоксилаза играет ключевую роль в производстве растворителей, катализируя декарбоксилирование ацетоацетата с получением ацетон и углекислый газ.[1]
Этот фермент вызвал особый интерес, потому что это классический пример того, как pKa значения ионизируемых групп в ферменте активный сайт могут быть значительно возмущены. В частности, значение pKa лизин 115 в активном центре необычно низка, что позволяет образовывать База Шиффа промежуточный и катализатор.[2]
| ацетоуксусная кислота | Ацетоацетат декарбоксилаза | ацетон | |
 |  | ||
| CO2 | |||
 | |||
История
Ацетоацетатдекарбоксилаза - это фермент, имеющий большое историческое значение, особенно в Первая Мировая Война и в установлении состояния Израиль.[3] Во время войны Союзники нужен чистый ацетон в качестве растворителя для нитроцеллюлоза, легковоспламеняющееся соединение, которое является основным компонентом пороха.[4] В 1916 году биохимик и будущий первый президент Израиля. Хаим Вейцманн был первым, кто изолировал Clostridium acetobutylicum, а Грамположительный, анаэробные бактерии, в которых обнаружена ацетоацетатдекарбоксилаза. Вейцман смог использовать способность организма выделять ацетон из крахмала для массового производства взрывчатых веществ во время войны.[3] Это побудило правительства США и Великобритании внедрить процесс, разработанный Хаимом Вейцманном, на нескольких крупных заводах в Англии, Франции, Канаде и США. Благодаря научному вкладу Вейцмана в Первую мировую войну он сблизился с влиятельными британскими лидерами, ознакомив их с его сионистскими убеждениями.[5] Одним из них был Артур Бальфур, человек, в честь которого Декларация Бальфура- был назван первый документ, провозглашающий поддержку Великобритании в создании еврейской родины.
Производство ацетона ацетоацетат декарбоксилазосодержащими или клостридиальными бактериями использовалось в крупномасштабных промышленных синтезах в первой половине двадцатого века. В 1960-х годах промышленность заменила этот процесс менее дорогим и более эффективным химическим синтезом ацетона из нефти и нефтепродуктов.[6] Однако растет интерес к производству ацетона, который является более экологически чистым, что вызывает возрождение использования бактерий, содержащих ацетоацетатдекарбоксилазу.[7] Точно так же становится популярной ферментация изопропанола и бутанола с использованием клостридиальных видов.
Структура
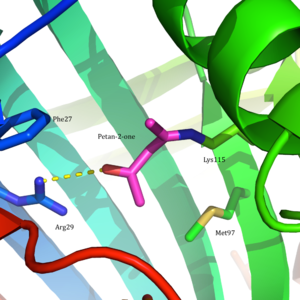
Ацетоацетатдекарбоксилаза представляет собой 365 кДа комплекс с гомододекамерной структурой.[8] Общая структура состоит из антипараллельных β-листы и центральный семитвенный конусообразный β-ствол. Ядро этого β-цилиндра окружает активный центр каждого протомера фермента. Активный сайт, состоящий из таких остатков, как Phe27, Мет97, и Tyr113, в основном гидрофобный. Однако активный центр действительно содержит два заряженных остатка: Arg29 и Glu76.
Считается, что Arg29 играет роль в связывании субстрата, в то время как Glu76, как полагают, играет роль в ориентации активного сайта для катализа. Общая гидрофобная среда активного центра играет решающую роль в поддержании нейтральной амин форма Lys115, ключевого остатка, участвующего в образовании База Шиффа средний. Считается, что другой важный остаток лизина, Lys116, играет важную роль в позиционировании Lys115 в активном сайте. Через водородные связи с Ser16 и Met210, Lys116 позиционирует Lys115 в гидрофобном кармане активного сайта, что способствует нейтральной форме амина.
Механизм реакции

Ацетоацетатдекарбоксилаза из Clostridium acetobutylicum катализирует декарбоксилирование ацетоацетата с образованием ацетона и диоксида углерода (рис. 1). Механизм реакции протекает через образование База Шиффа промежуточный, который ковалентно присоединен к лизин 115 на активном сайте. Первая линия поддержки этого механизма исходила от радиоактивная маркировка эксперимент, в котором исследователи назвали карбонил группа ацетоацетата с 18O и заметил, что кислородный обмен с водой, используемой в качестве растворителя, является необходимой частью стадии декарбоксилирования.[9] Эти результаты подтвердили, что механизм действует через базу Шиффа, промежуточную между кетокислота и аминокислотный остаток фермента.
Дальнейшие исследования привели к изоляции активного сайта. пептид последовательность и идентификация активного центра лизина, Lys115, который участвует в образовании промежуточного соединения основания Шиффа.[2][10] Кроме того, более поздние эксперименты привели к выводу, что максимальная активность фермента наблюдается при pH 5.95, предполагая, что pKа ε-аммониевой группы Lys115 значительно нарушена в активном центре.[2] Если pKа не были сдвинуты вниз, остаток лизина останется протонированным в виде катиона аммония, что сделает его инертным для нуклеофильного добавления, необходимого для образования основания Шиффа.

Основываясь на этом открытии, Westheimer et al. непосредственно измерил pKа Lys115 в активном сайте, используя 5-нитросалициловый альдегид (5-АНБ). Реакция 5-NSA с ацетоацетатдекарбоксилазой и последующее восстановление образовавшегося основания Шиффа с помощью борогидрид натрия привело к включению репортерной молекулы 2-гидрокси-5-нитробензиламино в активный центр (рис. 2). Титрование фермента с этой присоединенной репортерной группой показало, что pKа Lys115 снижается до 5,9 в активном сайте.[12] Эти результаты послужили основанием для предположения, что возмущение в pKа Lys115 было связано с его близостью к положительно заряженной ε-аммониевой группе Lys116 в активном центре.[2] Положительный заряд поблизости может вызвать неблагоприятное электростатическое отталкивание, которое ослабляет связь N-H в Lys115. Предложение Westheimer et al. Было дополнительно поддержано сайт-ориентированным мутагенез исследования. Когда Lys116 был мутирован в цистеин или же аспарагин, pKа Lys115 было значительно повышено до более чем 9,2, что указывает на то, что положительно заряженный Lys116 играет критическую роль в определении pKа Lys115.[2] Хотя Кристальная структура еще не было решено предоставить структурные доказательства, это предложение было широко принято и цитировалось в качестве учебного примера того, как активный сайт может быть точно организован для возмущения pKа и влияют на реактивность.[8]
В 2009 г. Кристальная структура ацетоацетат декарбоксилазы из Clostridium acetobutylicum была решена, что позволило оценить предложение Westheimer et al. с новой точки зрения. Из кристаллической структуры исследователи обнаружили, что Lys 115 и Lys 116 ориентированы в противоположных направлениях и разделены на 14,8 Å (Рисунок 3).[8] Это расстояние делает маловероятным, что положительный заряд Lys116 может влиять на pKа Lys115. Вместо этого за счет водородных связей с Ser16 и Met210 Lys116, вероятно, удерживает Lys115 в положении в гидрофобный карман активного сайта. Такое расположение нарушает стабильность протонированного катиона аммония Lys115, предполагая, что возмущение pK Lys115а происходит через 'опустошение эффект'.
Инактивация и ингибирование
Ацетоацетатдекарбоксилаза ингибируется рядом соединений. Уксусный ангидрид выполняет электрофильную атаку на критический каталитический остаток, Lys115, ацетоацетатдекарбоксилазы, чтобы инактивировать фермент.[13] Скорость инактивации оценивалась с помощью гидролиз синтетического субстрата 2,4-динитрофенилпропионата в динитрофенол с помощью ацетоацетатдекарбоксилазы. В присутствии уксусного ангидрида фермент инактивируется, не способный катализировать реакцию гидролиза 2,4-динитрофенилпропионата до динитрофенола.[14]
Ацетонилсульфонат действует как конкурентный ингибитор (Kя= 8,0 мМ), так как он имитирует характеристики природного субстрата, ацетоацетата (KM= 8,0 мМ).[15] Моноанионная версия ацетонилфосфоната также является хорошим ингибитором (Kя= 0,8 мМ), более эффективен, чем моноэфир ацетонилфосфоната или дианион.[16] Эти данные показывают, что активный сайт очень дискриминационный и стерически ограниченный.
Цианистый водород кажется неконкурентоспособный ингибитор, соединяясь с соединениями основания Шиффа, образованными в активном центре.[15] Добавление карбонильных соединений к ферменту в присутствии цианистого водорода увеличивает способность цианида водорода ингибировать ацетоацетатдекарбоксилазу, предполагая, что карбонильные соединения легко образуют основания Шиффа в активном центре. Цианистый водород наиболее эффективен как ингибитор при pH 6, оптимальном pH для фермента, что позволяет предположить, что ограничивающий шаг катализа является образование промежуточного соединения основания Шиффа.
Бета-дикетоны По-видимому, хорошо, но медленно, ингибирует ацетоацетатдекарбоксилазу. Ацетоацетатдекарбоксилаза имеет KM для ацетоацетата 7 × 10−3 M, тогда как фермент имеет Kя за бензоилацетон 1,9 × 10−6 М.[15] Енамин, скорее всего, образуется при взаимодействии бета-дикетонов со свободным ферментом.
Реакция ацетоацетатдекарбоксилазы с п-хлормеркурифенилсульфонат (CMS) приводит к снижению каталитической активности при двух эквивалентах CMS на субъединицу фермента.[15] CMS взаимодействует с двумя сульфгидрильными группами, расположенными на каждой субъединице фермента. Дальнейшая инактивация происходит при добавлении третьего эквивалента CMS на субъединицу. Добавление свободного цистеина к ингибированному ферменту способно обратить вспять ингибирование ацетоацетатдекарбоксилазы CMS.
Активность бактерий
Ацетоацетатдекарбоксилаза была обнаружена и изучена у следующих бактерий в дополнение к Clostridium acetobutylicum:
- Bacillus polymyxa
- Chromobacterium violaceum
- Clostridium beijerinckii
- Clostridium cellulolyticum
- Pseudomonas putida
Активность у людей и млекопитающих
Хотя этот фермент не был очищен из тканей человека, было показано, что его активность присутствует в сыворотке крови человека.[17][18]
У человека и других млекопитающих превращение ацетоацетата в ацетон и диоксид углерода под действием ацетоацетатдекарбоксилазы является последним необратимым этапом пути кетонового тела, который снабжает организм вторичным источником энергии.[19] В печени ацетил-ко-А, образованный из жиров и липидов, трансформируется в три кетоновых тела: ацетон, ацетоацетат, и D-β-гидроксибутират. Ацетоацетат и D-β-гидроксибутират экспортируются в непеченочные ткани, где они превращаются обратно в ацетил-коА и используются в качестве топлива. С другой стороны, ацетон и углекислый газ выдыхаются и не могут накапливаться в нормальных условиях.
Ацетоацетат и D-β-гидроксибутират свободно взаимопревращаются под действием D-β-гидроксибутиратдегидрогеназы.[19] Впоследствии одной функцией ацетоацетатдекарбоксилазы может быть регулирование концентраций других, двух 4-углеродных кетоновых тел.
Клиническое значение
Производство кетонов в организме значительно увеличивается, когда скорость метаболизма глюкозы недостаточна для удовлетворения энергетических потребностей организма. К таким состояниям относятся жирные кетогенные диеты, диабетический кетоацидоз, или жестокий голод.[20]
При повышенных уровнях ацетоацетата и D-β-гидроксибутирата ацетоацетатдекарбоксилаза производит значительно больше ацетона. Ацетон токсичен и в этих условиях может накапливаться в организме. Повышенный уровень ацетона в дыхании человека может использоваться для диагностики диабета.[20]
Рекомендации
- ^ Петерсон DJ, Беннетт GN (1990). «Очистка ацетоацетатдекарбоксилазы из Clostridium acetobutylicum. Клонирование АТСС ацетоацетатдекарбоксилазы в Escherichia coli». Прикладная и экологическая микробиология. 56 (11): 3491–3498.
- ^ а б c d е ж Хайбарджер, Луизиана; JA Gerlt; Г.Л. Кеньон (9 января 1996 г.). «Механизм реакции, катализируемой ацетоацетатдекарбоксилазой. Важность лизина 116 в определении pKa лизина 115 активного центра». Биохимия. 35 (1): 41–46. Дои:10.1021 / bi9518306. PMID 8555196.
- ^ а б Бормон, С (2009). «Новая структура пересматривает историю». Структурная биология. 87 (21): 9.
- ^ "Британника Онлайн".
- ^ «Еврейская виртуальная библиотека».
- ^ «Моделирование ферментации ABE» (PDF). Архивировано из оригинал (PDF) на 2014-08-08. Получено 2014-05-27.
- ^ Коллас, Флоран; Воутер Куит; Бенджамин Клемент; Реми Маршал; Ана М. Лопес-Контрерас; Фредерик Моно (21 августа 2012 г.). «Одновременное производство изопропона, бутанола, этанола и 2,3-бутандиола сконструированными штаммами Clostridium acetobutylicum ATCC 824». AMB Express. 2 (1): 45. Дои:10.1186/2191-0855-2-45. ЧВК 3583297. PMID 22909015.
- ^ а б c d е Хо М.К., Менетре Дж. Ф., Цурута Х., Аллен К. Н. (21 мая 2009 г.). «Происхождение электростатических возмущений в ацетоацетатдекарбоксилазе». Природа. 459 (7245): 393–397. Дои:10.1038 / природа07938. PMID 19458715.
- ^ Гамильтон Г.А., Вестхаймер Ф.Х. (1959). «О механизме ферментативного декарбоксилирования ацетоацетата». Варенье. Chem. Soc. 81 (23): 6332–6333. Дои:10.1021 / ja01532a058.
- ^ Уоррен, Стюарт; Берт Зернер, Ф.Х. Вестхаймер (март 1966 г.). «Ацетоацетат декарбоксилаза. Идентификация лизина в активном сайте». Биохимия. 5 (3): 817–823. Дои:10.1021 / bi00867a002. PMID 5911292.
- ^ «История ацетоацетат декарбоксилазы». JinKai.org. Архивировано из оригинал 3 марта 2016 г.. Получено 26 мая 2014.
- ^ Kokesh, Fritz C .; Ф. Х. Вестхаймер (29 декабря 1971 г.). «Репортерная группа в активном центре ацетоацетатдекарбоксилазы. Константа ионизации аминогруппы». Журнал Американского химического общества. 93 (26): 7270–7274. Дои:10.1021 / ja00755a025.
- ^ О'Лири, M.H .; Ф. Х. Вестхаймер (1968). «Ацетоацетатдекарбоксилаза. Селективное ацетилирование фермента». Биохимия. 7 (3): 913–919. Дои:10.1021 / bi00843a005.
- ^ Schmidt, Donald E .; Ф. Х. Вестхаймер (1971). «pK лизиновой аминогруппы в активном сайте ацетоацетатдекарбоксилазы». Биохимия. 10 (7): 1249–1253. Дои:10.1021 / bi00783a023.
- ^ а б c d Автор, Anne P .; И. Фридович (1970). «Взаимодействие ацетоацетат декарбоксилазы с карбонильными соединениями, цианистым водородом и органическим веществом ртути». J. Biol. Chem. 245 (20): 5214–5222.
- ^ Клюгер, Рональд; Курт Накаока (1974). «Ингибирование ацетоацетатдекарбоксилазы кетофосфонатами. Структурные и динамические пробы активного центра». Биохимия. 13 (5): 910–914. Дои:10.1021 / bi00702a013. PMID 4360355.
- ^ ван Стекеленбург Г.Дж., Коореваар Г. (июнь 1972 г.). «Доказательства существования ацетоацетатдекарбоксилазы млекопитающих: с особым акцентом на сыворотку крови человека». Clin. Чим. Acta. 39 (1): 191–9. Дои:10.1016/0009-8981(72)90316-6. HDL:1874/16479. PMID 4624981.
- ^ Коореваар Г., Ван Стекеленбург Г. Дж. (Сентябрь 1976 г.). «Активность ацетоацетатдекарбоксилазы млекопитающих. Ее распределение в субфракциях человеческого альбумина и встречаемость в различных тканях крысы». Clin. Чим. Acta. 71 (2): 173–83. Дои:10.1016/0009-8981(76)90528-3. PMID 963888.
- ^ а б «Метаболизм человека» (PDF).
- ^ а б Галассетти П.Р., Новак Б., Немет Д., Роуз-Готтрон С., Купер Д.М., Мейнарди С., Ньюкомб Р., Залдивар Ф., Блейк Д.Р. (2005). «Дыхательный этанол и ацетон как индикаторы уровня глюкозы в сыворотке: первоначальный отчет». Diabetes Technol. Ther. 7 (1): 115–23. Дои:10.1089 / диам.2005.7.115. PMID 15738709.
внешняя ссылка
- ацетоацетат + декарбоксилаза в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- EC 4.1.1.4
- Бренда: введение ацетоацетатдекарбоксилазы
- KEGG: вход ацетоацетатдекарбоксилазы
- InterPro: IPR010451 Ацетоацетатдекарбоксилаза