WikiDer > Бис (трифенилфосфин) хлорид палладия
 | |
 | |
 | |
| Идентификаторы | |
|---|---|
3D модель (JSmol) |
|
| ChemSpider | |
| ECHA InfoCard | 100.034.299 |
PubChem CID | |
| |
| |
| Характеристики | |
| C36ЧАС30Cl2п2Pd | |
| Молярная масса | 701.90 г · моль−1 |
| Внешность | желтый порошок |
| Температура плавления | 260 ° C (разлагается около 300 ° C) |
| Нерастворим в воде, ацетоне, эфире, четыреххлористом углероде и н-гептане // Растворим в CHCl.3 и CH2Cl2, Хлороформ (слегка), метанол (слегка нагретый) | |
| Опасности | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | 181,7 ° С |
| Родственные соединения | |
Родственные соединения | Бис (трифенилфосфин) хлорид платины |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
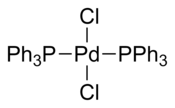
Бис (трифенилфосфин) хлорид палладия это координационное соединение из палладий содержащий два трифенилфосфин и два хлористый лиганды. Это твердое вещество желтого цвета, растворимое в некоторых органических растворителях. Он используется для реакции сочетания, катализируемые палладием, например в Реакция Соногашира – Хагихара. Комплекс квадратный плоский. Известно много аналогичных комплексов с различными фосфиновыми лигандами.
Подготовка и реакции
Это соединение может быть получено обработкой хлорид палладия (II) с трифенилфосфин:[1][2]
- PdCl2 + 2 PPh3 → PdCl2(PPh3)2
При сокращении с гидразин в присутствии избытка трифенилфосфина комплекс является предшественником тетракис (трифенилфосфин) палладий, Pd (PPh3)4:[3]
- 2 PdCl2(PPh3)2 + 4 человека в час3 + 5 N2ЧАС4 → 2 Pd (PPh3)4 + N2 + 4 N2ЧАС5+Cl−
Структура
Несколько кристаллические структуры содержащий PdCl2(PPh3)2 не поступало. Во всех структурах PdCl2(PPh3)2 принимает квадратная плоская координационная геометрия и транс изомерная форма.[4][5][6][7]
Приложения
Комплекс используется в качестве предварительного катализатора для различных реакций сочетания.[8]
В Сузуки реакция когда-то была ограничена высоким содержанием катализатора и ограниченной доступностью бороновых кислот. Были также найдены замены для галогенидов, увеличивающие количество партнеров для связывания для галогенида или псевдогалогенида. Используя бис (трифенилфосфин) хлорид палладия в качестве катализатора, трифлаты и бороновые кислоты были соединены в весе 80 кг с хорошим выходом.[9] Тот же катализатор эффективен для Муфта Соногашира.[10]
Смотрите также
Рекомендации
- ^ Норио Мияура и Акира Судзуки (1990). «Катализируемая палладием реакция 1-алкенилборонатов с галогенидами винила: (1Z, 3E) -1-фенил-1,3-октадиен». Органический синтез. 68: 130. Дои:10.15227 / orgsyn.068.0130.CS1 maint: использует параметр авторов (связь)
- ^ Хироши Итатани, Дж. К. Байлар (1967). "Гомогенный катализ в реакциях олефиновых веществ. V. Гидрирование метилового эфира соевого масла с трифенилфосфином и палладиевыми катализаторами трифениларсина". Журнал Американского общества химиков-нефтяников. 44: 147. Дои:10.1007 / BF02558176.CS1 maint: использует параметр авторов (связь)
- ^ Д. Р. Коулсон (1972). Тетракис (трифенилфосфин) палладий (0). Неорг. Synth. Неорганические синтезы. 13. С. 121–124. Дои:10.1002 / 9780470132449.ch23. ISBN 9780470132449.
- ^ Дж. Фергюсон, Р. МакКриндл, А. Дж. Макалис и М. Парвез (1982). "транс-Дихлорбис (трифенилфосфин) палладий (II) ». Acta Crystallogr. B38 (10): 2679–2681. Дои:10.1107 / S0567740882009583.CS1 maint: использует параметр авторов (связь)
- ^ Г. Стейл (2006). "транс-Дихлорбис (трифенилфосфин) палладий (II) дихлорметановый сольват ». Acta Crystallogr. E. 62: m1324 – m1325. Дои:10.1107 / S1600536806017521.
- ^ Дж. Понс, Дж. Гарсия-Антон, X. Соланс, М. Фон-Бардиа, Дж. Рос (2008). "транс-Дихлоридобис (трифенилфосфин) палладий (II) ». Acta Crystallogr. E. 64: m621. Дои:10.1107 / S1600536808008337.CS1 maint: использует параметр авторов (связь)
- ^ А. Нагипур, А. Горбани-Чогамарани, Х. Бабаи, М. Хашеми, Б. Ноташ (2017). "Кристаллическая структура нового полиморфа транс-дихлорбис (трифенилфосфин) палладий (II) и его применение в качестве нового, эффективного и извлекаемого катализатора для аминирования арилгалогенидов и реакций кросс-сочетания Стилла ». J. Organomet. Chem. 841: 31–38. Дои:10.1016 / j.jorganchem.2016.10.002.CS1 maint: использует параметр авторов (связь)
- ^ Рене Северин, Джессика Реймер, Свен Дой (2010). "Процедура в одном горшке для синтеза несимметричных диарилалкинов". J. Org. Chem. 75 (10): 3518–352. Дои:10.1021 / jo100460v. PMID 20420397.CS1 maint: использует параметр авторов (связь)
- ^ Jacks, T. E .; Belmont, Daniel T .; Бриггс, Кристофер А .; Хорн, Николь М .; Кантер, Джеральд Д.; Каррик, Грег Л .; Крикке, Джеймс Дж .; Маккейб, Ричард Дж .; Мустакис; Наннинга, Томас Н. (2004). «Разработка масштабируемого процесса для CI-1034, антагониста эндотелина». Исследования и разработки в области органических процессов. 8 (2): 201–212. Дои:10.1021 / op034104g.CS1 maint: использует параметр авторов (связь)
- ^ Chinchilla, R .; Нахера, К. (2007). «Реакция Соногашира: быстро развивающаяся методология в синтетической органической химии». Chem. Rev. 107 (3): 874–922. Дои:10.1021 / cr050992x. PMID 17305399.CS1 maint: использует параметр авторов (связь)

