WikiDer > Катепсин E
| Катепсин E | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер ЕС | 3.4.23.34 | ||||||||
| Количество CAS | 110910-42-4 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
Катепсин E является фермент (EC 3.4.23.34), который у человека кодируется CTSE ген.[5][6][7] Фермент также известен как медленная протеиназа, аспарагиновая протеиназа мембраны эритроцитов, SMP, EMAP, непепсиновая протеиназа, катепсин D-подобная кислая протеиназа, катепсин Е-подобная кислая протеиназа, протеиназа катепсина D-типа) является фермент.[8][9][10][11]
Катепсин E - это протеаза найдены в животных, а также в различных других организмах, принадлежащих к аспарагиновая протеаза группа. У человека он кодируется CTSE ген расположен по адресу 1q32 на хромосома 1.[12][13][11][14] Это внутриклеточный нелизосомальный гликопротеин это в основном находится в коже и в иммунных клетках.[15] Белок представляет собой аспартилпротеазу, которая функционирует как гомодимер с дисульфидной связью и имеет олигосахаридную цепь высокоманнозного типа.[16] Он является членом семейства пептидаз A1 и, следовательно, обладает специфичностью, аналогичной специфичности Пепсин А и Катепсин D. Катепсин E является внутриклеточным ферментом и, по-видимому, не участвует в переваривании пищевых белков. В наибольшем количестве он обнаруживается на поверхности клеток эпителия желудка, производящей слизь. Это первая аспарагиновая протеаза, присутствующая в желудке плода, и ее обнаруживают более чем в половине случаев рака желудка, что приводит к ее появлению. онкофетальный антиген. Варианты стенограммы с использованием альтернативы полиаденилирование сигналов и двух вариантов транскрипции, кодирующих разные изоформы существуют для этого гена.[14][15]
Дефицит уровня катепсина E в организме может играть роль в воспалительных заболеваниях кожи, таких как атопический дерматит, лечение которого будет зависеть от исправления функций и уровней белка в организме.[17] Вместе с ренин и катепсин D, катепсин E - одна из немногих аспарагиновых протеаз, которые, как известно, вырабатываются в тканях человека, кроме тканей желудочно-кишечного тракта и репродуктивного тракта.[18]
Структура
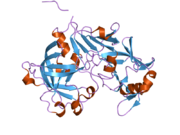
Структура катепсина E очень похожа на структуру катепсина D и BACE1, и все 3 имеют практически идентичные области активного сайта. Различия между ними заключаются в микросреде, окружающей их активные сайты. Остатки DTG 96-98 и DTG 281-283 способствуют образованию активного центра фермента. Также имеются две пары дисульфидных связей при остатках Cys 272-276 и Cys 314-351. Два других остатка Cys в положениях 109 и 114 аминокислотной цепи расположены близко друг к другу в трехмерном пространстве, однако расстояние между их атомами серы составляет 3,53 Å, что слишком велико для образования надлежащей дисульфидной связи. В структуре также есть четыре водородные связи между остатками Asp активного центра и окружающими остатками. Отличительный фактор катепсина E по сравнению со структурой катепсина D и BACE1 можно увидеть в образовании дополнительной водородной связи между остатками Asp 96 и Ser 99 и отсутствии водородной связи с Leu / Met в Asp 281.[17]
Расположение
Фермент распределяется в клетках желудочно-кишечный тракт, лимфоидный ткани, клетки крови, мочевыводящие органы и микроглия. Его внутриклеточная локализация в различных клетках млекопитающих отличается от его аналога катепсина D. Катепсин E ассоциируется с мембранной тканью во внутриклеточных канальцах желудка. париетальные клетки, желчные каналы клеток печени, клетки риналя проксимальный каналец в почках, эпителиальных клетках кишечника, трахее и бронхах, остеокласты и даже в эритроцитах. Его локализацию в структурах эндосом можно увидеть во многих различных типах клеток, таких как антигенпрезентирующие В-клетки. лимфобласты, клетки желудка и микроглия. Его присутствие также обнаруживается в цистерны ячейки эндоплазматический ретикулум.[16][19]
Функция
Катепсин E играет жизненно важную роль в деградации белка, процессинге антигена через MHC класс II путь[14] и образование биоактивного белка. Также считается, что фермент участвует в реализации пути смерти нейронов, вызванной возрастом, а также в чрезмерной стимуляции рецепторов глутамата эксайтотоксинами и транзиторной стимуляцией переднего мозга. ишемия. В эксперименте, проведенном на крысах, катепсин Е практически не обнаруживался в тканях мозга молодых крыс, однако у более старых крыс его уровень был значительно повышен в тканях мозга. неостриатум и кора головного мозга. Фермент также экспрессировался на высоких уровнях в активированной микроглии области CA1 гиппокампа и в дегенерирующих нейронах в течение недели после временной ишемии переднего мозга.[19] Катепсин E, возможно, играет роль в развитии хорошо дифференцированных аденокарцинома из кишечника метаплазия.[16] Фермент также играет роль в ассоциации с дендритными клетками, где он генерирует репертуар CD4 в ответ на собственные и чужеродные белки.[20]
Посттрансляционная модификация
Фермент гликозилированный. Различные типы клеток способствуют различию в природе углеводной цепи. В проферменте фибробластов наблюдается олигосахарид с высоким содержанием маннозы, однако зрелый фермент можно увидеть с олигосахаридом сложного типа. В мембранах эритроцитов зрелый фермент и профермент содержат олигосахариды сложного типа. Автокаталитическое расщепление дает две формы фермента: форма 1 начинается с остатка Ile 54, а форма 2 - с Thr 57.[21]
Смотрите также
использованная литература
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000196188 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000004552 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Couvreur JM, Azuma T, Miller DA, Rocchi M, Mohandas TK, Boudi FA, Taggart RT (август 1990 г.). «Отнесение катепсина E (CTSE) к области хромосомы человека 1q31 путем гибридизации in situ и анализа гибридов соматических клеток». Цитогенетика и клеточная генетика. 53 (2–3): 137–9. Дои:10.1159/000132914. PMID 2369841.
- ^ Адзума Т., Пальс Г., Мохандас Т.К., Куврёр Дж.М., Таггарт Р.Т. (октябрь 1989 г.). «Человеческий желудочный катепсин E. Предсказанная последовательность, локализация в хромосоме 1 и гомология последовательности с другими аспарагиновыми протеиназами». Журнал биологической химии. 264 (28): 16748–53. PMID 2674141.
- ^ "Entrez Gene: CTSE катепсин E".
- ^ Лапресл С., Пуисдар В., Поршон-Бертолотто С., Жукофф Е., Тюрк V (июнь 1986 г.). «Структурные различия между катепсином E кролика и катепсином D». Биологическая химия Хоппе-Зейлер. 367 (6): 523–6. Дои:10.1515 / bchm3.1986.367.1.523. PMID 3741628.
- ^ Ёнэдзава С., Фуджи К., Маэдзима Ю., Тамото К., Мори Ю., Муто Н. (ноябрь 1988 г.). «Дальнейшие исследования катепсина Е крысы: субклеточная локализация и существование активной формы субъединицы». Архивы биохимии и биофизики. 267 (1): 176–83. Дои:10.1016/0003-9861(88)90021-5. PMID 3058036.
- ^ Джапп Р.А., Ричардс А.Д., Кей Дж., Данн Б.М., Вайкофф Дж. Б., Самлофф И. М., Ямамото К. (сентябрь 1988 г.). «Идентификация аспарагиновых протеиназ из мембран эритроцитов человека и слизистой оболочки желудка (медленная протеиназа) как каталитически эквивалентных катепсину Е». Биохимический журнал. 254 (3): 895–8. Дои:10.1042 / bj2540895. ЧВК 1135167. PMID 3058118.
- ^ а б Адзума Т., Пальс Г., Мохандас Т.К., Куврёр Дж.М., Таггарт Р.Т. (октябрь 1989 г.). «Человеческий желудочный катепсин E. Предсказанная последовательность, локализация в хромосоме 1 и гомология последовательности с другими аспарагиновыми протеиназами». Журнал биологической химии. 264 (28): 16748–53. PMID 2674141.
- ^ «Катепсин Е CTSE [Homo sapiens (человек)] - Ген - NCBI». www.ncbi.nlm.nih.gov. Получено 2016-10-16.
- ^ Couvreur JM, Azuma T, Miller DA, Rocchi M, Mohandas TK, Boudi FA, Taggart RT (1990). «Отнесение катепсина E (CTSE) к области хромосомы человека 1q31 путем гибридизации in situ и анализа гибридов соматических клеток». Цитогенетика и клеточная генетика. 53 (2–3): 137–9. Дои:10.1159/000132914. PMID 2369841.
- ^ а б c Zaidi N, Kalbacher H (март 2008 г.). «Катепсин E: мини-обзор». Сообщения о биохимических и биофизических исследованиях. 367 (3): 517–22. Дои:10.1016 / j.bbrc.2007.12.163. PMID 18178150.
- ^ а б Ясуда Ю., Кагеяма Т., Акамине А., Сибата М., Коминами Е., Учияма Ю., Ямамото К. (июнь 1999 г.). «Характеристика новых флуорогенных субстратов для быстрого и чувствительного анализа катепсина E и катепсина D». Журнал биохимии. 125 (6): 1137–43. Дои:10.1093 / oxfordjournals.jbchem.a022396. PMID 10348917.
- ^ а б c Саку Т, Сакаи Х, Сибата Й, Като Й, Ямамото К. (декабрь 1991 г.). «Иммуноцитохимическое исследование четкой внутриклеточной локализации катепсина E и катепсина D в клетках желудка человека и различных клетках крыс». Журнал биохимии. 110 (6): 956–64. Дои:10.1093 / oxfordjournals.jbchem.a123696. PMID 1794985.
- ^ а б Chou KC (май 2005 г.). «Моделирование третичной структуры катепсина-Е человека». Сообщения о биохимических и биофизических исследованиях. 331 (1): 56–60. Дои:10.1016 / j.bbrc.2005.03.123. PMID 15845357.
- ^ Лиз В.Е., Калинка С., Мич Дж., Каппер С.Дж., Кук Н.Д., Кей Дж. (Октябрь 1990 г.). «Генерация человеческого эндотелина катепсином Е». Письма FEBS. 273 (1–2): 99–102. Дои:10.1016/0014-5793(90)81060-2. PMID 2226872.
- ^ а б Цукуба Т., Окамото К., Ясуда Ю., Морикава В., Наканиши Н., Ямамото К. (декабрь 2000 г.). «Новые функциональные аспекты катепсина D и катепсина E». Молекулы и клетки. 10 (6): 601–11. Дои:10.1007 / с10059-000-0601-8. PMID 11211863.
- ^ Chain BM, Free P, Medd P, Swetman C, Tabor AB, Terrazzini N (февраль 2005 г.). «Экспрессия и функция катепсина E в дендритных клетках». Журнал иммунологии. 174 (4): 1791–800. Дои:10.4049 / jimmunol.174.4.1791. PMID 15699105.
- ^ «CTSE - предшественник катепсина E - Homo sapiens (человек) - ген и белок CTSE». www.uniprot.org. Получено 2016-10-16.
дальнейшее чтение
- Цукуба Т., Ямамото К. (июль 2003 г.). «[Атопический дерматит и катепсин E]». Нихон Якуригаку Засши. Folia Pharmacologica Japonica. 122 (1): 15–20. Дои:10.1254 / fpj.122.15. PMID 12843568.
- Флинн Т.Дж., Дешмук Д.С., Пиеринджер Р.А. (август 1977 г.). «Влияние измененной функции щитовидной железы на метаболизм галактозилдиацилглицерина в миелинизирующем мозге крыс». Журнал биологической химии. 252 (16): 5864–70. PMID 195962.
- Адзума Т., Лю WG, Вандер Лаан DJ, Bowcock AM, Taggart RT (январь 1992 г.). «Ген желудочного катепсина Е человека. Множественные транскрипты возникают в результате альтернативного полиаденилирования первичных транскриптов одного локуса гена в 1q31-q32». Журнал биологической химии. 267 (3): 1609–14. PMID 1370478.
- Саку Т, Сакаи Х, Сибата Й, Като Й, Ямамото К. (декабрь 1991 г.). «Иммуноцитохимическое исследование четкой внутриклеточной локализации катепсина E и катепсина D в клетках желудка человека и различных клетках крыс». Журнал биохимии. 110 (6): 956–64. Дои:10.1093 / oxfordjournals.jbchem.a123696. PMID 1794985.
- Атауда С.Б., Такахаши Т., Иноуэ Х., Ичиносе М., Такахаши К. (ноябрь 1991 г.). «Протеолитическая активность и специфичность расщепления катепсина E при физиологическом pH, как исследуется в отношении B-цепи окисленного инсулина». Письма FEBS. 292 (1–2): 53–6. Дои:10.1016 / 0014-5793 (91) 80832-Н. PMID 1959628.
- Лиз В.Е., Калинка С., Мич Дж., Каппер С.Дж., Кук Н.Д., Кей Дж. (Октябрь 1990 г.). «Генерация человеческого эндотелина катепсином Е». Письма FEBS. 273 (1–2): 99–102. Дои:10.1016/0014-5793(90)81060-2. PMID 2226872.
- Атауда С.Б., Мацузаки О, Кагеяма Т., Такахаши К. (апрель 1990 г.). «Структурные доказательства двух изоферментных форм и сайта связывания углеводов желудочного катепсина E человека». Сообщения о биохимических и биофизических исследованиях. 168 (2): 878–85. Дои:10.1016 / 0006-291X (90) 92403-М. PMID 2334440.
- Фаулер С.Д., Кей Дж., Данн Б.М., Татнелл П.Дж. (июнь 1995 г.). «Мономерный катепсин Е человека». Письма FEBS. 366 (1): 72–4. Дои:10.1016 / 0014-5793 (95) 00501-У. PMID 7789521.
- Finley EM, Kornfeld S (декабрь 1994 г.). «Субклеточная локализация и нацеливание катепсина Е». Журнал биологической химии. 269 (49): 31259–66. PMID 7983070.
- Такэда-Эзаки М., Ямамото К. (август 1993 г.). «Выделение и биохимическая характеристика прокатепсина E из мембран эритроцитов человека». Архивы биохимии и биофизики. 304 (2): 352–8. Дои:10.1006 / abbi.1993.1361. PMID 8346912.
- Шульц Т.Ф., Ривз Дж. Д., Хоад Дж. Г., Портной С., Стивенс П., Клементс Г., Ортлепп С., Пейдж К. А., Мур Дж. П., Вайс Р. А. (февраль 1993 г.). «Влияние мутаций в петле V3 gp120 ВИЧ-1 на инфекционность и восприимчивость к протеолитическому расщеплению». Исследования СПИДа и ретровирусы человека. 9 (2): 159–66. Дои:10.1089 / помощь.1993.9.159. PMID 8457383.
- Finzi G, Cornaggia M, Capella C, Fiocca R, Bosi F, Solcia E, Samloff IM (март 1993). «Катепсин E в связанном с фолликулом эпителии кишечника и миндалин: локализация в М-клетках и возможная роль в процессинге антигена». Гистохимия. 99 (3): 201–11. Дои:10.1007 / BF00269138. PMID 8491674.
- Адзума Т., Хираи М., Ито С., Ямамото К., Таггарт Р. Т., Мацуба Т., Ясукава К., Уно К., Хаякумо Т., Накадзима М. (август 1996 г.). «Экспрессия катепсина E в поджелудочной железе: возможный онкомаркер для поджелудочной железы, предварительный отчет». Международный журнал рака. 67 (4): 492–7. Дои:10.1002 / (SICI) 1097-0215 (19960807) 67: 4 <492 :: AID-IJC5> 3.0.CO; 2-N. PMID 8759606.
- Сили Л., Мота Ф., Реймент Н., Татнелл П., Кей Дж., Цепь В (август 1996 г.). «Регулирование экспрессии катепсина E во время дифференцировки В-клеток человека in vitro». Европейский журнал иммунологии. 26 (8): 1838–43. Дои:10.1002 / eji.1830260826. PMID 8765029.
- Бернштейн Х.Г., Райхенбах А., Видерандерс Б. (январь 1998 г.). «Иммунореактивность катепсина Е в тканях глаза человека: влияние старения и патологических состояний». Письма о неврологии. 240 (3): 135–8. Дои:10.1016 / S0304-3940 (97) 00946-4. PMID 9502222.
- Кук М., Касвелл Р. Дж., Ричардс Р. Дж., Кей Дж., Татнелл П. Дж. (Май 2001 г.). «Регулирование экспрессии гена прокатепсина E человека и мыши». Европейский журнал биохимии. 268 (9): 2658–68. Дои:10.1046 / j.1432-1327.2001.02159.x. PMID 11322887.
- Сузуки Й, Цунода Т, Сесе Дж, Тайра Х, Мидзусима-Сугано Дж, Хата Х, Ота Т, Исогай Т, Танака Т, Накамура Й, Суяма А, Сакаки Й, Моришита С., Окубо К., Сугано С. (май 2001 г.) . «Идентификация и характеристика потенциальных промоторных областей 1031 вида генов человека». Геномные исследования. 11 (5): 677–84. Дои:10.1101 / гр.гр-1640р. ЧВК 311086. PMID 11337467.
внешние ссылки
- В МЕРОПЫ онлайн-база данных пептидаз и их ингибиторов: A01.010
- Катепсин + E в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)