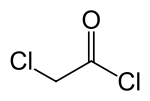
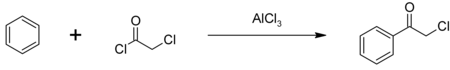WikiDer > Хлорацетилхлорид
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC Хлорацетилхлорид | |
| Другие имена 2-хлорацетилхлорид Хлоруксусная кислота хлорид Хлоруксусный хлорид Монохлорацетилхлорид | |
| Идентификаторы | |
3D модель (JSmol) | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| ECHA InfoCard | 100.001.065 |
| Номер ЕС |
|
| КЕГГ | |
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| Номер ООН | 1752 |
| |
| |
| Характеристики | |
| C2ЧАС2Cl2О | |
| Молярная масса | 112.94 г · моль−1 |
| Внешность | От бесцветной до желтой жидкости |
| Плотность | 1,42 г / мл |
| Температура плавления | -22 ° С (-8 ° F, 251 К) |
| Точка кипения | 106 ° С (223 ° F, 379 К) |
| Реагирует | |
| Давление газа | 19 мм рт. Ст. (20 ° C)[1] |
| Опасности | |
| Паспорт безопасности | Оксфордский паспорт безопасности материалов |
| Пиктограммы GHS |     |
| Сигнальное слово GHS | Опасность |
| H301, H311, H314, H331, H372, H400 | |
| P260, P261, P264, P270, P271, P273, P280, P301 + 310, P301 + 330 + 331, P302 + 352, P303 + 361 + 353, P304 + 340, P305 + 351 + 338, P310, P311, P312, P314, P321, P322, P330, P361, P363, P391, P403 + 233, P405 | |
| точка возгорания | негорючий [1] |
| NIOSH (Пределы воздействия на здоровье в США): | |
PEL (Допустимо) | никто[1] |
REL (Рекомендуемые) | TWA 0,05 частей на миллион (0,2 мг / м3)[1] |
IDLH (Непосредственная опасность) | N.D.[1] |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Хлорацетилхлорид хлорированный ацилхлорид. Это бифункциональное соединение, что делает его полезным химическим строительным блоком.
Производство
Промышленно его производит карбонилирование из метиленхлорид, окисление из винилиденхлорид, или добавление хлор к кетен.[2] Его можно приготовить из хлоруксусная кислота и тионилхлорид, пентахлорид фосфора, или же фосген.
Реакции
Хлорацетилхлорид является бифункциональным - ацилхлорид легко образует сложные эфиры[3] и амиды, в то время как другой конец молекулы может образовывать другие связи, например с аминами. Использование хлорацетилхлорида в синтезе лидокаин является иллюстративным:[4]
Приложения
В основном хлорацетилхлорид используется в качестве промежуточного продукта при производстве гербицидов из семейства хлорацетанилидов, включая метолахлор, ацетохлор, алахлор и бутахлор; примерно 100 миллионов фунтов используются ежегодно. Некоторое количество хлорацетилхлорида также используется для производства фенацилхлорид, еще один промежуточный химический продукт, также используемый в качестве слезоточивого газа.[2] Фенацил хлорид синтезируется в Ацилирование Фриделя-Крафтса из бензол, с хлорид алюминия катализатор:[5]
Безопасность
Как и другие ацилхлориды, реакция с другими протонными соединениями, такими как амины, спирты и вода, дает соляная кислота, что делает его слезоточивый.
Нет регулируемого допустимый предел воздействия установлен Управление по охране труда. Тем не менее Национальный институт охраны труда и здоровья установил рекомендуемый предел воздействия 0,05 промилле в течение восьмичасового рабочего дня.[6]
Рекомендации
- ^ а б c d е Карманный справочник NIOSH по химической опасности. "#0120". Национальный институт охраны труда и здоровья (NIOSH).
- ^ а б Пол Р. Уоршам (1993). «15. Галогенированные производные». В Zoeller, Joseph R .; Агреда, В. Х. (ред.). Уксусная кислота и ее производные (Google Книги выдержка). Нью-Йорк: М. Деккер. С. 288–298. ISBN 0-8247-8792-7.
- ^ Роберт Х. Бейкер и Фредерик Г. Бордвелл (1955). «трет-бутилацетат». Органический синтез.; Коллективный объем, 3
- ^ Т. Дж. Рейли (1999). «Приготовление лидокаина». J. Chem. Educ. 76 (11): 1557. Дои:10.1021 / ed076p1557.
- ^ Натан Левин и Уолтер Хартунг (1955). «ω-Хлоризонитрозоацетофенон». Органический синтез.; Коллективный объем, 3, п. 191
- ^ "Карманный справочник NIOSH по химической опасности". Центры по контролю и профилактике заболеваний. 2011 г.