WikiDer > EIF4A1
Фактор инициации эукариот 4A-I (также известный как eIF4A1 или DDX2A) - 46 кДа цитозольный белок что у людей кодируется EIF4A1 ген, который расположен на хромосома 17.[5][6][7] Это самый распространенный представитель eIF4A семья из АТФ-зависимый РНК-геликазы, и играет решающую роль в инициации зависящей от кэп трансляция эукариотических белков как компонент eIF4F комплекс инициации перевода.[8] eIF4A1 раскручивает вторичную структуру РНК внутри 5'-UTR из мРНК, важный шаг, необходимый для набора 43S преинициативный комплекс, и, таким образом, перевод белка в эукариоты.[8] Впервые он был охарактеризован в 1982 году Грифо, и другие., который очистил его от кролик ретикулоцит лизат.[9]
Задний план
Регулирование перевод транскриптов мРНК в белок - один из лучших способов, с помощью которых клетка может изменить свой ответ на окружающую среду, так как изменения транскрипция генов часто требуется значительно больше времени для активации. Трансляцию белка можно разделить на четыре фазы: активация, инициация, элонгация и завершение. Из этих шагов инициация - это тот, который клетки имеют наибольший контроль. Это этап, ограничивающий скорость синтеза белка, контролируемый множеством белков, известных как факторы инициации эукариот, или eIFs. Относительное количество этих факторов или их относительная индивидуальная активность дает эукариотическим клеткам широкий контроль над скоростью инициации и, следовательно, над синтезом белка. eIF регулируются хорошо известными внутриклеточными сигнальными путями, такими как Путь PI3K / AKT / mTOR, однако другие биохимические уровни регуляции, такие как сложность вторичной структуры РНК в 5'-UTR, становятся очевидными с дальнейшими исследованиями.[8]
Подсемейство eIF4A у млекопитающих состоит из трех паралоги, eIF4A1, eIF4A2, и eIF4A3.[10] eIF4A1 и eIF4A2 имеют 90% сходства последовательностей и оба являются цитоплазматическими белками, в то время как eIF4A3 локализован в ядро, и разделяет только 60% гомология.[10] Исторически eIF4A1 и eIF4A2 считались взаимозаменяемыми, поскольку это наблюдалось в in vitro эксперименты, но дальнейшие исследования показали, что eIF4A1 более распространен в делящихся клетках, тогда как eIF4A2 более распространен в неделящихся клетках, и, кроме того, более свежие данные свидетельствуют о том, что они могут иметь функционально разные роли in vivo.[8][10]
Структура
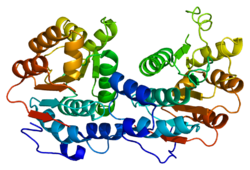
eIF4A1 является членом МЕРТВАЯ коробка семейство РНК-геликаз.[11] РНК-геликазы - это ферменты, которые используют энергию, выделяемую при гидролизе АТФ, для управления вторичной структурой РНК, а семейство DEAD-боксов является самым большим семейством РНК-геликаз.[11] Название «DEAD box» относится к ключевой аминокислотной последовательности D-E-A-D на мотиве II геликазы, которая участвует в нуклеозидтрифосфат привязка (в случае eIF4A1, АТФ). Другие консервированные мотивы, общие для всех белков семейства eIF4A, представляют собой мотивы Q, I, Ia, Ib, III, IV, V и VI. Мотивы Ia, Ib, IV и V связывают РНК, мотивы I, II и III опосредуют РНК-зависимую АТФаза активность и мотив VI необходимы как для связывания РНК, так и для гидролиза АТФ.[10]

Семейство DEAD-боксов отмечено структурно высококонсервативным ядром геликазы, состоящим из двух RecA-подобные домены, соединенные гибкой шарнирной областью, вокруг которой белок может открываться и закрываться при гидролизе АТФ.[13][10][14] Щель, образованная между этими двумя доменами, образует АТФ-связывающий карман.[11] Молекула РНК связывается напротив этого связывающего кармана, протягиваясь через каждый из доменов.[11] Это ядро фланкировано вариабельными вспомогательными доменами, которые придают им уникальную функцию каждой РНК-геликазы частично за счет специфического связывания с дополнительными белками.[11]
Функция
eIF4A1 представляет собой АТФ-зависимую РНК-геликазу,[15] однако точная природа его зависимости от АТФ для его функции все еще обсуждается.[10] Хотя после связывания АТФ последующий гидролиз вызывает конформационные изменения в eIF4A1, было показано, что другие DEAD-бокс-РНК-геликазы обладают хеликазной активностью в присутствии негидролизуемых аналогов АТФ, что позволяет предположить, что связывание, а не гидролиз, является более важным элементом в регулирующая деятельность.[10]
eIF4A1 является компонентом комплекса инициации трансляции eIF4F вместе с eIF4E, то 5'-концевой колпачок связывающий белок, и eIF4G, белок каркаса, который удерживает вместе eIF4A и eIF4E.[10] Комплекс eIF4F часто сопровождается дополнительными белками eIF4B и eIF4H, любой из которых может по-разному увеличивать активность eIF4A1. После того, как мРНК транскрибируется с ДНК и перемещается в цитоплазму, цитозольный PABP связан с поли (A) -хвостом растущей мРНК, его 5'-кэп будет связываться с eIF4E, а PABP будет связываться с eIF4G.[8] Затем eIF4A1 будет раскручивать вторичную структуру РНК от 5 'до 3', поскольку 43S PIC рекрутируется в комплекс eIF4F.[8] 43S PIC также будет сканировать развернутую мРНК от 5 до 3 футов, пока она не достигнет AUG. стартовый кодон, после чего 60S рибосомная субъединица будут набраны, чтобы начать процесс удлинения.[8]

(B) eIF4A1 раскручивание вторичной структуры мРНК и рекрутирование 43S PIC.
(C) 40S субъединица рибосомы, сканирующая 5'-UTR транскрипта мРНК в поисках стартового кодона.
(D) Рекрутирование рибосомной субъединицы 60S и начало элонгации.
Регулирование
Транскрипция eIF4A1 управляется фактор транскрипции МОЙ С.[8] Сама по себе геликазная активность eIF4A1 является низкой, однако эта особенность накладывает практическое ограничение на eIF4A1, поскольку неспецифическая, «непреднамеренная» активность геликазы в клетке может быть вредной для функции определенных эндогенных необходимых структур РНК.[10] Его эффективность значительно улучшается в присутствии eIF4B и eIF4H, партнеров по связыванию, которые модулируют его активность. Когда eIF4B связывается с eIF4A1, геликазная активность eIF4A1 увеличивается более чем в 100 раз, но когда вместо этого связывается eIF4H, увеличение не столь велико, что позволяет предположить, что различные относительные концентрации этих дополнительных белков могут обеспечить дополнительный уровень регуляции эффективности. из eIF4A1.[10]
И наоборот, активность eIF4A1 подавляется, когда она связана с PDCD4, а подавитель опухолей сам модулируется mTOR и miR-21.[8] PCDC4 обычно локализуется в ядре здоровых клеток, однако в канцерогенных условиях он перемещается в ядро, и две отдельные молекулы eIF4A1 будут связываться с ним, подавляя способность eIF4A1 связываться с РНК, блокируя молекулы в их неактивной конформации. тем самым предотвращая связывание с eIF4G.[16][11]
Роль в болезни
Рак
Трансляционная дисрегуляция - отличительный признак злокачественная трансформация из рак клетки. Раковые клетки в растущих опухолях становятся «зависимыми» от повышенных уровней трансляции белков и, в частности, зависят от активированной трансляции проонкогенных мРНК. Эти проонкогенные мРНК имеют характерно более длинные 5'-UTR с более сложными вторичными структурами, а повышающая регуляция eIF4A1 участвует в нескольких раковых заболеваниях человека (см. Таблицу).[8][17][18] Учитывая общую тенденцию сверхэкспрессии eIF4A1, вызывающую рак, существует интерес к разработке ингибиторов этого фермента. Некоторые природные соединения были идентифицированы как кандидаты в ингибиторы для развития, хотя они неспецифично ингибируют как eIF4A1, так и eIF4A2.[8] Они включают гиппуристанол, сильвестрол и патеамин А, среди прочего.[8] Сильвестрол, в частности, рокаглат производное, и этот класс соединений может быть жизнеспособными ингибиторами eIF4A.[19]
| Тип рака | eIF4A1 Нарушение регуляции / ассоциация |
|---|---|
| Гепатоцеллюлярная карцинома | Сверхэкспрессия[17] |
| Меланома | Сверхэкспрессия[17] |
| Немелкоклеточный рак легкого (НМРЛ) | Выражение, связанное с метастаз[8] |
| Рак эндометрия | Избыточное выражение в атипичная гиперплазия[8] |
| Рак шейки матки | Сверхэкспрессия; уменьшилось выражение после брахитерапия связано с лучшим результатом[8] |
| Рак молочной железы | Выражение, связанное с плохим исходом в рецептор эстрогена отрицательная болезнь[8] |
Вирусные инфекции
Вирусы полагаются на захват клеточного аппарата клеток, которые они заражают, чтобы создать свои собственные вирусные белки и позволить им продолжать инфицировать новые клетки. Таким образом, их способность манипулировать eIF, такими как eIF4A1, значительно влияет на их вирулентность. Например, цитомегаловирус полагается на eIF4A для управления синтезом белка. Вирусный белок pUL69 стабилизирует образование eIF4F за счет связывания с eIF4A, процесса, посредством которого предотвращается диссоциация eIF4E от комплекса eIF4F.[14] Таким образом, eIF4E больше не может секвестрироваться своим негативным регулятором, 4EBP.[14] Кроме того, цитомегаловирус стимулирует синтез всех элементов комплекса eIF4F, чтобы управлять синтезом белка.[14] Другие вирусы, например Cotesia plutellae браковирус (CpBV), которые способствуют независимой от кэпа трансляции, будут использовать преимущества eIF4A1 в обратном контексте, изолируя eIF4A1 от комплекса eIF4F с вирусными партнерами по связыванию, в данном случае с белком, называемым CpBV15β, таким образом подавляя эндогенную кэп-зависимую трансляцию мРНК и способствуя трансляции вирусного белка.[14] Соединения, упомянутые в предыдущем разделе о раке, гиппуристанол, сильвестрол, патеамин А, производные рокаглата и т. Д., Также могут применяться в качестве предполагаемых вирусных ингибиторов.[8][19]
использованная литература
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000161960 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000059796 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Ким Н.С., Като Т., Абэ Н., Като С. (апрель 1993 г.). «Нуклеотидная последовательность кДНК человека, кодирующая фактор инициации эукариот 4AI». Исследования нуклеиновых кислот. 21 (8): 2012. Дои:10.1093 / nar / 21.8.2012. ЧВК 309447. PMID 8493113.
- ^ Джонс Э., Куинн С.М., См. К.Г., Монтгомери Д.С., Форд М.Дж., Кёльбле К. и др. (Октябрь 1998 г.). «Связанные гены человеческого фактора инициации элонгации 4A1 (EIF4A1) и CD68 отображаются на хромосоме 17p13». Геномика. 53 (2): 248–50. Дои:10.1006 / geno.1998.5515. PMID 9790779.
- ^ «Ген Entrez: фактор инициации эукариотической трансляции EIF4A1 4A, изоформа 1».
- ^ а б c d е ж г час я j k л м п о п q Раза Ф, Уолдрон Дж. А., Кен Дж. Л. (декабрь 2015 г.). «Нарушение трансляции при раке: изоформы eIF4A и детерминанты последовательности eIF4A-зависимости». Сделки Биохимического Общества. 43 (6): 1227–33. Дои:10.1042 / BST20150163. PMID 26614665.
- ^ Грифо Дж. А., Тахара С. М., Лейс Дж. П., Морган М. А., Шаткин А. Дж., Меррик В. К. (май 1982 г.). «Характеристика эукариотического фактора инициации 4А, белка, участвующего в АТФ-зависимом связывании мРНК глобина». Журнал биологической химии. 257 (9): 5246–52. PMID 7068683.
- ^ а б c d е ж г час я j k Лу В.Т., Вильчинска А., Смит Э., Бушелл М. (февраль 2014 г.). «Разнообразные роли семейства eIF4A: вы - компания, которую составляете». Сделки Биохимического Общества. 42 (1): 166–72. Дои:10.1042 / BST20130161. PMID 24450646.
- ^ а б c d е ж Линдер П., Янковский Э. (июль 2011 г.). «От раскручивания до зажима - семейство DEAD-бокс-РНК-геликазы». Обзоры природы. Молекулярная клеточная биология. 12 (8): 505–16. Дои:10.1038 / nrm3154. PMID 21779027. S2CID 2037710.
- ^ «EIF4A1 - фактор инициации эукариот 4A-I - Homo sapiens (человек) - ген и белок EIF4A1». www.uniprot.org.
- ^ Шарма Д., Янковский Э. (20 июля 2014 г.). «Подсемейство Ded1 / DDX3 DEAD-бокс-РНК-геликаз». Критические обзоры в биохимии и молекулярной биологии. 49 (4): 343–60. Дои:10.3109/10409238.2014.931339. PMID 25039764. S2CID 23470056.
- ^ а б c d е Монтеро, Хильда; Перес-Хиль, Густаво; Сампиери, Клара Л. (22 февраля 2019 г.). «Фактор инициации эукариот 4A (eIF4A) при вирусных инфекциях». Гены вирусов. 55 (3): 267–273. Дои:10.1007 / s11262-019-01641-7. ЧВК 7088766. PMID 30796742.
- ^ Шацкий И.Н., Дмитриев С.Е., Андреев Д.Е., Теренин И.М. (1 марта 2014 г.). «Транскриптомные исследования раскрывают разнообразие способов рекрутирования мРНК в эукариотические рибосомы». Критические обзоры в биохимии и молекулярной биологии. 49 (2): 164–77. Дои:10.3109/10409238.2014.887051. PMID 24520918. S2CID 207506515.
- ^ «Запрограммированная PDCD4 клеточная смерть 4 [Homo sapiens (человек)] - Ген - NCBI». www.ncbi.nlm.nih.gov.
- ^ а б c Али М.Ю., Ур Рахман М.С., Цзя З, Цзян К. (июнь 2017 г.). «Факторы инициации трансляции эукариот и рак». Биология опухоли. 39 (6): 1010428317709805. Дои:10.1177/1010428317709805. PMID 28653885.
- ^ Абдельхалим М (июль 2004 г.). «У человека РНК-геликазы есть роль в развитии рака?». Biochimica et Biophysica Acta (BBA) - Обзоры на рак. 1704 (1): 37–46. Дои:10.1016 / j.bbcan.2004.05.001. PMID 15238243.
- ^ а б Пан, Ли; Woodard, John L .; Лукас, Дэвид М .; Fuchs, James R .; Кингхорн, А. Дуглас (2 мая 2014 г.). «Рокагламид, сильвестрол и структурно родственные биоактивные соединения из видов Aglaia». Отчеты о натуральных продуктах. 31 (7): 924–939. Дои:10.1039 / c4np00006d. ЧВК 4091845. PMID 24788392.
дальнейшее чтение
- Редди Н.С., Рот В.В., Брэгг П.В., Вахба А.Дж. (октябрь 1988 г.). «Выделение и картирование гена фактора инициации синтеза белка 4А и его экспрессия во время дифференциации клеток мышиной эритролейкемии». Ген. 70 (2): 231–43. Дои:10.1016/0378-1119(88)90195-3. PMID 3215517.
- Кукимото И., Ватанабэ С., Танигучи К., Огата Т., Йошиике К., Канда Т. (апрель 1997 г.). «Характеристика клонированного промотора гена фактора инициации 4AI человека». Сообщения о биохимических и биофизических исследованиях. 233 (3): 844–7. Дои:10.1006 / bbrc.1997.6555. PMID 9168945.
- Иматака Х, Соненберг Н (декабрь 1997 г.). «Человеческий фактор инициации трансляции эукариот 4G (eIF4G) имеет два отдельных и независимых сайта связывания для eIF4A». Молекулярная и клеточная биология. 17 (12): 6940–7. Дои:10.1128 / mcb.17.12.6940. ЧВК 232551. PMID 9372926.
- Гради А, Иматака Х, Свиткин Ю.В., Ром Э, Рот Б., Морино С., Соненберг Н. (январь 1998 г.). «Новый функциональный фактор инициации трансляции человеческих эукариот 4G». Молекулярная и клеточная биология. 18 (1): 334–42. Дои:10.1128 / mcb.18.1.334. ЧВК 121501. PMID 9418880.
- Крейг А. В., Хагигхат А., Ю. А. Т., Соненберг Н. (апрель 1998 г.). «Взаимодействие полиаденилат-связывающего белка с гомологом eIF4G PAIP усиливает трансляцию». Природа. 392 (6675): 520–3. Bibcode:1998Натура.392..520C. Дои:10.1038/33198. PMID 9548260. S2CID 10891925.
- Хенис-Коренблит С., Штрампф Н.Л., Гольдстауб Д., Кимчи А. (январь 2000 г.). «Новая форма белка DAP5 накапливается в апоптотических клетках в результате расщепления каспаз и внутренней трансляции, опосредованной сайтом входа в рибосомы». Молекулярная и клеточная биология. 20 (2): 496–506. Дои:10.1128 / MCB.20.2.496-506.2000. ЧВК 85113. PMID 10611228.
- Куинн С.М., Уайлс А.П., Эль-Шанавани Т., Кэтчпол I, Алнадаф Т., Форд М.Дж. и др. (Декабрь 1999 г.). «Ген фактора инициации эукариот человека 4AI (EIF4A1) содержит множество регуляторных элементов, которые управляют экспрессией репортерного гена высокого уровня в линиях клеток млекопитающих». Геномика. 62 (3): 468–76. Дои:10.1006 / geno.1999.6031. PMID 10644445.
- Куэста Р., Си К., Шнайдер Р. Дж. (Июль 2000 г.). «Специфическая трансляция аденовируса путем вытеснения киназы Mnk1 из комплекса кэп-инициация eIF4F». Журнал EMBO. 19 (13): 3465–74. Дои:10.1093 / emboj / 19.13.3465. ЧВК 313943. PMID 10880459.
- Mendell JT, Medghalchi SM, Lake RG, Noensie EN, Dietz HC (декабрь 2000 г.). «Новые ортологи Upf2p предполагают функциональную связь между инициацией трансляции и бессмысленными комплексами наблюдения». Молекулярная и клеточная биология. 20 (23): 8944–57. Дои:10.1128 / MCB.20.23.8944-8957.2000. ЧВК 86549. PMID 11073994.
- Ли В., Белшем Дж. Дж., Гордый К. Г. (август 2001 г.). «Факторы инициации эукариот 4A (eIF4A) и 4G (eIF4G) взаимно взаимодействуют in vivo в соотношении 1: 1». Журнал биологической химии. 276 (31): 29111–5. Дои:10.1074 / jbc.C100284200. PMID 11408474.
- Du MX, Johnson RB, Sun XL, Staschke KA, Colacino J, Wang QM (апрель 2002 г.). «Сравнительная характеристика двух РНК-геликаз DEAD-бокса в суперсемействе II: человеческий фактор инициации трансляции 4A и геликаза неструктурного белка 3 (NS3) вируса гепатита С». Биохимический журнал. 363 (Pt 1): 147–55. Дои:10.1042/0264-6021:3630147. ЧВК 1222461. PMID 11903057.
- Bohnsack MT, Regener K, Schwappach B, Saffrich R, Paraskeva E, Hartmann E, Görlich D (ноябрь 2002 г.). «Exp5 экспортирует eEF1A через тРНК из ядер и взаимодействует с другими транспортными путями, чтобы ограничить трансляцию в цитоплазме». Журнал EMBO. 21 (22): 6205–15. Дои:10.1093 / emboj / cdf613. ЧВК 137205. PMID 12426392.
- Ян Х.С., Чо М.Х., Закович Х., Хегамиер Г., Зоненберг Н., Колберн Н.Х. (май 2004 г.). «Новая функция доменов MA-3 в супрессоре трансформации и трансляции Pdcd4 важна для его связывания с эукариотическим фактором инициации трансляции 4A». Молекулярная и клеточная биология. 24 (9): 3894–906. Дои:10.1128 / MCB.24.9.3894-3906.2004. ЧВК 387765. PMID 15082783.
- Mingot JM, Bohnsack MT, Jäkle U, Görlich D (август 2004 г.). «Exportin 7 определяет новый общий путь ядерного экспорта». Журнал EMBO. 23 (16): 3227–36. Дои:10.1038 / sj.emboj.7600338. ЧВК 514512. PMID 15282546.
- Хинтон TM, Колдвелл М.Дж., Карпентер Г.А., Морли С.Дж., Пейн В.М. (январь 2007 г.). «Функциональный анализ индивидуальных связывающих активностей каркасного белка eIF4G». Журнал биологической химии. 282 (3): 1695–708. Дои:10.1074 / jbc.M602780200. PMID 17130132.
- Юинг Р.М., Чу П., Элизма Ф., Ли Х., Тейлор П., Клими С. и др. (2007). «Крупномасштабное картирование белок-белковых взаимодействий человека с помощью масс-спектрометрии». Молекулярная системная биология. 3 (1): 89. Дои:10.1038 / msb4100134. ЧВК 1847948. PMID 17353931.
| Эта статья о ген на хромосома человека 17 это заглушка. Вы можете помочь Википедии расширяя это. |