WikiDer > Окисление Фетизона - Википедия
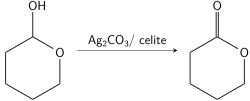
Фетизон окисление это окисление первичных и вторичных спирты использование соединения карбонат серебра (I) впитывается на поверхность целит также известный как Реактив Фетизона Впервые нанят Марселем Фетизоном в 1968 году.[1] Это мягкий реагент, подходящий как для кислот, так и для чувствительных к основанию соединений. Его отличная реактивность с лактолы делает окисление Фетизона полезным методом для получения лактоны из диол. Реакция значительно подавляется полярный группы внутри реакционной системы, а также стерическое препятствие α-водорода спирта.
Подготовка
Реагент Фетизона обычно готовится путем добавления нитрат серебра для водный раствор карбоната, такого как карбонат натрия[2] или же бикарбонат калия,[3] при интенсивном перемешивании в присутствии очищенного целита.
Механизм
Предлагаемый механизм окисления спирта реактивом Фетизона включает одноэлектронное окисление спиртового кислорода и альфа-водорода до спирта двумя атомами серебра (I) на поверхности целита. В карбонат ион затем переходит к депротонированию образовавшегося бикарбоната, образующего карбонил, который далее протонируется дополнительно генерируемым катионом водорода, вызывая устранение из воды и создание углекислый газ.[4]
Предполагается, что лимитирующей стадией этой реакции является начальная ассоциация спирта с ионами серебра. В результате присутствие даже слабо связывающих лигандов с серебром может сильно ингибировать реакцию. В результате даже слабополярные растворители любого разнообразия, такие как ацетат этила или же метилэтилкетон, избегают при использовании этого реагента, поскольку они конкурируют с реагентом.[5] По возможности также следует избегать дополнительных полярных функциональных возможностей реагента, поскольку даже присутствие алкен иногда может снизить реакционную способность субстрата в 50 раз.[6] Обычно используемые растворители, такие как бензол и ксилол крайне неполярны, и дальнейшее ускорение реакции может быть достигнуто за счет использования более неполярных гептан.[6] Растворитель также обычно кипятят с обратным холодильником для ускорения реакции с помощью тепла и удаления воды, образующейся в результате реакции, через азеотропная дистилляция.Стерическое препятствие альфа-водорода к спирту является основным фактором, определяющим скорость окисления, поскольку он влияет на скорость ассоциации.[5] Третичные спирты, в которых отсутствует альфа-водород, выбираются против и обычно не окисляются в присутствии реактива Фетизона.[7]
Увеличение количества целита, используемого в реагенте, ускоряет скорость реакции за счет увеличения площади поверхности, доступной для реакции. Однако увеличение количества целита сверх 900 грамм на моль карбоната серебра (I) начинает замедлять реакцию из-за эффектов разбавления.[5]
Реактивность
Реагент Фетизона используется в первую очередь для окисления первичных или вторичных спиртов до альдегиды или же кетоны с небольшой селективностью по вторичным спиртам[8] и ненасыщенный спирты.[1] Реакцию обычно проводят в кипящем с обратным холодильником сухом неполярном органическом растворителе при обильном перемешивании. Время реакции зависит от структуры спирта и обычно завершается в течение трех часов. Очень привлекательным свойством реагента Фетизона является его способность отделяться от продукта реакции путем его физической фильтрации и промывания бензолом. Неспособность реагента Фетизона окислять третичные спирты делает его чрезвычайно полезным для моноокисления [1,2] диола, в котором один из спиртов является третичным, избегая при этом разрыва углерод-углеродной связи.[7]
Мягкость и структурная чувствительность реагента также делают этот реагент идеальным для моноокисления симметричного диола.[8]
Лактолы чрезвычайно чувствительны к реагенту Фетизона, очень быстро окисляясь до функциональных лактонов. Это позволяет избирательно окислять лактолы в присутствии других спиртов.[9] Это также позволяет классическим способом использовать реагент Фетизона для образования лактонов из первичного диола. Путем окисления одного из спиртов до альдегида второй спирт уравновешивается с альдегидом с образованием лактола, который быстро вступает в реакцию с большим количеством реагента Фетизона, улавливая циклическое промежуточное соединение в виде лактона.[8] Этот метод позволяет синтезировать семичленные лактоны, которые традиционно сложнее синтезировать.[10]
Фенол функциональные группы могут быть окислены до их соответствующих хинон формы. Эти хиноны могут далее соединяться в растворе, образуя множество димеризация в зависимости от их заместителей.[2]
Амины было показано, что окисляются в присутствии реактива Фетизона до енамины[11] и иминий катионы, которые оказались в ловушке,[12] но также может быть выбрано против соединения с более легко окисляемыми спиртовыми функциональными группами.[13]Реагент Фетизона также может использоваться для облегчения циклоприсоединение 4-гидрокси-2-фурохинилона и олефина с образованием дигидрофурохинолинонов.[14]
Защита групп
Пара-метоксибензил (PMB) является обычно используемой защитной группой для спиртов от реагента Фетизона.[15] Поскольку окисление Фетизона является нейтральной реакцией, чувствительные к кислотам и основанию защитные группы также совместимы с реагентом и образующимися побочными продуктами.
Чувствительные группы
Хотя на третичные спирты реагент Фетизона обычно не влияет, на третичные спирты пропаргиловые спирты было показано, что они окисляются в этих условиях и приводят к фрагментации спирта с алкин уходящая группа.[16]
Галогидрины которые обладают транс стереохимией, как было показано, образуют эпоксиды и транспонированные продукты в присутствии реактива Фетизона. Галогидрины, обладающие цис-стереохимией, по-видимому, осуществляют типичное окисление Фетизона до кетона.[17]
[1,3] диолы имеют тенденцию устранять воду после моноокисления реактивом Фетизона с образованием Enone.[8]
При различных структурных условиях [1,2] диолы могут образовывать дикетоны в присутствии реагента Фетизона. Однако также может происходить окислительный разрыв углерод-углеродной связи.[18][19]
Приложения
С момента открытия в качестве полезного метода окисления реагент Фетизона использовался в полном синтезе множества молекул, таких как (±) -букиттинггин.[20] Реагент Фетизона также широко использовался при изучении химического состава различных сахаров для достижения селективного окисления три- и тетраметилированных альдоз до альдолактонов,[21] окисление D-ксилозы и L-арабинозы до D-треозы и L-эритрозы соответственно,[22] и окисление L-сорбозы с получением L-треозы среди многих других.[23]
Рекомендации
- ^ а б Фетизон, Марсель; Гольфье, Мишель (1968). Comptes Rendus de l'Académie des Sciences, серия C. 267: 900. Отсутствует или пусто
| название =(помощь) - ^ а б Фетизон, М .; Балог, В .; Гольфье, М. (1971). «Окисление карбонатом серебра / целитом. V. Окисление фенолов и родственных соединений». Журнал органической химии. 36 (10): 1339. Дои:10.1021 / jo00809a004.
- ^ Parra, M. G. D. L .; Хатчинсон, К. Р. (1987). «Биосинтез макролидов: стереохимия гидроксилирования брефелдинга C». Журнал антибиотиков. 40 (8): 1170–4. Дои:10.7164 / антибиотики. 40.1170. PMID 3680028.
- ^ Тохо, Габриэль (2006) "Реагент Фетизона: карбонат серебра на целите". Окисление спиртов до альдегидов и кетонов. США: Springer. ISBN 978-0-387-23607-0 Дои:10.1007 / 0-387-25725-X_8 С. 281–288.
- ^ а б c Kakis, F.J .; Фетизон, М .; Душкин, Н .; Гольфье, М .; Mourgues, P .; Прейндж, Т. (1974). «Механистические исследования окисления спиртов карбонатом серебра на целите». Журнал органической химии. 39 (4): 523. Дои:10.1021 / jo00918a024.
- ^ а б Eckert-Maksić, M .; Tušek, L .; Сунко, Д. Э. (1971). Хорват. Чим. Acta. 43: 79. Отсутствует или пусто
| название =(помощь) - ^ а б Терашима, Широ; Танно, Норихико; Кога, Кенджи (1980). «Новый синтез (±) -2-ацетил-5,8-диметокси-1,2,3,4-тетрагидро-2-нафтола, ключевого промежуточного соединения для синтеза антрациклинонов». Tetrahedron Lett. 21 (28): 2749–2752. Дои:10.1016 / S0040-4039 (00) 78596-0.
- ^ а б c d Fétizon, M .; Гольфье, М .; Луи, Дж. М. (1969). «Высокоселективное окисление диолов карбонатом серебра». Журнал химического общества D: Химические коммуникации (19): 1102. Дои:10.1039 / C29690001102.
- ^ Zelle, Robert E .; ДеНинно, Майкл П .; Селник, Гарольд Г .; Данишефский, Сэмюэл Дж. (1986). «Систематическая деградация цинкофорина: стереоселективный синтез фрагмента C₂₅-C₂₅». J. Org. Chem. 51 (25): 5032–5036. Дои:10.1021 / jo00375a060.
- ^ Фетизон, Марсель; Гольфье, Мишель; Луи, Жан-Мари (1969). «Новый синтез лактонов: применение к (±) -мевалонолактону». J. Chem. Soc. D (19): 1118–1119. Дои:10.1039 / C29690001118.
- ^ Buechi, G .; Вуэст, Х. (1971). «Синтез 2-ацетил-1,4,5,6-тетрагидропиридина, составляющего аромат хлеба». Журнал органической химии. 36 (4): 609. Дои:10.1021 / jo00803a030.
- ^ Кхыонг-Хуу, Ф .; Херлем, Д. (1970). "Alcaloides steroidiques CX (1) - N-деметилированный фотохимик D'amines tertiaires steroidiques". Буквы Тетраэдра. 11 (42): 3649–52. Дои:10.1016 / S0040-4039 (01) 98552-1. PMID 5470892.
- ^ Gonikberg, E.M .; Ле Нобль, В. Дж. (1995). «Выбор лица в реакциях производных 5,7-диазаадамантан-2-она: взаимное влияние удаленных заместителей». Журнал органической химии. 60 (24): 7751. Дои:10.1021 / jo00129a014.
- ^ Рок Ли, Й .; Kim, B.S .; Иль Квеон, Х. (2000). «Эффективный синтез дигидрофурохинолинонов и фурохинолинонов с помощью серебра (I) / целита, стимулированного окислительным циклоприсоединением». Тетраэдр. 56 (24): 3867. Дои:10.1016 / S0040-4020 (00) 00307-0.
- ^ Митчелл, Ян С .; Паттенден, Джеральд; Стоунхаус, Джеффри П. (2002). «Краткий энантиоселективный общий синтез ризоксина D». Tetrahedron Lett. 43 (3): 493–497. Дои:10.1016 / S0040-4039 (01) 02154-2.
- ^ Ленц, Г. Р. (1972). «Реакции фрагментации, катализируемые реактивом Фетизона (карбонат серебра на целите)». Журнал химического общества, химические коммуникации (8): 468. Дои:10.1039 / C39720000468.
- ^ Фетизон, М .; Гольфье, М .; Montaufier, M.T .; Ренс, Дж. (1975). «Перегруппировки галогидринов в присутствии дикарбоната углерода на основе целита-II». Тетраэдр. 31 (8): 987. Дои:10.1016/0040-4020(75)80114-1.
- ^ Thuan, M. S. L. T .; Майтте, М. П. (1975). «Селективное окисление α-диолов арил-этиленовых кислот и α-цетолов». Буквы Тетраэдра. 16 (25): 2027. Дои:10.1016 / S0040-4039 (00) 75284-1.
- ^ Туан, С.-Л.-Т. (1971). Акад. Sc. Париж. 272: 233. Отсутствует или пусто
| название =(помощь) - ^ Heathcock, C.H .; Стаффорд, Дж. А .; Кларк, Д. Л. (1992). «Алкалоиды дафнифиллума. 14. Полный синтез (±) -букиттингина». Журнал органической химии. 57 (9): 2575. Дои:10.1021 / jo00035a011.
- ^ Моргенли, Свейн; Леандер, Курт; Люнинг, Бьёрн; Фахреус, Гёста; Юнггрен, Ганс; Эренберг, Л. (1971). «Окисление производных углеводов карбонатом серебра на целите. Окисление некоторых метиловых эфиров альдозы». Acta Chem. Сканд. 25: 1154–1155. Дои:10.3891 / acta.chem.scand.25-1154.
- ^ Моргенли, Свейн; Лехто, Аннели; Симов, Д .; Эйе, Х. А .; Свенссон, Зигфрид (1972). «Окисление производных углеводов карбонатом серебра на целите. III. Образование тетрозов из D-ксилозы и L-арабинозы». Acta Chem. Сканд. 26: 1709–1710. Дои:10.3891 / acta.chem.scand.26-1709.
- ^ Моргенли, Свейн; Свенссон, Зигфрид; Sæthre, Leif J .; Enzell, Curt R .; Свенссон, Зигфрид (1972). «Окисление производных углеводов карбонатом серебра на целите. IV. Окисление L-сорбозы, альтернативный синтез L-треозы». Acta Chem. Сканд. 26: 2146–2147. Дои:10.3891 / acta.chem.scand.26-2146.