WikiDer > Гексафторфосфат
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Гексафторфосфат | |||
| Систематическое название ИЮПАК | |||
| Идентификаторы | |||
3D модель (JSmol) | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.111.656 | ||
| 2704 | |||
PubChem CID | |||
| |||
| |||
| Характеристики | |||
| [ПФ6]− | |||
| Молярная масса | 144,964 181 г моль−1 | ||
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
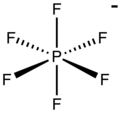
Гексафторфосфат является анион с химической формулой ПФ−
6. Это восьмигранный разновидность. Не придает окраске его солям. ПФ−
6 является изоэлектронный с гексафторид серы, SF6, а гексафторсиликат дианион SiF2−
6, и фтороантимонат SbF−
6. Быть плохо нуклеофильный, гексафторфосфат классифицируется как некоординирующий анион.[2][3]
Синтез
Гексафторфосфатные соли можно получить реакцией пентахлорид фосфора и галогенид щелочи или аммония в растворе плавиковая кислота:[4]
- PCl5 + MCl + 6 HF → MPF6 + 6 HCl
Гексафторфосфорная кислота может быть получен прямой реакцией фтороводород с пентафторид фосфора.[5] Это сильный Кислота Бренстеда что обычно генерируется на месте непосредственно перед его использованием.
- ПФ5 + ВЧ → ФВЧ6
Эти реакции требуют специального оборудования для безопасного устранения опасностей, связанных с плавиковой кислотой и фтористым водородом.
Количественный анализ
Несколько методов количественный анализ для гексафторфосфат-иона. Тетрафениларсония хлорид, [(C6ЧАС5)4Как] Cl, использовался как для титриметрический[6] и гравиметрический[7] количественное определение гексафторфосфата. Оба этих определения зависят от образования гексафторфосфата тетрафениларсония:
- [(C6ЧАС5)4В качестве]+ + ПФ−
6 → [(C6ЧАС5)4As] PF6
Гексафторфосфат также можно определить спектрофотометрически с ферроин.[8]
Реакции
В основных условиях гидролиз происходит очень медленно.[9] Кислотно-катализируемый гидролиз к фосфат ion также медленный.[10] Тем не менее, гексафторфосфат склонен к разложению с выделением фтороводорода в ионные жидкости.[11]
Металлоорганический и неорганический синтез
Гексафторфосфат - обычное противодействие катионный металлические комплексы. Это один из трех широко используемых некоординирующих анионов: гексафторфосфат, тетрафторборат BF−
4, и перхлорат ClO−
4. Из них ион гексафторфосфата имеет наименьшую координирующую способность.[12]
Гексафторфосфатные соли можно получить реакциями гексафторфосфат серебра с галогенидными солями. Осаждение нерастворимого галогенида серебра помогает довести эту реакцию до завершения. Поскольку соли гексафторфосфата часто нерастворимы в воде, но растворимы в полярных органических растворителях, даже добавление гексафторфосфат аммония (NH4ПФ6) к водным растворам многих органических и неорганических солей дает твердые осадки гексафторфосфатных солей. Одним из примеров является синтез соли родоцения:[13] Общее уравнение преобразования:
- RhCl3·ИксЧАС2O + 2 С5ЧАС6 + NH4ПФ6 → [(η5-C5ЧАС5)2Rh] PF6 + 2 HCl + NH4Cl + Икс ЧАС2О
Тетракис (ацетонитрил) гексафторфосфат меди (I) производится добавлением гексафторфосфорной кислоты к суспензии оксид меди (I) в ацетонитриле:[14]
- Cu2O + 2 HPF6 + 8 кан.3CN → 2 [Cu (CH3CN)4]ПФ6 + H2О
Гидролиз гексафторфосфатных комплексов
Хотя гексафторфосфат-ион обычно инертен и, следовательно, подходит противоион, это сольволиз могут быть вызваны высокоэлектрофильными металлическими центрами. Например, трис (растворитель) родий сложный [(η5-C5Мне5) Rh (Me2CO)3](ПФ6)2 подвергается сольволизу при нагревании в ацетон, образуя дифторфосфат-мостовой комплекс [(η5-C5Мне5) Rh (μ-OPF2O)3Rh (η5-C5Мне5)]ПФ6.[15][16]
Приложения
Практическое использование иона гексафторфосфата обычно использует одно или несколько из следующих свойств: некоординирующий анион; что гексафторфосфатные соединения обычно растворимы в органических растворителях, в частности полярный они, но имеют низкую растворимость в водный раствор; или что он обладает высокой степенью стабильности, включая устойчивость как к кислотным, так и к основным гидролиз.
Вторичные батареи
Основное коммерческое использование гексафторфосфата - его литиевая соль, гексафторфосфат лития. Эта соль в сочетании с диметилкарбонат, является обычным электролитом в промышленных вторичные батареи Такие как литий-ионные элементы. В этом приложении используется высокая растворимость гексафторфосфатных солей в органических растворителях и устойчивость этих солей к восстановлению катодом из щелочного металла.[17] Поскольку ионы лития в этих батареях обычно присутствуют в виде координационные комплексы в электролите,[18] некоординирующая природа иона гексафторфосфата также является полезным свойством для этих применений.
Ионные жидкости
Ионные жидкости комнатной температуры, такие как 1-бутил-3-метилимидазолий гексафторфосфат (обычно сокращенно bmimPF6) были подготовлены.[19] Преимущество анионного обмена в пользу некоординирующего аниона состоит в том, что получаемая ионная жидкость имеет гораздо большую термическую стабильность. Хлорид 1-бутил-3-метилимидазолия разлагается до N-метилимидазол и 1-хлорбутан или чтобы N-бутилимидазол и хлорметан. Для bmimPF такие разложения невозможны.6. Однако термическое разложение гексафторфосфатных ионных жидкостей с образованием фтороводород газ известны.[11]
Рекомендации
- ^ а б «Гексафторфосфат (1-) (CHEBI: 30201)». Химические объекты, представляющие биологический интерес (ChEBI). Великобритания: Европейский институт биоинформатики.
- ^ Дэвис, Дж. А. (1996). Синтетическая координационная химия: принципы и практика. World Scientific. п. 165. ISBN 981-02-2084-7.
- ^ Константа, S .; Лакур, Дж. (2005). Ж.-П. Майорал (ред.). Новые тенденции в химии гексакоординированного фосфора. Новые аспекты химии фосфора. 5. Springer. п. 3. ISBN 3-540-22498-X.
- ^ Войски, М. М. (1950). «Гексафторфосфаты натрия, аммония и калия». Неорг. Synth. 3: 111–117. Дои:10.1002 / 9780470132340.ch29.
- ^ Молнар, А .; Сурья Пракаш, Г. К .; Соммер, Дж. (2009). Суперкислотная химия (2-е изд.). Wiley-Interscience. п. 44. ISBN 0-471-59668-X.
- ^ Affsprung, H.E .; Арчер, В. С. (1963). «Определение гексафторфосфата амперометрическим титрованием с хлоридом тетрафениларсония». Анальный. Chem. 35 (8): 976–978. Дои:10.1021 / ac60201a017.
- ^ Affsprung, H.E .; Арчер, В. С. (1963). «Гравиметрическое определение гексафторфосфата как гексафторфосфата тетрафениларсония». Анальный. Chem. 35 (12): 1912–1913. Дои:10.1021 / ac60205a036.
- ^ Арчер, В. С .; Дулиттл, Ф. Г. (1967). «Спектрофотометрическое определение гексафторфосфата с ферроином». Анальный. Chem. 39 (3): 371–373. Дои:10.1021 / ac60247a035.
- ^ Ryss, I.G .; Тульчинский, В. Б. (1964). «Кинетика Гидролиза Иона Гексафторофосфата» ПФ−
6". Ж. Неорг. Хим. 9 (4): 836–840. - ^ Gebala, A.E .; Джонс, М. М. (1969). «Катализируемый кислотой гидролиз гексафторфосфата». J. Inorg. Nucl. Chem. 31 (3): 771–776. Дои:10.1016/0022-1902(69)80024-2.
- ^ а б Дайсон, П. Дж. (2005). Гельдбах, Т. Дж. (Ред.). Катализируемые металлами реакции в ионных жидкостях. Катализ металлическими комплексами. 29. Springer Science & Business. п. 27. ISBN 1-4020-3914-X.
- ^ Mayfield, H.G .; Бык, У. Э. (1971). «Координационные тенденции гексафторфосфат-иона». J. Chem. Soc. А (14): 2279–2281. Дои:10.1039 / J19710002279.
- ^ Baghurst, D. R .; Мингос, Д. М. П.; Watson, M. J .; Уотсон, Майкл Дж. (1989). «Применение микроволновых эффектов нагрева диэлектрических потерь для быстрого и удобного синтеза металлоорганических соединений». J. Organomet. Chem. 368 (3): C43 – C45. Дои:10.1016 / 0022-328X (89) 85418-X.
- ^ Кубас, Г. Дж. (1979). «Тетракис (ацетонитирил) гексафторофосфат меди (I)». Неорг. Synth. 19: 90–91. Дои:10.1002 / 9780470132593.ch15.
- ^ Томпсон, С. Дж .; Bailey, P.M .; Белый, C .; Питер Мейтлис (1976). «Сольволиз гексафторфосфат-иона и структура [трис (μ-дифторфосфат) бис (пента-метилциклопентадиенилродий)] гексафторфосфата». Энгью. Chem. Int. Эд. 15 (8): 490–491. Дои:10.1002 / anie.197604901.
- ^ Белый, C .; Томпсон, С. Дж .; Питер Мейтлис (1977). «Пентаметилциклопентадиенил-родиевые и -иридиевые комплексы XIV. Сольволиз координированных форм растворителя ацетона до трис (μ-дифторфосфат) бис [η5-пентаметилциклопентадиенилродий (III)] гексафторфосфат, к η5- (2,4-диметил-1-оксапента-1,3-диенил) (пентаметилциклопентадиенил) иридиевый катион, или к η5- (2-гидрокси-4-метилпентадиенил) (η5-пентаметилциклопентадиенил) иридиевый катион ». Журнал металлоорганической химии. 134 (3): 319–325. Дои:10.1016 / S0022-328X (00) 93278-9.
- ^ Гуденаф, J. B .; Ким, Ю. (2010). «Проблемы литиевых аккумуляторных батарей». Chem. Mater. 22 (3): 587–603. Дои:10,1021 / см901452z.
- ^ «Паспорт безопасности материалов: литий-ионные батареи National Power Corp.» (PDF). tek.com. Tektronix Inc. 7 мая 2004 г. Архивировано с оригинал (PDF) 26 июня 2011 г.. Получено 11 июн 2010.
- ^ Gordon, C.M .; Джон Д. Холбри; Алан Р. Кеннеди; Кеннет Р. Седдон (1998). «Ионные жидкие кристаллы: гексафторфосфатные соли». Журнал химии материалов. 8 (12): 2627–2636. Дои:10.1039 / a806169f.