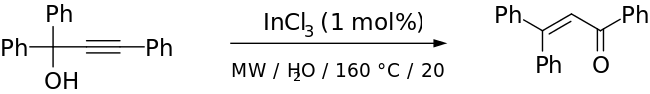WikiDer > Перегруппировка Мейера – Шустера
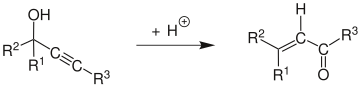
В Перегруппировка Мейера – Шустера это химическая реакция описывается как кислота-катализированный перестановка среднего и высшего пропаргиловые спирты к α, β-ненасыщенным кетоны если алкиновая группа является внутренней и α, β-ненасыщенной альдегиды если алкиновая группа является терминальной.[1] Обзоры были опубликованы Сваминатаном и Нараяном,[2] Вартанян и Банбанян,[3] и Энгель и Дадли,[4] последний из которых описывает способы стимулирования перегруппировки Мейера-Шустера по сравнению с другими реакциями, доступными для пропаргиловых спиртов.
При катализе основанием реакция называется Реакция Фаворского.
Механизм
В механизм реакции[5] начинается с протонирования спирта, который уходит в E1 реакция сформировать аллен от алкин. Атака молекулы воды на карбокатион и за депротонированием следует таутомеризация дать α, β-ненасыщенное карбонильное соединение.
Edens и другие. исследовали механизм реакции.[6] Они обнаружили, что он характеризуется тремя основными этапами: (1) быстрое протонирование кислорода, (2) медленное, этап определения ставки включая 1,3-смена протонированной гидроксильной группы и (3) кето-енольная таутомерия с последующим быстрым депротонированием.
Изучая лимитирующую стадию реакции Мейера-Шустера, Андрес и другие. показали, что движущей силой реакции является необратимое образование непредельных карбонильных соединений через ионы карбония.[7] Они также обнаружили, что реакции способствует растворитель. Это было дополнительно расследовано Тапиа. и другие. кто показал каркас для растворителя стабилизирует переходное состояние.[8]
Перестановка рупий
Реакция третичных спиртов, содержащих α-ацетиленовый группа не производит ожидаемых альдегидов, а скорее α, β-ненасыщенные метил кетоны через Enyne средний.[9][10] Эта альтернативная реакция называется Реакция рупа, и конкурирует с перегруппировкой Мейера – Шустера в случае третичных спиртов.
Использование катализаторов
Хотя в традиционной перегруппировке Мейера-Шустера используются жесткие условия с сильной кислотой в качестве катализатора, это создает конкуренцию реакции Рупе, если спирт является третичным.[2] Более мягкие условия успешно использовались с переходный металлна основе и Кислота Льюиса катализаторы (например, Ru-[11] и на основе Ag[12] катализаторы). Cadierno и другие. сообщить об использовании микроволновая печь-излучение с InCl в качестве катализатора для получения отличных выходов с коротким временем реакции и замечательным стереоселективность.[13] Пример из их статьи приведен ниже:
Приложения
Перегруппировка Мейера-Шустера использовалась во множестве приложений, начиная с превращения ω-алкинил-ω-карбинола лактамы в енамиды с использованием каталитического PTSA[14] к синтезу α, β-ненасыщенных тиоэфиры из γ-серозамещенных пропаргиловых спиртов[15] с перегруппировкой 3-алкинил-3-гидроксил-1ЧАС-изоиндолы в слабокислой среде с образованием α, β-ненасыщенных карбонильных соединений.[16] Однако одним из самых интересных приложений является синтез части паклитаксел в диастереомерно-селективный способ, ведущий только к E-алкен.[17]
Показанный выше этап имел выход 70% (91%, когда побочный продукт был преобразован в продукт Мейера-Шустера на другом этапе). Авторы использовали перегруппировку Мейера-Шустера, потому что они хотели превратить затрудненный кетон в алкен, не разрушая остальную часть своей молекулы.
Рекомендации
- ^ Meyer, K. H .; Шустер, К. Бер. 1922, 55, 819.(Дои:10.1002 / cber.19220550403)
- ^ а б Swaminathan, S .; Нараян, К. В. "Перестановки Рупе и Мейера-Шустера" Chem. Ред. 1971, 71, 429–438. (Рассмотрение)
- ^ Вартанян, С.А .; Банбанян, С.О. Русь. Chem. Ред. 1967, 36, 670. (Рассмотрение)
- ^ Engel, D.A .; Дадли, Г. Органическая и биомолекулярная химия 2009, 7, 4149–4158. (Рассмотрение)
- ^ Ли, Дж. Дж. В Перегруппировка Мейера-Шустера; Назовите реакции: сборник подробных механизмов реакции; Springer: Берлин, 2006 г .; С. 380–381. (Дои:10.1007/978-3-642-01053-8_159)
- ^ Edens, M .; Boerner, D .; Chase, C. R .; Nass, D .; Скьявелли, М.Д. J. Org. Chem. 1977, 42, 3403–3408. (Дои:10.1021 / jo00441a017)
- ^ Andres, J .; Cardenas, R .; Силла, Э .; Тапиа, О. Варенье. Chem. Soc. 1988, 110, 666–674. (Дои:10.1021 / ja00211a002)
- ^ Tapia, O .; Lluch, J.M .; Cardena, R .; Андрес, Дж. Варенье. Chem. Soc. 1989, 111, 829–835. (Дои:10.1021 / ja00185a007)
- ^ Rupe, H .; Камбли, Э. Helv. Чим. Acta 1926, 9, 672. (Дои:10.1002 / hlca.19260090185)
- ^ Ли, Дж. Дж. В Перестановка рупий; Назовите реакции: сборник подробных механизмов реакции; Springer: Берлин, 2006 г .; стр. 513–514. (Дои:10.1007/978-3-642-01053-8_224)
- ^ Cadierno, V .; Вязание крючком, П .; Химено, Дж. Synlett 2008, 1105–1124. (Дои:10.1055 / с-2008-1072593)
- ^ Sugawara, Y .; Yamada, W .; Yoshida, S .; Ikeno, T .; Ямада, Т. Варенье. Chem. Soc. 2007, 129, 12902-12903. (Дои:10.1021 / ja074350y)
- ^ Cadierno, V .; Francos, J .; Химено, Дж. Tetrahedron Lett. 2009, 50, 4773–4776.(Дои:10.1016 / j.tetlet.2009.06.040)
- ^ Чихаб-Эддин, А .; Daich, A .; Jilale, A .; Декруа, Б. J. Heterocycl. Chem. 2000, 37, 1543–1548.(Дои:10.1002 / jhet.5570370622)
- ^ Yoshimatsu, M .; Naito, M .; Кавахигаши, М .; Shimizu, H .; Катаока, Т. J. Org. Chem. 1995, 60, 4798–4802.(Дои:10.1021 / jo00120a024)
- ^ Omar, E.A .; Вт, Ц .; Wigal, C.T .; Браун, Л. J. Heterocycl. Chem. 1992, 29, 947–951.(Дои:10.1002 / jhet.5570290445)
- ^ Crich, D .; Натараджан, С .; Крич, Дж. З. Тетраэдр 1997, 53, 7139–7158.(Дои:10.1016 / S0040-4020 (97) 00411-0)