WikiDer > Сигматропная реакция
А сигматропная реакция в органическая химия это перициклическая реакция где чистый результат - один σ-связь заменяется на другую σ-связь в некатализированном внутримолекулярная реакция.[1] Название сигматропный это результат компаундирование давно установившегося сигма-обозначения от одиночного углерод–Углеродные связи и греческое слово тропос, что означает очередь. В этом типе реакция перегруппировки, а заместитель перемещается из одной части π-скрепленный системы в другую часть во внутримолекулярной реакции с одновременной перегруппировкой π-системы.[2] Истинные сигматропные реакции обычно некатализируются, хотя Кислота Льюиса катализ возможно. В сигматропных реакциях часто используются катализаторы на основе переходных металлов, которые образуют промежуточные продукты в аналогичных реакциях. Наиболее известными из сигматропных перегруппировок являются [3,3] Справиться перестановкой, Перестановка Клейзена, Перестановка Кэрролла, а Синтез индола по Фишеру.
Обзор сигматропных сдвигов
Номенклатура сигматропного сдвига Вудворда – Хоффмана
Сигматропные перестройки кратко описываются порядок срок [i, j], который определяется как миграция σ-связи, смежной с одной или несколькими системами π, в новое положение (i-1) и (j-1) атомы удалены из исходного местоположения σ-связи.[3] Когда сумма i и j является четным числом, это указывает на участие нейтральной цепи, состоящей из атомов углерода. Нечетное число указывает на участие заряженного атома углерода или неподеленной пары гетероатома, заменяющей двойную связь CC. Таким образом, [1,5] и [3,3] сдвиги становятся [1,4] и [2,3] сдвигается с гетероатомами, сохраняя при этом соображения симметрии. Водороды для ясности опущены в третьем примере.
Удобный способ определения порядка данной сигматропной перегруппировки состоит в том, чтобы пронумеровать атомы разорванной связи как атом 1, а затем подсчитать атомы в каждом направлении от разорванной связи до атомов, которые образуют новую σ-связь в продукт, пронумерованный последовательно. Затем числа, соответствующие атомам, образующим новую связь, разделяются запятой и помещаются в скобки для создания дескриптора порядка сигматропной реакции.[4]
В случае миграции атома водорода можно применить аналогичный метод. При определении порядка сигматропного сдвига, включающего миграцию атома водорода, очень важно подсчитывать по всем атомам, участвующим в реакции, а не только по ближайшим атомам. Например, следующая миграция атома водорода имеет порядок [1,5] и достигается путем счета против часовой стрелки по системе π, а не путем обозначения порядка [1,3] через кольцо CH2 группа, которая будет ошибочно считаться по часовой стрелке.
В общем случае можно просто изобразить переходное состояние реакции. Для сигматропной реакции переходное состояние будет состоять из двух фрагментов, соединенных вместе образующими и разрушающими σ-связями. Сигматропная реакция называется [я,j] -сигматропная перегруппировка (я ≤ j), если эти два фрагмента состоят из я и j атомы. Это проиллюстрировано ниже, соответствующие фрагменты показаны цветом.
Супрафациальные и антарафациальные сдвиги
В принципе, все сигматропные сдвиги могут происходить либо с сохранением, либо с инверсией геометрии мигрирующей группы, в зависимости от того, были ли исходные связующая доля мигрирующего атома или другой его доли используется для образования новой связи.[4]
В случаях стереохимический При удерживании мигрирующая группа переводится без вращения в положение связывания, в то время как в случае стереохимической инверсии мигрирующая группа как вращается, так и перемещается, чтобы достичь своей связанной конформации.
Однако другой эффект стереохимического перехода, в равной степени способный производить продукты инверсии или удерживания, заключается в том, остается ли мигрирующая группа на исходной поверхности π-системы после повторного связывания или вместо этого переносится на противоположную сторону π-системы. Если мигрирующая группа остается на той же стороне π-системы, сдвиг известен как надфасциальный, а если мигрирующая группа переходит на противоположную поверхность, это называется антарафациальным сдвигом,[3] которые невозможны при преобразованиях, происходящих в кольцах малых и средних размеров.
Классы сигматропных перегруппировок
[1,3] смены
Термогидридные сдвиги
В тепловой [1,3] гидрид сдвиг, гидрид перемещает три атома. В Правила Вудворда – Хоффмана диктуют, что это будет продолжаться в антарафациальном сдвиге. Хотя такой сдвиг допустим по симметрии, Мебиус топология требуется в переходное состояние запрещает такой сдвиг, потому что он геометрически невозможен, что объясняет тот факт, что Enols не изомеризовать без кислота или же основание катализатор.[4]
Термические алкильные сдвиги
Термические алкильные [1,3] сдвиги, аналогичные [1,3] гидридным сдвигам, должны протекать антарафациально. Здесь геометрия переходного состояния запрещена, но алкильная группаиз-за природы своих орбиталей может инвертировать свою геометрию, образовывать новую связь с задней долей своего sp3 орбитальный, и, следовательно, происходит через надфасциальный сдвиг. Эти реакции все еще не характерны для соединения с открытой цепью из-за высокоупорядоченной природы переходного состояния, которое легче достигается в циклический молекулы.[4]
Фотохимические [1,3] сдвиги
Фотохимические [1,3] сдвиги должны происходить через супрафациальные сдвиги; однако большинство из них не согласованы, потому что они проходят через триплетное состояние (т.е. иметь бирадикал механизм, к которому правила Вудворда-Хоффмана не применяются).[4]
[1,5] смены
Сдвиг [1,5] включает сдвиг на 1 заместитель (гидрид, алкил или арил) вниз на 5 атомов π-системы. Было показано, что водород сдвигается как в циклических соединениях, так и в соединениях с открытой цепью при температурах не ниже 200 ˚C.[4] Предполагается, что эти реакции будут протекать надфасциально, через переходное состояние топологии Хюккеля.
Для фотооблучения потребуется антарафациальный сдвиг водорода. Хотя и редко, есть примеры, где предпочтение отдается антарафациальным сдвигам:[5]
В отличие от водородных [1,5] сдвигов, в соединениях с открытой цепью никогда не наблюдались [1,5] алкильные сдвиги.[4] Однако было проведено несколько исследований для определения ставка предпочтения по [1,5] алкильным сдвигам в циклических системах: карбонил и карбоксил> гидрид> фенил и винил>> алкил.[6][7]
Алкильные группы очень плохо претерпевают [1,5] сдвиги, обычно требующие высоких температур, однако для циклогексадиен, температура для алкильных сдвигов не намного выше, чем для карбонилов, лучшей мигрирующей группы. Исследование показало, что это связано с тем, что алкильные сдвиги в циклогексадиенах происходят по другому механизму. Сначала кольцо открывается, затем происходит сдвиг [1,7], а затем кольцо восстанавливается. электроциклически:[8]
Тот же самый механистический процесс показан ниже, без окончательной электроциклической реакции замыкания кольца, при взаимном превращении люмистерола в витамин D.2.
[1,7] смены
[1,7], согласно правилам Вудворда-Хоффмана, сигматропные сдвиги протекают антарафациально, через переходное состояние топологии Мебиуса. Антарафациальный [1,7] сдвиг наблюдается при превращении люмистерол к Витамин Д2, где после электроциклического раскрытия кольца до превитамина D2, а метил водородные сдвиги.[9]
Бициклические нонатриены также претерпевают [1,7] сдвиги в так называемом перестановка ходьбы,[10] что является сдвигом двухвалентный группа в составе трехчленного кольца в бициклическая молекула.
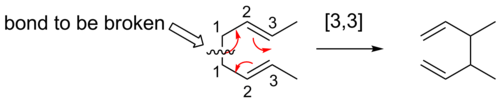
[3,3] смены
[3,3] сигматропные сдвиги хорошо изучены сигматропными перестройками. Правила Вудворда – Хоффмана предсказывают, что эти шесть-электрон реакции будут протекать надфасциально, через переходное состояние топологии Хюккеля.
Перестановка Клейзена
Открыт в 1912 г. Райнер Людвиг Клайзен, перегруппировка Клейзена является первым зарегистрированным примером [3,3] -сигматропной перегруппировки.[11][12][13] Эта перестановка полезна углерод-углерод связь-формирование реакция. Примером перегруппировки Клейзена является перегруппировка [3,3] аллил винил эфир, который при нагревании дает γ, δ-ненасыщенный карбонил. Образование карбонильной группы делает эту реакцию, в отличие от других сигматропных перегруппировок, необратимой.
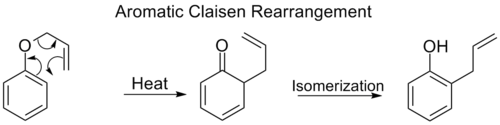
Ароматическая перегруппировка Клейзена
В перегруппировка орто-Клейзена включает [3,3] сдвиг аллилфениловый эфир к промежуточному звену, который быстро таутомеризуется в орто-замещенный фенол.
Когда оба орто позиции по бензол кольцо заблокировано, произойдет вторая [3,3] перегруппировка. Этот пара-Клайзенская перегруппировка заканчивается таутомеризацией до тризамещенного фенола.
Справиться перестановкой
В Справиться перестановкой широко изученный органическая реакция с участием [3,3] сигматропной перегруппировки 1,5-диенов.[14][15][16] Он был разработан Артур Коуп. Например, 3,4-диметил-1,5-гексадиен, нагретый до 300 ° C, дает 2,6-октадиен.
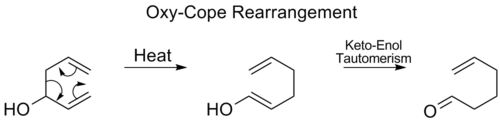
Окси-копе перегруппировка
в окси-копе перегруппировка, а гидроксил группа добавляется в C3, образуя энал или енон после кето-енольная таутомерия промежуточного енола:[17]
Перестановка Кэрролла
В Перестановка Кэрролла это реакция перегруппировки в органическая химия и включает в себя преобразование β-кето аллил сложный эфир в α-аллил-β-кетокарбоновую кислоту.[18] Эта органическая реакция сопровождается декарбоксилирование и конечный продукт представляет собой γ, δ-аллилкетон. Перестановка Кэрролла - это адаптация Перестановка Клейзена и эффективно декарбоксилированное аллилирование.
Синтез индола по Фишеру
В Синтез индола по Фишеру это химическая реакция который производит ароматный гетероцикл индол из (заменено) фенилгидразин и альдегид или же кетон под кислый условия.[19][20] Реакция была открыта в 1883 г. Герман Эмиль Фишер.
Выбор кислотного катализатора очень важен. Кислоты Бренстеда Такие как HCl, ЧАС2ТАК4, полифосфорная кислота и п-толуолсульфоновая кислота были успешно использованы. Кислоты Льюиса Такие как трифторид бора, хлорид цинка, хлорид железа (III), и хлорид алюминия также являются полезными катализаторами.
Опубликовано несколько обзоров.[21][22][23]
[5,5] Смены
Подобно [3,3] сдвигам, правила Вудворда-Хоффмана предсказывают, что [5,5] сигматропные сдвиги будут происходить надфасциально, в переходном состоянии топологии Хюккеля. Эти реакции встречаются реже, чем [3,3] сигматропные сдвиги, но это в основном функция того факта, что молекулы, которые могут претерпевать [5,5] сдвиги, реже, чем молекулы, которые могут претерпевать [3,3] сдвиги.[4]
[2,3] смены
Пример 2,3-сигматропная перегруппировка это 2,3-перегруппировка Виттига:
Перестановки ходьбы
Миграция двухвалентной группы, такой как О, S, N–R или C – R2, которое является частью трехчленного кольца в бициклической молекуле, обычно называют блуждающей перегруппировкой. Формально это можно охарактеризовать в соответствии с правилами Вудворда-Хофмана как сигматропический сдвиг (1, n).[24] Примером такой перегруппировки является сдвиг заместителей на тропилиденах (1,3,5-циклогептатриенах). При нагревании пи-система проходит через замыкание электроциклического кольца с образованием бицикло [4,1,0] гептадиена (норкарадиена). После этого следует [1,5] алкильный сдвиг и электроциклическое раскрытие кольца.
Ожидается, что после сдвига [1,5] прогулочная перегруппировка норкарадиенов будет протекать надфасциально с сохранением стереохимии. Однако экспериментальные наблюдения показывают, что 1,5-сдвиги норкарадиенов протекают антарафациально.[25] Теоретические расчеты обнаружил, что сдвиг [1,5] был бирадикал процесс, но без участия бирадикалов минимумы на поверхность потенциальной энергии.[26]
Смотрите также
Рекомендации
- ^ Кэри, Ф.А. и Р.Дж. Сундберг. Продвинутая органическая химия Часть А ISBN 0-306-41198-9
- ^ «Сигматропные перестройки». Химия LibreTexts.
- ^ а б Вудворд, Р.; Хоффманн, Р. Сохранение орбитальной симметрии. Verlag Chemie Academic Press. 2004 г. ISBN 0-89573-109-6.
- ^ а б c d е ж грамм час Миллер, Бернард. Продвинутая органическая химия. 2-е изд. Верхняя река Сэддл: Pearson Prentice Hall. 2004 г. ISBN 0-13-065588-0
- ^ Kiefer, E.F .; Тана, C.H. Варенье. Chem. Soc., 1969, 91, 4478. Дои:10.1021 / ja01044a027
- ^ Филдс, Д.Дж .; Jones, D.W .; Книн, Г. Химические коммуникации 1976. 873 – 874. Дои:10.1039 / C39760000873
- ^ Miller, L.L .; Greisinger, R .; Бойер, Р.Ф. Варенье. Chem. Soc. 1969. 91. 1578. Дои:10.1021 / ja01034a076
- ^ Schiess, P .; Динкель, Р. Буквы Тетраэдра, 1975, 16, 29, 2503. Дои:10.1016/0040-4039(75)80050-5
- ^ Кэри, Фрэнсис А.; Сандберг, Ричард Дж (2000). Продвинутая органическая химия. Часть A: Структура и механизмы (4-е изд.). Нью-Йорк: Kluwer Academic / Plenum. п.625. ISBN 0-306-46242-7.
- ^ Клаернер, Ф. Агнью. Chem. Intl. Эд. Англ., 1972, 11, 832.Дои:10.1002 / anie.197208321
- ^ Клайзен, Л.; Бер. 1912, 45, 3157. Дои:10.1002 / cber.19120450348
- ^ Claisen, L .; Tietze, E .; Chemische Berichte 1925, 58, 275. Дои:10.1002 / cber.19250580207
- ^ Claisen, L .; Tietze, E .; Chemische Berichte 1926, 59, 2344. Дои:10.1002 / cber.19260590927
- ^ Коуп, А.С.; и другие. Варенье. Chem. Soc. 1940, 62, 441. Дои:10.1021 / ja01859a055
- ^ Hoffmann, R .; Stohrer, W. D. Варенье. Chem. Soc. 1971, 93, 25, 6941–6948. Дои:10.1021 / ja00754a042
- ^ Dupuis, M .; Мюррей, С .; Дэвидсон, Э. Р. Дж. Ам. Chem. Soc. 1991, 113, 26, 9756–9759. Дои:10.1021 / ja00026a007
- ^ Берсон, Джером А .; Джонс, Мейтленд. Варенье. Chem. Soc. 1964, 86, 22, 5019–5020. Дои:10.1021 / ja01076a067
- ^ Кэррол, М.Ф. Журнал химического общества 1940, 704–706. Дои:10.1039 / JR9400000704.
- ^ Fischer, E .; Журдан, Ф. Chemische Berichte 1883, 16, 2241.Дои:10.1002 / cber.188301602141
- ^ Fischer, E .; Он такой. Chemische Berichte 1884, 17, 559. Дои:10.1002 / cber.188401701155
- ^ van Orden, R. B .; Линдвелл, Х. Chem. Ред. 1942, 30, 69–96. Дои:10.1021 / cr60095a004
- ^ Робинсон, Б. Chem. Ред. 1963, 63, 373–401. Дои:10.1021 / cr60224a003
- ^ Робинсон, Б. Chem. Ред. 1969, 69, 227–250. Дои:10.1021 / cr60262a003
- ^ Дженсен, Ф. Варенье. Chem. Soc., 1989, 111, 13, 4643 – 4647. Дои:10.1021 / ja00195a018
- ^ Кларнер, Ф. Темы стереохимии, 1984, 15, 1–42. ISSN 0082-500X
- ^ Kless, A .; Nendel, M .; Wilsey, S .; Хоук, К. Варенье. Chem. Soc., 1999, 121, 4524. Дои:10.1021 / ja9840192






![[1,3] Алкильные сдвиги](http://upload.wikimedia.org/wikipedia/commons/thumb/e/e9/1%2C3alkylfixed.png/550px-1%2C3alkylfixed.png)
![[1,5] гидридный сдвиг в циклической системе](http://upload.wikimedia.org/wikipedia/commons/thumb/7/7f/1%2C5hydridecyclicfixed.png/300px-1%2C5hydridecyclicfixed.png)
![Антарафациальный [1,5] гидридный сдвиг](http://upload.wikimedia.org/wikipedia/commons/thumb/9/99/1%2C5hantarafacialfixed.png/600px-1%2C5hantarafacialfixed.png)








![[5,5] сдвиг фенилпентадиенилового эфира](http://upload.wikimedia.org/wikipedia/commons/thumb/2/25/5%2C5shiftfixeds.png/800px-5%2C5shiftfixeds.png)

