WikiDer > N, N-дициклогексилкарбодиимид - Википедия
 | |
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC N,N'-Дициклогексилметандиимин | |
| Другие имена Дициклогексилметандиимин N,N'-Дициклогексилкарбодиимид DCC, DCCD, DCCI | |
| Идентификаторы | |
3D модель (JSmol) | |
| 610662 | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| ECHA InfoCard | 100.007.914 |
| Номер ЕС |
|
| 51651 | |
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| Номер ООН | 2811 |
| |
| |
| Характеристики | |
| C13ЧАС22N2 | |
| Молярная масса | 206.333 г · моль−1 |
| Внешность | белый кристаллический порошок |
| Плотность | 1,325 г / см3, твердый |
| Температура плавления | 34 ° С (93 ° F, 307 К) |
| Точка кипения | 122 ° С (252 ° F, 395 К) (при 6 мм рт. Ст.) |
| не растворим | |
| Опасности | |
| Пиктограммы GHS |    |
| Сигнальное слово GHS | Опасность |
| H302, H311, H317, H318 | |
| P261, P264, P270, P272, P280, P301 + 312, P302 + 352, P305 + 351 + 338, P310, P312, P321, P322, P330, P333 + 313, P361, P363, P405, P501 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | 113 ° С (235 ° F, 386 К) |
| Родственные соединения | |
Связанный карбодиимиды | DIC,EDC |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
N,N′ -Дициклогексилкарбодиимид (DCC или же DCCD)[1] является органическое соединение с химической формулой (C6ЧАС11N)2C. Это воскообразное белое твердое вещество со сладким запахом. Его основное использование - соединение аминокислоты во время искусственного пептидный синтез. Низкая температура плавления этого материала позволяет плавить его, что упрощает обращение с ним. Хорошо растворяется в дихлорметан, тетрагидрофуран, ацетонитрил и диметилформамид, но не растворим в воды.
Структура и спектроскопия
Ядро C-N = C = N-C карбодиимидов (N = C = N) является линейным, поскольку связано со структурой аллен. Молекула идеализировала C2 симметрия.
Фрагмент N = C = N дает характерную ИК-спектроскопическую сигнатуру при 2117 см.−1.[2] В 15N ЯМР Спектр показывает характерный сдвиг азотной кислоты на 275 м.д. 13Спектр ЯМР 13С имеет пик примерно при 139 м.д. в слабом поле от ТМС.[3]
Подготовка
Из нескольких синтезов DCC, Pri-Bara и другие. использовать ацетат палладия, йод и кислород для соединения циклогексиламина и циклогексила изоцианид.[4] При использовании этого маршрута достигнута доходность до 67%:
- C6ЧАС11NC + C6ЧАС11NH2 + O2 → (C6ЧАС11N)2C + H2О
Тан и другие. сконденсировать два изоцианаты с использованием катализатора OP (MeNCH2CH2)3N с выходом 92%:[2]
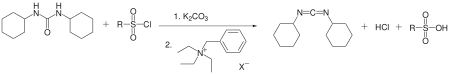
DCC также был подготовлен из дициклогексилмочевина используя катализатор межфазного переноса по Jaszay и другие. Дизамещенная мочевина, аренсульфонилхлорид и карбонат калия реагируют в толуоле в присутствии хлорида бензилтриэтиламмония с получением DCC с выходом 50%.[5]
Реакции
Образование амидов, пептидов и эфиров
DCC - это дегидратирующий агент для приготовления амиды, кетоны и нитрилы.[1] В этих реакциях DCC гидратируется с образованием дициклогексилмочевины (DCU), соединения, которое практически нерастворимо в большинстве органических растворителей и нерастворимо в воде. Таким образом, большая часть DCU легко удаляется фильтрацией, хотя последние следы трудно удалить из неполярных продуктов. DCC также можно использовать для инвертировать вторичные спирты. в Этерификация Стеглиха, спирты, включая даже некоторые третичные спирты, могут быть этерифицированы с использованием карбоновой кислоты в присутствии DCC и каталитического количества DMAP.[6]
В синтезе белка (например, Fmoc твердотельные синтезаторы), N-конец часто используется как место прикрепления, на котором аминокислота мономеры добавлены. Чтобы усилить электрофильность из карбоксилат группы, отрицательно заряженный кислород сначала должен быть «активирован» в лучшую уходящая группа. Для этого используется DCC. Отрицательно заряженный кислород будет действовать как нуклеофил, атакуя центральный углерод в DCC. DCC временно присоединяется к бывшей карбоксилатной группе, образуя высокоэлектрофильный промежуточный продукт, что делает нуклеофильная атака по концевой аминогруппе на растущем пептиде более эффективно.
Окисление Моффатта
В комбинации с диметилсульфоксид (ДМСО), DCC влияет на Окисление Пфицнера-Моффатта.[7] Эта процедура используется для окисления спирты к альдегиды и кетоны. В отличие от опосредованного металлом окисления, такой как Окисление Джонсаусловия реакции достаточно мягкие, чтобы избежать чрезмерного окисления альдегидов до карбоновых кислот. Обычно трем эквивалентам DCC и 0,5 эквивалента источника протонов в ДМСО дают возможность реагировать в течение ночи при комнатной температуре. Реакцию гасят кислотой.
Другие реакции
- Реакция кислоты с пероксидом водорода в присутствии DCC приводит к образованию пероксидной связи.
- Спирты также можно обезвоживать с помощью DCC. Эта реакция протекает, сначала получая промежуточное соединение O-ацилмочевины, которое затем гидрогенолизируют с получением соответствующего алкена:
- RCHOHCH2R '+ C6ЧАС11N)2С → RCH = CHR '+ (С6ЧАС11NH)2CO
- Вторичные спирты можно стереохимически инвертировать путем образования формилового эфира с последующим омыление. Вторичный спирт смешивают непосредственно с DCC, муравьиная кислота, и сильная база, такая как метоксид натрия.
Биологическое действие
DCC - классический ингибитор АТФ-синтаза.[8] DCC ингибирует АТФ-синтазу, связываясь с одним из c субъединиц и вызывающие стерические затруднения вращения FО субъединица.[9]
Безопасность
DCC - сильный аллерген и сенсибилизатор, часто вызывающий кожную сыпь.[1]
Смотрите также
Рекомендации
- ^ а б c Джеффри С. Альберт, Эндрю Д. Гамильтон, Эми К. Харт, Сяомин Фэн, Лили Линь, Чжэнь Ван (2017). «1,3-Дициклогексилкарбодиимид». EEROS: 1–9. Дои:10.1002 / 047084289X.rd146.pub3. ISBN 9780470842898.CS1 maint: использует параметр авторов (связь)
- ^ а б Tang, J .; Mohan, T .; Веркаде, Дж. Г. (1994). «Селективный и эффективный синтез пергидро-1,3,5-триазин-2,4,6-трионов и карбодиимидов из изоцианатов с использованием ZP (MeNCH2CH2)3Катализаторы N ». Журнал органической химии. 59 (17): 4931–4938. Дои:10.1021 / jo00096a041.
- ^ Явари, I .; Робертс, Дж. Д. (1978). «Спектроскопия ядерного магнитного резонанса азота-15. Карбодиимиды» (PDF). Журнал органической химии. 43 (25): 4689–4690. Дои:10.1021 / jo00419a001.
- ^ Pri-Bar, I .; Шварц, Дж. (1997). «Синтез N, N-диалкилкарбодиимида путем катализируемого палладием взаимодействия аминов с изонитрилами». Химические коммуникации. 1997 (4): 347–348. Дои:10.1039 / a606012i.
- ^ Jászay, Z. M .; Petneházy, I .; Töke, L .; Сажани, Б. (1987). «Получение карбодиимидов с использованием межфазного катализа». Синтез. 1987 (5): 520–523. Дои:10.1055 / с-1987-27992.
- ^ Neises, B .; Стеглич, В. (1985). «Этерификация карбоновых кислот дициклогексилкарбодиимидом / 4-диметиламинопиридином: трет-бутилэтилфумарат». Органический синтез. 63: 183. Дои:10.15227 / orgsyn.063.0183.
- ^ Джон Г. Моффатт (1967). «Холан-24-ал». Орг. Синтезатор. 47: 25. Дои:10.15227 / orgsyn.047.0025.
- ^ Hong S, Pedersen PL. (2008). «АТФ-синтаза и действие ингибиторов, используемых для изучения ее роли в здоровье человека, болезнях и других научных областях». Микробиол Мол Биол Рев. 72 (4): 590–641. Дои:10.1128 / MMBR.00016-08. ЧВК 2593570. PMID 19052322.CS1 maint: использует параметр авторов (связь)
- ^ Тоэй М., Нодзи Х. (2013). «Одномолекулярный анализ F0F1-АТФ-синтаза ингибируется N,N-дициклогексилкарбодиимид ". J Biol Chem. 288 (36): 25717–26. Дои:10.1074 / jbc.M113.482455. ЧВК 3764779. PMID 23893417.CS1 maint: использует параметр авторов (связь)
внешняя ссылка
- Прекрасную иллюстрацию этого механизма можно найти здесь: [1].