WikiDer > N-ацетилглутаминовая кислота
 | |
| Имена | |
|---|---|
| Название ИЮПАК 2-ацетамидопентандиовая кислота[1] | |
| Другие имена Ацетилглутаминовая кислота[нужна цитата] | |
| Идентификаторы | |
3D модель (JSmol) | |
| 3DMet | |
| Сокращения |
|
| 1727473 S | |
| ЧЭБИ | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.024.899 |
| Номер ЕС |
|
| КЕГГ | |
| MeSH | N-ацетилглутамат |
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| |
| |
| Характеристики | |
| C7ЧАС11NО5 | |
| Молярная масса | 189.167 г · моль−1 |
| Внешность | Белые кристаллы |
| Плотность | 1 г мл−1 |
| Температура плавления | От 191 до 194 ° C (от 376 до 381 ° F, от 464 до 467 K) |
| 36 г л−1 | |
| Опасности | |
| Смертельная доза или концентрация (LD, LC): | |
LD50 (средняя доза) | > 7 г кг−1 (оральный, крыса) |
| Родственные соединения | |
Родственные алкановые кислоты | |
Родственные соединения | |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
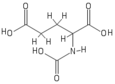
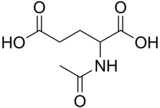
N-Ацетилглутаминовая кислота (также называемый N-ацетилглутамат, сокращенно НАГ, химическая формула C7ЧАС11Нет5)[2] биосинтезируется из глутамат и ацетилорнитин орнитинацетилтрансферазой и от глютаминовая кислота и ацетил-КоА ферментом N-ацетилглутаматсинтаза. Обратная реакция, гидролиз ацетильной группы, катализируется специфическим гидролаза. Это первое промежуточное соединение, участвующее в биосинтезе аргинин у прокариот и простых эукариот и регулятор в процессе, известном как цикл мочевины который превращает токсичный аммиак в мочевину, которая выводится из организма позвоночных.
Открытие
N-Ацетилглутаминовая кислота - внеклеточная метаболит изолированные от прокариот Ризобий trifolii, который был охарактеризован с использованием многих методов определения структуры, таких как протонный ядерный магнитный резонанс (1H ЯМР) спектроскопия, Инфракрасная спектроскопия с преобразованием Фурье, и газовая хроматография-масс-спектрометрия.
В Ризобий, внеклеточное накопление N-ацетилглутаминовая кислота из-за метаболизма с участием кивок фактор гены на симбиотический плазмида. Когда нод-факторы мутируют, меньше N-ацетилглутаминовая кислота.[3]
Биосинтез
Прокариоты и простые эукариоты
У прокариот и простых эукариот N-ацетилглутаминовая кислота может производиться N-ацетилглутаматсинтаза (NAGS) или орнитинацетилтрансфераза (OAT).
Синтез орнитинацетилтрансферазы (ОАТ)
ОАТ синтезирует N-ацетилглутаминовая кислота из глутамат и ацетилорнитин и является методом выбора для продуцирования прокариотами, способными синтезировать соединение орнитин.[4]
N-Синтез ацетилглутаматсинтазы (NAGS)
N-Ацетилглутаматсинтаза - это фермент, который восполняет N-ацетилглутаминовая кислота для дополнения любых N-ацетилглутаминовая кислота теряется клеткой через митоз или деградация. NAGS синтезирует N-ацетилглутаминовая кислота, катализируя присоединение ацетильной группы из ацетил-кофермент А к глутамат. У прокариот с нециклической продукцией орнитина NAGS является единственным методом N-синтез ацетилглутаминовой кислоты и ингибируется аргинином.[4] Считается, что ацетилирование глутамата предотвращает использование глутамата пролин биосинтез.[5]
Позвоночные
В отличие от прокариот, NAGS у млекопитающих усиливается аргинином вместе с протамины. Это подавляется N-ацетилглутаминовая кислота и ее аналоги (прочие N-ацетилированные соединения).[4]
Мозг также содержит N-ацетилглутаминовая кислота в следовых количествах, однако экспрессия NAGS не обнаружена. Это говорит о том, что N-ацетилглутаминовая кислота вырабатывается другим ферментом в мозге, который еще предстоит определить.[4]
Биологические роли
Позвоночные и млекопитающие
У позвонков и млекопитающих N-ацетилглутаминовая кислота представляет собой молекулу аллостерического активатора митохондрий. карбамилфосфатсинтетаза I (CPSI), который является первым ферментом в цикле мочевины.[6] Он запускает производство первого промежуточного продукта цикла мочевины, карбамилфосфат. CPSI неактивен, когда N-ацетилглутаминовая кислота отсутствует. В печени и тонком кишечнике, N-зависимый от ацетилглутаминовой кислоты CPSI производит цитруллин, второй промежуточный продукт в цикле мочевины. Распределение клеток печени N-ацетилглутаминовая кислота наиболее высока в митохондриях и составляет 56% от общего количества N- доступность ацетилглутаминовой кислоты, 24% в ядре, а остальные 20% в цитозоле. Аминоацилаза Я в клетках печени и почек разлагается N-ацетилглутаминовая кислота до глутамата и ацетата.[7] В отличие, N-ацетилглутаминовая кислота нет аллостерический кофактор карбамилфосфатсинтетазы, обнаруженный в цитоплазме, который участвует в пиримидин синтез.[8]
N-концентрация ацетилглутаминовой кислоты увеличивается при увеличении потребления белка из-за накопления аммиака, который должен секретироваться в цикле мочевины, что поддерживает роль N-ацетилглутаминовая кислота в качестве кофактора CPSI. Более того, N-ацетилглутаминовую кислоту можно найти во многих обычно потребляемых продуктах, таких как соя, кукуруза и кофе, причем какао-порошок содержит особенно высокую концентрацию.[9]
Дефицит в N-ацетилглутаминовая кислота у человека является аутосомно-рецессивным заболеванием, которое приводит к блокированию выработки мочевины, что в конечном итоге увеличивает концентрацию аммиака в крови (гипераммониемия). Дефицит может быть вызван дефектами гена, кодирующего NAGS, или недостатком предшественников, необходимых для синтеза.[4]
Бактерии
N-Ацетилглутаминовая кислота является вторым промежуточным продуктом в пути производства аргинина в кишечная палочка и производится через NAGS.[5] На этом пути Nкиназа ацетилглутаминовой кислоты (NAGK) катализирует фосфорилирование гамма (третьей) карбоксильной группы N-ацетилглутаминовая кислота с использованием фосфата, производимого гидролиз из аденозинтрифосфат (АТФ).[10]
Корни рассады белого клевера
Ризобий может формировать симбиотические отношения с белый клевер саженцы корни и образуют колонии. Внеклеточный N-ацетилглутаминовая кислота, продуцируемая этими бактериями, оказывает три морфологических эффекта на корни проростков белого клевера: разветвление корневых волосков, набухание кончиков корней и увеличение числа клеточных делений в недифференцированных клетках, обнаруженных на самом внешнем слое клеток корня. . Это говорит о том, что N-ацетилглутаминовая кислота участвует в стимуляции митоза. Такие же эффекты наблюдались на клубничный клевер, но не в бобовые. Эффекты N-ацетилглутаминовая кислота на виды клевера была более сильной, чем эффекты от глутамин, глутамат, аргинин или аммиак.[4]
Структура
N-Ацетилглутаминовая кислота состоит из двух групп карбоновых кислот и амидной группы, выступающей из второго углерода. Структура N-ацетилглутаминовая кислота при физиологических pH (7.4) имеет все карбоксильные группы депротонированный.
Протонная ЯМР-спектроскопия
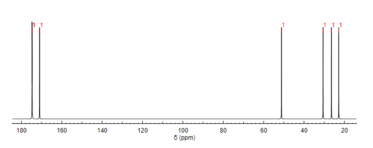
Молекулярная структура N-ацетилглутаминовая кислота определялась с использованием протонная спектроскопия ЯМР.[3] Протонный ЯМР показывает наличие и расположение функциональных групп протонов на основе химические сдвиги записано на спектре.[11]
13C ЯМР спектроскопия
Подобно протонному ЯМР, углерод-13 (13C) ЯМР-спектроскопия - это метод, используемый для определения молекулярной структуры. 1313C ЯМР выявляет типы атомов углерода, присутствующие в молекуле, на основе химических сдвигов, соответствующих определенным функциональным группам. N-Ацетилглутаминовая кислота наиболее отчетливо проявляет карбонильные атомы углерода из-за трех карбонилсодержащих заместителей.[12]
Смотрите также
Рекомендации
- ^ "N-Ацетил-DL-глутаминовая кислота - Резюме соединения ". PubChem Compound. США: Национальный центр биотехнологической информации. 25 марта 2005 г. Идентификация. Получено 25 июн 2012.
- ^ Pubchem. "N-Ацетил L-глютаминовая кислота". pubchem.ncbi.nlm.nih.gov. Получено 2018-06-03.
- ^ а б Филип-Холлингсворт С., Холлингсворт Р.И., Dazzo FB (сентябрь 1991 г.). "N-Ацетилглутаминовая кислота: внеклеточный сигнал узла Rhizobium trifolii ANU843, который вызывает ветвление корневых волосков и узелковые зачатки в корнях белого клевера ". Журнал биологической химии. 266 (25): 16854–8. PMID 1885611.
- ^ а б c d е ж Caldovic L, Tuchman M (июнь 2003 г.). "N-Ацетилглутамат и его меняющаяся роль в процессе эволюции ». Биохимический журнал. 372 (Pt 2): 279–90. Дои:10.1042 / BJ20030002. ЧВК 1223426. PMID 12633501.
- ^ а б Caldara M, Dupont G, Leroy F, Goldbeter A, De Vuyst L, Cunin R (март 2008 г.). «Биосинтез аргинина в кишечная палочка: экспериментальное возмущение и математическое моделирование ». Журнал биологической химии. 283 (10): 6347–58. Дои:10.1074 / jbc.M705884200. PMID 18165237.
- ^ Аудиторе, Джозеф В .; Уэйд, Литтлтон; Олсон, Эрик Дж. (Ноябрь 1966 г.). "Появление N-ацетил-L-глутаминовая кислота в мозге человека ». Журнал нейрохимии. 13 (11): 1149–1155. Дои:10.1111 / j.1471-4159.1966.tb04272.x. ISSN 0022-3042. PMID 5924663.
- ^ Харпер М.С., Аманда Шен З., Барнетт Дж. Ф., Крсманович Л., Майре А., Делани Б. (ноябрь 2009 г.). "N-Ацетилглутаминовая кислота: оценка острой пероральной токсичности и генотоксичности при повторных дозах в течение 28 дней ». Пищевая и химическая токсикология. 47 (11): 2723–9. Дои:10.1016 / j.fct.2009.07.036. PMID 19654033.
- ^ Пелли Дж. В. (2007). «Глава 14: Пурин, пиримидин и одноуглеродный метаболизм». Интегрированная биохимия Эльзевьера. Эльзевир. С. 117–122. Дои:10.1016 / b978-0-323-03410-4.50020-1. ISBN 978-0-323-03410-4.
- ^ Hession AO, Esrey EG, Croes RA, Maxwell CA (октябрь 2008 г.). "N-Ацетилглутамат и N-ацетиласпартат в соевых бобах (Глицин макс Л.), Кукуруза (Zea Mays Л.), [исправлено] и другие продукты питания ». Журнал сельскохозяйственной и пищевой химии. 56 (19): 9121–6. Дои:10.1021 / jf801523c. PMID 18781757.
- ^ Хиль Ортис Ф, Рамон Майкес С., Фита I, Рубио V (август 2003 г.). «Ход фосфора в реакции N-ацетил-L-глутаматкиназа, определяемая по структуре кристаллических комплексов, в том числе комплекса с AlF−
4 имитатор переходного состояния ". Журнал молекулярной биологии. 331 (1): 231–44. Дои:10.1016 / S0022-2836 (03) 00716-2. PMID 12875848. - ^ "Предсказывать 1Спектры протонного ЯМР H ". www.nmrdb.org. Получено 2018-06-03.
- ^ "Предсказывать 13Спектры ЯМР углерода C ». www.nmrdb.org. Получено 2018-06-03.