WikiDer > Фосфорные кислоты и фосфаты
А фосфорная кислота, в общем смысле, является оксокислота фосфора в котором каждый фосфор атом находится в степень окисления +5, и это связанный до четырех кислород атомы, один из них через двойная связь, расположенные как углы тетраэдр. Два или более из них PO
4 тетраэдры могут быть соединены общими атомами кислорода с одинарными связями, образуя линейные или разветвленные цепи, циклы или более сложные структуры. Односвязные атомы кислорода, которые не являются общими, дополнены кислый водород атомы. Общая формула фосфорной кислоты Hп+2−2ИксппО3п+1−Икс, куда п - количество атомов фосфора и Икс это количество фундаментальные циклы в структуре молекулы от 0 до (п+2)/2.
Удаление протоны H + из k гидроксильные группы –OH листья анионы обычно называется фосфаты (если k = п−2Икс+2) или гидрофосфаты (если k находится между 1 и п−2Икс+1) с общей формулой [Hп−2Икс+2−kппО3п+1−Икс]k−. Полностью диссоциированный анион (k = п−2Икс+2) имеет формулу [PпО3п−Икс+1](п−2Икс+2)− Термин также используется в органическая химия для функциональные группы это происходит, когда или несколько атомов водорода заменяются связями с другими группами.
Эти кислоты вместе с их соли и сложные эфиры, включают некоторые из самых известных соединений фосфора, имеющих большое значение в биохимия, минералогия, сельское хозяйство, аптека, химическая индустрия, и химические исследования.
Кислоты
Ортофосфорная кислота
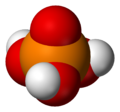
Самая простая и наиболее часто встречающаяся из фосфорных кислот - это ортофосфорная кислота, H3PO4. Действительно, термин фосфорная кислота часто означает именно это соединение (и это тоже текущий ИЮПАК номенклатура).
Олигофосфорная и полифосфорная кислоты
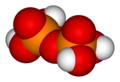
Две или более ортофосфорных кислот молекулы может быть присоединен конденсация в более крупные молекулы за счет устранения воды. Конденсация нескольких единиц дает олигофосфорные кислоты, а молекулы большего размера называются полифосфорные кислоты. (Однако различие между этими двумя терминами четко не определено.)
Например, пирофосфорный, трифосфорный и тетрафосфорный кислоты могут быть получены реакциями
- 2 ЧАС
3PO
4 → ЧАС
4п
2О
7 + ЧАС
2О - ЧАС
4п
2О
7 + ЧАС
3PO
4 → ЧАС
5п
3О
10 + ЧАС
2О - ЧАС
5п
3О
10 + ЧАС
3PO
4 → ЧАС
6п
4О
13 + ЧАС
2О
«Костяк» молекулы полифосфорной кислоты представляет собой цепочку чередующихся атомов P и O. Каждая дополнительная единица ортофосфорной кислоты, которая конденсируется, добавляет 1 дополнительный H (водород) атом, 1 лишний P (фосфор) атома и 3 лишних O (кислород) атомов. Общая формула полифосфорной кислоты: ЧАС
п+2п
пО
3п+1 или HO (–P (O) (OH) –O–)пЧАС.
Полифосфорные кислоты используются в органический синтез за циклизации и ацилирование.[1][2]
Циклические фосфорные кислоты
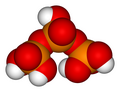
С другой стороны, конденсация между двумя звеньями –OH одной и той же молекулы удаляет два атома водорода и один атом кислорода, создавая цикл, как при образовании триметафосфорная кислота:
- ЧАС
5п
3О
10 → ЧАС
3п
3О
9 + ЧАС
2О
Общая формула фосфорной кислоты Hп−2Икс+2ппО3п−Икс+1, куда п - количество атомов фосфора и Икс это количество фундаментальные циклы в структуре молекулы; то есть минимальное количество связей, которые необходимо разорвать, чтобы устранить все циклы.
Ортофосфорная кислота
ЧАС3PO4Пирофосфорная кислота
ЧАС
4п
2О
7Триполифосфорная кислота
ЧАС
5п
3О
10
Предельный случай внутренней конденсации, когда все атомы кислорода общие и нет атомов водорода (Икс = (п+2) / 2) будет ангидрид ппО5п/2, Такие как пятиокись фосфора п
4О
10.
Фосфаты
Удаление атомов водорода как протоны H + превращает фосфорную кислоту в анион фосфата. При частичном удалении образуются различные анионы гидрофосфата.
Ортофосфат
Анионы ортофосфорной кислоты ЧАС
3PO
4 находятся ортофосфат PO3−
4, гидрофосфат HPO2−
4, и дигидрофосфат ЧАС
2PO−
4
Линейные олигофосфаты и полифосфаты
Диссоциация пирофосфорной кислоты ЧАС
4п
2О
7 генерирует четыре аниона, ЧАС
4-kп
2О−
7k−, где заряд k варьируется от 1 до 4. Последний пирофосфат [П
2О4−
7. В пирофосфаты в основном водорастворимы.
Аналогично, триполифосфорная кислота ЧАС
5п
3О
10 дает не менее пяти анионов [ЧАС
5-kп
3О
10]k−, куда k колеблется от 1 до 5, включая триполифосфат [П
3О5−
10. Тетраполифосфорная кислота ЧАС
6п
4О
13 дает не менее шести анионов, включая тетраполифосфат [П
4О6−
13, и так далее. Обратите внимание, что каждая дополнительная фосфорная единица добавляет один дополнительный атом P, три дополнительных кислород атомов, и либо один дополнительный атом водорода, либо дополнительный отрицательный заряд.
Разветвленные полифосфорные кислоты дают аналогично разветвленные полифосфатные анионы. Самый простой пример этого: трифосфонофосфат [OP (OPO
3)
3]9− и его частично диссоциированные версии.
Общая формула таких (нециклических) полифосфатных анионов, линейных или разветвленных, следующая: [ЧАС
п+2−kп
пО
3п+1]k−, где заряд k может варьироваться от 1 до п+2. Обычно в водный решение, степень или процент диссоциации зависит от pH решения.
Циклические полифосфаты
Единицы фосфорной кислоты могут быть связаны в кольца (циклические структуры), образуя метафосфорная кислота молекулы. Самое простое такое соединение - триметафосфорная кислота или же циклотрифосфорная кислота имеющий формулу H3п3О9. Его структура показана на иллюстрации. Поскольку концы уплотнены, в его формуле на единицу меньше H2О (вода), чем триполифосфорная кислота. Что обычно называют триметафосфаты на самом деле есть смесь размеров колец. Общая формула таких циклических соединений (HPO3)Икс где x = количество фосфорных звеньев в молекуле. Гипотетический мономер монометафосфорная кислота (HPO3), что было бы валентный изоэлектронный с азотная кислота, о существовании не известно.
Когда эти метафосфорные кислоты теряют свои водороды в виде H+, циклический анионы называется метафосфаты сформированы. Примером соединения с таким анионом является гексаметафосфат натрия (Na6п6О18), используемый как секвестрант и пищевая добавка.
Химические свойства
Растворимость
Эти серии фосфорных кислот обычно воды-растворимый принимая во внимание полярность молекул. Аммоний и щелочь фосфаты также хорошо растворяются в воде. В щелочноземельный соли начинают становиться менее растворимыми, а фосфатные соли различных других металлов становятся еще менее растворимыми.
Гидролиз и конденсация
В водных растворах (водных растворах) вода постепенно (в течение нескольких часов) гидролизует полифосфаты на более мелкие фосфаты и, наконец, на ортофосфаты при достаточном количестве воды. Более высокая температура или кислая среда могут ускорить гидролиз. реакции значительно.[3]
И наоборот, полифосфорные кислоты или полифосфаты часто образуются при дегидратации раствора фосфорной кислоты; Другими словами, часто удаляя из него воду, нагревая и выпаривая воду.
Использует
Орто-, пиро- и триполифосфатные соединения обычно используются в моющие средства (т.е. чистящие средства) составы. Например, см. Триполифосфат натрия. Иногда называют пирофосфат, триполифосфат, тетраполифосфат и др. дифосфат, трифосфат, тетрафосфати т. д., особенно когда они являются частью фосфорные эфиры в биохимия. Они также используются для масштабирования и контроль коррозии к поставщики питьевой воды.[4] Как ингибитор коррозии полифосфаты действуют, образуя защитную пленку на внутренней поверхности труб.[5]
Фосфорные эфиры
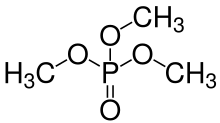
Группы -ОН в фосфорных кислотах также могут конденсироваться с гидроксильные группы из спирты формировать фосфорные эфиры. Поскольку ортофосфорная кислота имеет три группы -ОН, она может этерифицироваться одной, двумя или тремя молекулами спирта с образованием моно-, ди- или триэфира. См. Изображение общей структуры орто- (или моно-) фосфата. сложный эфир внизу слева, где любой из р группы могут быть водородом или органический радикал. Также возможны ди- и триполи- (или три-) сложные эфиры фосфата и т.д. Любые группы -ОН на фосфатах в этих молекулах сложного эфира могут потерять H+ ионы с образованием анионов, опять же в зависимости от pH раствора. В биохимии живых организмов существует много видов (моно) фосфатных, дифосфатных и трифосфатных соединений (в основном сложные эфиры), многие из которых играют важную роль в метаболизме, например аденозиндифосфат (АДФ) и трифосфат (АТФ).
Смотрите также
Рекомендации
- ^ Харвуд, Лоуренс М .; Hodgkinson, Leslie C .; Сазерленд, Джеймс К .; Башни, Патрик (1984). «Синтез антрациклинонов. Часть 1. Региоселективное алкилирование 5-гидроксихинизарина». Канадский химический журнал. 62 (10): 1922–1925. Дои:10.1139 / v84-329.
- ^ Накадзава, Коичи; Мацуура, Шин; Кусуда, Косуке (1954). «Исследования по применению полифосфорной кислоты в качестве конденсирующего агента. II». Якугаку Засши. 74 (5): 495–497. Дои:10.1248 / yakushi1947.74.5_495.
- ^ «Фосфорная кислота и фосфаты». Энциклопедия химической технологии. Нью-Йорк: Interscience Encyclopedia, Inc., 1953. стр. 421.
- ^ «Полифосфаты для защиты от накипи и коррозии». Tramfloc, INC. Январь 2009 г.. Получено 23 декабря, 2010.
- ^ «Ингибиторы орто-полифосфатной коррозии» (PDF). Правительственная инженерия: журнал общественной инфраструктуры (Сентябрь – октябрь 2006 г.): 48–49. Получено 23 декабря, 2010.
- ^ Пармар, Диксит; Сугионо, Эрли; Раджа, Садия; Рупинг, Магнус (2014). "Полное руководство по асимметричной кислоте БИНОЛ-фосфата и металлическому катализу: история и классификация по способу активации; кислотность Бренстеда, водородная связь, образование пар ионов и фосфаты металлов". Химические обзоры. 114 (18): 9047–9153. Дои:10.1021 / cr5001496. PMID 25203602.
дальнейшее чтение
- Шредер Х.С., Курц Л., Мюллер В.Е., Лоренц Б. (март 2000 г.). «Полифосфат в кости» (PDF). Биохимия (Москва). 65 (3): 296–303. Архивировано из оригинал (PDF) на 2011-08-25.