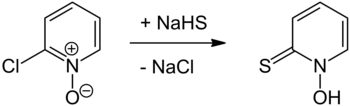WikiDer > Пиритион - Википедия
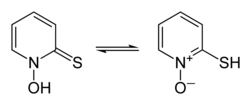 Взаимное превращение таутомеров пиритиона форма тиона слева, форма тиола справа | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC 1-гидрокси-2 (1ЧАС) -пиридинтион (тион) 2-пиридинтиол-1-оксид (тиол) | |
| Другие имена Омадин тион: 1-гидроксипиридин-2-тион N-Гидроксипиридин-2-тион тиол: 2-Меркаптопиридин монооксид 2-меркаптопиридин N-окись 2-меркаптопиридин 1-оксид | |
| Идентификаторы | |
| |
3D модель (JSmol) |
|
| ЧЭБИ | |
| ChemSpider | |
| ECHA InfoCard | 100.013.027 |
PubChem CID | |
| |
| |
| Характеристики | |
| C5ЧАС5NОS | |
| Молярная масса | 127.16 г · моль−1 |
| Внешность | Бежевый кристаллический порошок |
| Температура плавления | От 70 до 73 ° C (от 158 до 163 ° F, от 343 до 346 K) |
| 2,5 г л−1 при 20 ° C | |
| Растворимость | Растворимый: бензол, хлороформ, дихлорметан, диметилформамид, диметилсульфоксид, ацетат этила[1] Слабо растворим: диэтиловый эфир, этиловый спирт, метил терт-бутиловый эфир, тетрагидрофуран[1] |
| Кислотность (пKа) | −1.95, 4.6[2][3] |
| Опасности | |
| R-фразы (устарело) | R20 / 21/22, R36 / 37/38, R63 |
| S-фразы (устарело) | S22, S24 / 25, S26, S36 / 37 |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Пиритион это общее название сероорганическое соединение с молекулярная формула C
5ЧАС
5NOS, выбранный как сокращение от пиридинтион, и найдено в Персидский лук-шалот.[4] Он существует как пара таутомеры, основная форма - тион 1-гидрокси-2 (1ЧАС) -пиридинтион и второстепенная форма тиол 2-меркаптопиридин N-окись; он кристаллизуется в форме тиона.[5] Обычно его готовят либо из 2-бромпиридин,[1] 2-хлорпиридин,[6][7] или же 2-хлорпиридин N-окись,[8] и коммерчески доступен как нейтральное соединение, так и его натрий соль.[1] Используется для приготовления пиритион цинка,[9][10] который используется в основном для лечения перхоть и себорейный дерматит в лечебные шампуни,[11][12] хотя также противообрастающий агент в красках.[13]
Подготовка
О получении пиритиона впервые сообщили в 1950 году.[13] по Шоу[14] и был приготовлен реакцией 2-хлорпиридин N-окись с гидросульфид натрия с последующим подкислением,[8] или совсем недавно с сульфид натрия.[15] 2-хлорпиридин N-оксид может быть получен из 2-хлорпиридин с помощью перуксусная кислота.[16] Другой подход предполагает обработку того же стартового N-оксид с тиомочевина чтобы получить хлорид пиридил-2-изотиоурония N-оксид, который подвергается основному гидролизу до пиритиона.[1][17] 2-бромпиридин может быть окислен до его N-оксид с использованием подходящего перкислота (в отношении 2-хлорпиридина), оба подхода аналогичны описанным в Органический синтез для окисления пиридин к его N-окись.[1][18] А реакция замещения используя либо дитионит натрия (Na
2S
2О
4) или сульфид натрия с едкий натр позволит заменить бромзаместитель на тиол функциональная группа.[1][15]
Альтернативная стратегия - сформировать меркаптан до введения N-окись часть. 2-Меркаптопиридин был первоначально синтезирован в 1931 году путем нагревания 2-хлорпиридина с гидросульфид кальция,[6] подход, аналогичный тому, который впервые использовали для получения пиритиона.[8] Аналогичный подход с использованием тиомочевины с использованием соли урония был описан в 1958 году и обеспечивает более удобный способ получения 2-меркаптопиридина.[7] Окисление до N-оксид может быть проведен.
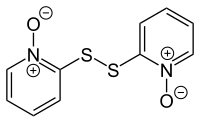
Пиритион встречается как натуральный продукт в Allium stipitatum завод, Азиатский разновидность из лук, также известный как персидский лук-шалот.[4] Его присутствие было обнаружено с помощью положительного иона. масс-спектрометрии используя Источник ионов DART[19] и дисульфид дипиритион (2,2'-дисульфандиилбис (пиридин) -1,1'-диоксид) сообщалось от того же вида.[20] Дипиритион можно получить в лаборатории окислением пиритиона с помощью хлор в присутствии едкий натр:[16]
- 2 C
5ЧАС
4NOSH + Cl
2 + 2 NaOH → ONC
5ЧАС
4–S – S – C
5ЧАС
4НЕТ + 2 NaCl + 2ЧАС
2О
- 2 C
Дипиритион используется как фунгицид и бактерицид,[8] и, как сообщается, обладает романом цитотоксическая активность побуждая апоптоз.[21]
Характеристики
Пиритион существует как пара прототипов, форма таутомерия посредством чего быстрое взаимопревращение конституциональные изомеры включает в себя смещение одного протона, в данном случае между атомами серы и кислорода (показано в информационном окне выше).[3][22][23]
Соли из сопряженное основание пиритиона также можно рассматривать как проявляющее таутомерию, условно связывая ион натрия с любым гетероатомом, несущим отрицательный заряд аниона (в отличие от официальные обвинения связанный с N-окись); однако, рассматривая только анион, это также можно описать как пример резонанс.
Пиритион - слабая кислота с пKа значения -1,95 и +4,6 (тиоловый протон),[2][3] но это заметно более сильная кислота, чем любое из ее исходных соединений (пиридин-N-оксид и пиридин-2-тиол), оба из которых имеют pKа > 8.[22] Он слабо растворяется в воде (2,5 г л−1), но растворим во многих органических растворителях (включая бензол, хлороформ, дихлорметан, диметилформамид, диметилсульфоксид, и ацетат этила) и небольшая растворимость в других (диэтиловый эфир, этиловый спирт, метил терт-бутиловый эфир, и тетрагидрофуран).[1]
Пиритион можно использовать как источник гидроксильный радикал в органическом синтезе[24] поскольку он фотохимически разлагается до HO• и (пиридин-2-ил) сульфанильный радикал.[25]
Приложения
Вершина: Структурная формула мономера.
Нижний: Шариковая модель димера
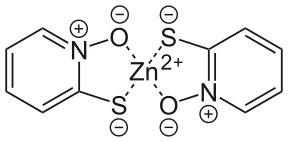
В сопряженное основание пиритиона (пиритионат-ион) является анион содержащий два донорные атомы, атом серы и атом кислорода, каждый из которых несет отрицательный официальное обвинение; атом азота остается формально заряженным положительно. Анион тиолата может быть образован реакцией с карбонатом натрия, и пиритион цинка образуется, когда хлорид цинка добавлен.[10] Анион может действовать как монодентатный или двузубый лиганд и образует 1: 2 сложный с металлическим центром цинк (II). Пиритион цинка используется с 1930-х годов, хотя его получение не было раскрыто до британского патента 1955 года.[13] в котором пиритион непосредственно реагировал с гидратированным сульфат цинка в этаноле.[9] В своем мономерный пиритион цинка имеет два аниона хелатный в цинковый центр с тетраэдрическая геометрия. В твердом состоянии образует димер в котором каждый цинковый центр принимает тригонально-бипирамидная геометрия с двумя анионами, действующими как мостиковые лиганды координируется через атомы кислорода в аксиальных положениях.[26] В растворе димеры диссоциируют через разрыв цинк-кислородных связей с каждым мостиковым лигандом. Дальнейшая диссоциация мономера на его составляющие может происходить и нежелательна, поскольку комплекс более эффективен в медицинских применениях; по этой причине, карбонат цинка может быть добавлен в составы, поскольку он ингибирует диссоциацию мономера.[27]
Пиритион цинка давно используется в лечебные шампуни лечить перхоть и себорейный дерматит[28][29][30] (перхоть можно считать легкой формой себорейного дерматита[12]). Он демонстрирует как противогрибковый и противомикробный свойства, ингибирующие Malassezia дрожжи, которые способствуют возникновению этих состояний кожи головы.[27] Механизмы, с помощью которых работает эта работа, являются предметом постоянного изучения.[31][32] Его можно использовать как антибактериальный агент против Стафилококк и Стрептококк инфекции при таких состояниях, как микоз, экзема, псориаз и стригущий лишай.[13] Известно, что это цитотоксический против Pityrosporum ovale, особенно в сочетании с кетоконазол, который является предпочтительным препаратом при себорейном дерматите.[11] Сам пиритион подавляет процессы мембранного транспорта у грибов.[22][33]
Краски, используемые для наружных работ, иногда содержат пиритион цинка в качестве профилактики от водорослей и плесени.[13][34]
Рекомендации
- ^ а б c d е ж грамм час Рыцарь, Дэвид В .; Хартунг, Йенс (15 сентября 2006 г.). «1-гидроксипиридин-2 (1H) -тион». 1-гидроксипиридин-2 (1ЧАС) -тион. Энциклопедия реагентов для органического синтеза. Джон Уайли и сыновья. Дои:10.1002 / 047084289X.rh067.pub2. ISBN 0471936235.
- ^ а б Родригес Мелладо, Хосе Мигель; Марин Гальвин, Рафаэль; Руис Монтойя, Мерседес (2004). «Антропогенные загрязнители окружающей среды: электрохимические исследования гербицидов и фунгицидов». В Бриллас Косо, Энрик; Кэбот Джулия, Пере-Луис (ред.). Тенденции в электрохимии и коррозии в начале 21 века: Посвящается профессору доктору Хосепу М. Коста по случаю его 70-летия. Edicions Universitat Barcelona. С. 335–358. ISBN 9788447526390.
- ^ а б c Джонс, Р. Алан; Катрицкий, А. (1960). "N-оксиды и родственные соединения. Часть XVII. Таутомерия меркапто- и ациламинопиридин-1-оксидов ». J. Chem. Soc.: 2937–2942. Дои:10.1039 / JR9600002937.
- ^ а б Ebrahimia, R .; Zamani, Z .; Каш, А. (2009). «Оценка генетического разнообразия дикого персидского лука-шалота (Лук хиртифолиум Boiss.) С использованием морфологических и RAPD-маркеров ». Sci. Hortic. 119 (4): 345–351. Дои:10.1016 / j.scienta.2008.08.032.
- ^ Бонд, Эндрю; Джонс, Уильям (1999). "1-Гидрокси-2 (1ЧАС) -пиридинтион ». Acta Crystallogr. C. 55 (9): 1536–1538. Дои:10.1107 / S0108270199006824.
- ^ а б Räth, C .; Binz, A .; Рэт, К. (1931). "Mercaptane und Sulfosäuren des Pyridins. XII. Mitteilung über Derivate des Pyridins". Justus Liebigs Ann. Chem. (на немецком). 487: 105–119. Дои:10.1002 / jlac.19314870107.
- ^ а б Jones, R.A .; Катрицки, А. Р. (1958). «721. Таутомерные пиридины. Часть I. Пирид-2- и -4-тион». J. Chem. Soc.: 3610–3613. Дои:10.1039 / JR9580003610.
- ^ а б c d Вход на Пиритион. в: Römpp Online. Георг Тиме Верлаг, получено 15 декабря 2016 г.
- ^ а б США предоставили 2809971, Bernstein, Jack & Losee, Kathryn A., "Производные тяжелых металлов 1-гидрокси-2-пиридинетионов и способ их получения", опубликовано 1957-10-15, передано Олин Мэтисон
- ^ а б США предоставили 4396766, Фармер, Дэвид А. и Кац, Лоуренс Э., «Процесс производства пиритиона натрия и цинка», опубликовано 2 августа 1983 г., назначено Олин Корпорация
- ^ а б Гупта, Мринал; Махаджан, Викрам К .; Mehta, Karaninder S .; Чаухан, Пушпиндер С. (2014). «Цинковая терапия в дерматологии: обзор». Дерматол. Res. Практик. 2014: 1–11. Дои:10.1155/2014/709152. ЧВК 4120804. PMID 25120566.
- ^ а б Чернов, Карен; Лин, Ричи; Коэн, Стивен Р. (2014). "Себорейный дерматит". В Рудикоффе, Дональде; Коэн, Стивен Р .; Шейнфельд, Ной (ред.). Атопический дерматит и экзематозные заболевания. CRC Press. С. 275–288. ISBN 9781840766530.
- ^ а б c d е «Молекула недели: пиритион цинка». Американское химическое общество. 10 февраля 2014 г.. Получено 23 апреля 2020.
- ^ Шоу, Эллиотт; Бернштейн, Джек; Лоси, Кэтрин; Лотт, В. А. (1950). «Аналоги аспергилловой кислоты. IV. Замещенный 2-бромпиридин-N-оксиды и их превращение в циклические тиогидроксамовые кислоты ». Варенье. Chem. Soc. 72 (10): 4362–4364. Дои:10.1021 / ja01166a008.
- ^ а б Ченг, Хэфэн; Она, Джи (1990). «14. Улучшенный препарат 2-меркаптопиридина-N-окись". Чжунго Ияо Гонге Зачжи. 21 (2): 55–56.
- ^ а б Унгер, Томас А. (1996). «Дипиритион». Справочник по синтезу пестицидов. Нойес Публикации. п. 853. ISBN 9780815518532.
- ^ Thomas, K .; Джерчел, Д. (1964). «Введение заместителей в пиридиновое кольцо». В Фёрсте, Вильгельм; Бирнбаум, Генри (переводчик) (ред.). Новые методы препаративной органической химии. 3. Академическая пресса. С. 53–110. ISBN 9780323146104.
- ^ Mosher, H.S .; Тернер, Л .; Карлсмит, А. (1963). «Пиридин-N-окись". Органический синтез. Дои:10.15227 / orgsyn.033.0079.; Коллективный объем, 4, п. 828
- ^ Блок, Эрик; Датчанин, А. Джон; Коди, Роберт Б. (2011). «Измельчение чеснока и нарезка лука: обнаружение сульфеновых кислот и других реакционноспособных сероорганических соединений из чеснока и других луковиц с использованием прямого анализа в масс-спектрометрии в реальном времени (DART-MS)». Фосфор сера. 186 (5): 1085–1093. Дои:10.1080/10426507.2010.507728. S2CID 98520689.
- ^ О'Доннелл, Джемма; Poeschl, Rosemarie; Зимхони, Орен; Гунаратнам, Мекала; Moreira, Joao B.C .; Нейдл, Стивен; Евангелопулос, Димитриос; Бхактах, Санджиб; Малкинсон, Джон П .; Boshoff, Елена I .; Ленертс, Энн; Гиббонс, Саймон (2009). «Биоактивный пиридин-N-оксид дисульфидов из Allium stipitatum". J. Nat. Prod. 72 (3): 360–365. Дои:10.1021 / np800572r. ЧВК 2765505. PMID 19093848.
- ^ Фан, Юмей; Лю, Цайчжи; Хуанг, Юнмао; Чжан, Цзе; Цай, Линлинь; Ван, Шэннань; Чжан, Юнцзе; Дуань, Сянлинь; Инь, Чжимин (2013). «Дипиритион вызывает остановку клеточного цикла и апоптоз в четырех линиях раковых клеток. in vitro и подавляет рост опухоли на мышиной модели ». BMC Pharmacol. Toxicol. 14 (54): 54. Дои:10.1186/2050-6511-14-54. ЧВК 4015681. PMID 24139500.
- ^ а б c Чендлер, Кэрол Дж .; Сегел, Ирвин Х. (1978). «Механизм антимикробного действия пиритиона: влияние на мембранный транспорт, уровни АТФ и синтез белка». Антимикробный. Агенты Chemother. 14 (1): 60–68. Дои:10.1128 / AAC.14.1.60. ЧВК 352405. PMID 28693.
- ^ Катрицки, Алан Р.; Эльгуэро, Хосе (1976). Таутомерия гетероциклов. Академическая пресса. ISBN 9780120206513.
- ^ Смит, Майкл Б. (2013). Мартовская продвинутая органическая химия (7-е изд.). Вайли. п. 246. ISBN 978-0-470-46259-1.
- ^ ДеМаттео, Мэтью П .; Пул, Джеймс С .; Ши, Сяофэн; Сачдева, Ракеш; Хэтчер, Патрик Дж .; Хадад, Кристофер М .; Платц, Мэтью С. (2005). "Об электрофильности гидроксильных радикалов: лазерный импульсный фотолиз и вычислительное исследование". Журнал Американского химического общества. 127 (19): 7094–7109. Дои:10.1021 / ja043692q. ISSN 0002-7863. PMID 15884952.
- ^ Barnett, B.L .; Kretschmar, H.C .; Хартман, Ф. А. (1977). «Структурная характеристика бис (N-оксопиридин-2-тионато) цинк (II) ». Неорг. Chem. 16 (8): 1834–1838. Дои:10.1021 / ic50174a002.
- ^ а б Trüeb, Ralph M .; Ли, Вон-Су (2014). «6.2.5 - Перхоть». Мужская алопеция: руководство к успешному лечению. Springer Science & Business Media. С. 247–250. ISBN 9783319032337.
- ^ Маркс, Р .; Pearse, A.D .; Уокер, А. П. (1985). «Влияние шампуня, содержащего пиритион цинка, на борьбу с перхотью». Br. J. Dermatol. 112 (4): 415–422. Дои:10.1111 / j.1365-2133.1985.tb02314.x. PMID 3158327. S2CID 23368244.
- ^ Фаэргеманн, Ян (2000). «Лечение себорейного дерматита и разноцветного лишая». Являюсь. J. Clin. Дерматол. 1 (2): 75–80. Дои:10.2165/00128071-200001020-00001. PMID 11702314. S2CID 43516330.
- ^ Бэкон, Роберт А .; Мидзогути, Харуко; Шварц, Джеймс Р. (2014). «Оценка терапевтической эффективности лечения кожи головы от перхоти и себорейного дерматита, часть 1: надежный и актуальный метод, основанный на шкале отслаивания кожи головы (ASFS)». J. Dermatolog. Относиться. 25 (3): 232–236. Дои:10.3109/09546634.2012.687089. PMID 22515728. S2CID 30707098.
- ^ Чендлер, Кэрол Дж .; Сегел, Ирвин Х. (1978). «Механизм антимикробного действия пиритиона: влияние на мембранный транспорт, уровни АТФ и синтез белка». Антимикробный. Агенты Chemother. 14 (1): 60–68. Дои:10.1128 / AAC.14.1.60. ЧВК 352405. PMID 28693.
- ^ Reeder, N.L .; Xu, J .; Youngquist, R. S .; Шварц, Джеймс Р .; Rust, R.C .; Сондерс, К. В. (2011). «Противогрибковый механизм действия пиритиона цинка». Br. J. Dermatol. 165 (s2): 9–12. Дои:10.1111 / j.1365-2133.2011.10571.x. PMID 21919897. S2CID 31243048.
- ^ Ермолаева, Елена; Сандерс, Дейл (1995). "Механизм индуцированной пиритионом деполяризации мембраны в Neurospora crassa". Appl. Environ. Microbiol. 61 (9): 3385–3390. Дои:10.1128 / AEM.61.9.3385-3390.1995. ЧВК 167618. PMID 7574648.
- ^ Патент США 4039312, Джозеф, Марсель и Патру, Гастон, «Бактериостатические, фунгистатические и альгицидные композиции, особенно для подводных красок», опубликовано 2 августа 1977 года, передано Джозефу, Марселю и Патру, Гастону.